Авторами проведен анализ проблематики диагностических шкал острого аппендицита, приведены результаты сравнительного методологического анализа существующих диагностических шкал, на основе которого предложены единые принципы и алгоритмы их разработки и сравнительной оценки. Показано несоответствие ранее созданных диагностических шкал острого аппендицита современным требованиям по его диагностике. С целью оптимизации диагностики острого аппендицита на основе предложенных единых методологических принципов и разработанных алгоритмов разработана оригинальная клинико-соноскопическая шкала острого деструктивного аппендицита и алгоритм ее применения. Представлен результат оценки её клинической эффективности и проведен сравнительный анализ с нестандартизованным клинико-соноскопическим методом диагностик диагностики острого деструктивного аппендицита и диагностической шкалой острого аппендицита Alvarado в рамках проспективного исследования.
Ключевые слова: острый аппендицит, диагностическая шкала, Alvarado
Острый аппендицит (ОА) входит в тройку самых распространённых острых хирургических заболеваний, вероятность возникновения которого в течение жизни составляет около 7 % [7], а летальность при ОА и его осложнениях в различных возрастных группах колеблется от 0,1 % до 15 % [14].
Со времени первого описания в 1839 г. Bright и Addison клинической картины ОА основным методом его диагностики по-прежнему остается клинический [5].
По всеобщему признанию, наивысшую чувствительность и специфичность в диагностике ОА демонстрирует лапароскопия [1,6]. Однако, данный метод еще не распространён повсеместно и не может быть использован на догоспитальном этапе диагностики ОА.
МСКТ и МРТ отличаются высокой точностью диагностики ОА. Однако, использование данных методик в условиях ургентной хирургии доступно только в ограниченном количестве в крупных лечебных учреждениях, имеют ряд ограничений и противопоказаний, а также осложнений при их проведении [15].
Наиболее широко в клинической практике используется УЗИ, которое может применяться во всех ЛПУ и не имеет противопоказаний к применению [15].
Несмотря на огромный опыт, клинические классификации ОА до настоящего времени содержат понятие недеструктивных форм ОА, а клинические руководства и рекомендации по его лечению допускают выполнение аппендэктомии при недеструктивных формах ОА, что значительно увеличивает сроки нетрудоспособности населения и расходы на лечение ОА [11].
До настоящего времени так и не были сформулированы диагностические стандарты ОА и само понятие «достаточности» объёма диагностических мероприятий.
В 1983г. Ira Teicher et al. [16] предложил одну из первых диагностических шкал (ДШ) ОА. С этого времени было предложено более полутора десятков различных ДШ ОА, однако, они так и не стали основным диагностическим методом при ОА [18].
Современным направлением совершенствования клинических ДШ ОА является включение в них ультразвуковых (УЗ) признаков ОА, что уже показало их более высокую клиническую эффективность [3,17].
Однако, все ДШ ОА были составлены на основе устаревших классификаций ОА с включением в них недеструктивных форм ОА, которые с современных позиций не являются показанием к удалению червеобразного отростка (ЧО). Результатом этого являлось чрезмерно высокое (до 53,8 %) количество «напрасных» аппендэктомий [17].
До настоящего времени не дана организационно-правовая оценка ДШ ОА и не сформулирована единая методологическая основа их создания и сравнительного анализа.
Необходимость улучшения диагностики и результатов лечения острого деструктивного аппендицита (ОДА) путём формулирования организационно-правовой основы ДШ ОА, систематизации методологических принципов их создания и сравнительного анализа, создания современной клинико-соноскопической шкалы (КСШ) ОДА и определило актуальность проводимого исследования.
Целью проводимого исследования являлосьулучшение качества лечения больных с ОДА, путём стандартизации и оптимизации требований к формированию ДШ ОА и создания на их основе более эффективной оригинальной КСШ ОДА.
Задачами исследования являлись:
- Дать организационно-правовую оценку ДШ ОА в современной хирургической практике и осуществить их системный методический анализ (МА).
- Сформулировать единые методологические принципы создания ДШ ОА, алгоритмов их применения и сравнительного анализа.
- Разработать оригинальную КСШ ОДА и алгоритм её применения на основе единых методологических принципов.
- Оценить эффективность оригинальной КСШ ОДА и провести её сравнительную оценку с традиционной нестандартизованной КС диагностикой ОДА и с ДШ ОА Alvarado.
Материалы и методы
Настоящая работа представляет собой проспективное нерандомизированное одноцентровое исследование.
Для проведения МА ДШ ОА нами были отобраны наиболее распространенные клинические ДШ ОА: Alvarado [7], Christian [10], RIPASA [9], Lintula [13], Eskelinen (в модификации H. Sitter) [12], а также ДШ ОА, сочетающие клиническую и УЗ диагностику (КСШ ОА): Tzanakis [17] и Натрошвили [3].
Критерием отбора ДШ ОА являлась доступность предоставленных авторами данных по их разработке и оценке.
МА ранее разработанных ДШ (Табл. 1) ОА включал в себя оценку дизайна исследования (ретроспективное, проспективное); метода статистической обработки полученных результатов, формы ОА при разработке ДШ (не деструктивные и деструктивные); популяция, на которой разрабатывалась ДШ ОА и область применения, рекомендованная авторами; показания, противопоказания, условия применения ДШ ОА (диагностический алгоритм), указанные авторами; наличие или отсутствие «серой» зоны ДШ ОА; количество и характер интерпретаций результатов ДШ ОА.
Создание оригинальной КСШ ОДА было проведено на основе обследования 408 пациентов, поступивших в НУЗ «Дорожная клиническая больница на ст. Хабаровск-1 ОАО «РЖД» в период с 1.04.2013 г. по 02.11.2015 г. с подозрением на ОА.
Критериями включения пациентов в исследование явились: направительный диагноз при поступлении «ОА»; согласие пациентов на проведение исследования; возраст 18 лет и старше.
Критериями исключения пациентов из исследования являлись: отказ от обследования; возраст, младше 18 лет; беременность (вне зависимости от сроков); наличие поражений ЦНС, препятствующих сбору жалоб и анамнеза заболевания; отказ от контрольного осмотра через 1 месяц после первичного обращения при исключении ОА; невозможность осмотра пациента самим исследователем с выполнением УЗ исследования (УЗИ) по различным причинам. На основании этих критериев из анализа были исключены 26 пациентов.
Минимальный возраст обследованных составил 18 лет, максимальный возраст — 87 лет, средний возраст — 35,5±15,4 лет. Соотношение мужчин и женщин составило 1:1,5.
У 136 пациентов диагностирован ОДА и у 246 пациентов этот диагноз был исключен.
В соответствии с дизайном исследования, у всех пациентов фиксировались возраст, пол, контактные данные, проводился общеклинический осмотр, включавший: сбор жалоб, анамнеза заболевания и жизни, термометрию, определение наиболее распространенных симптомов ОА. Всем пациентам выполнялись общий анализ крови (ОАК) и общий анализ мочи (ОАМ).
УЗИ брюшной полости проводилось по методике дозированной компрессии [69,129] с помощью конвексного датчика с частотой 3,5–5 Mhz. Осматривалась зона червеобразного отростка (ЧО) и наибольшей болезненности. Для регистрации были отобраны прямые и косвенные УЗ признаки ОДА [13].
Данные пациентов вносились в созданную нами «Форму регистрации пациентов».
Окончательный диагноз ОДА устанавливался по данным патогистологического исследования (ПГИ) ЧО.
Сравнение показателей диагностической эффективности проводилось при помощи вычисления критерия ƛ2 (кси-квадрат).
Разработка оригинальной КСШ ОДА проводилась посредством первичного отбора демографических, анамнестических, клинических, лабораторных, УЗ признаков пациентов первой группы, встречаемость которых статистически значимо различалась с p < 0,001 при наличии ОДА и без такового.
Данные различия устанавливались с использованием критерия ƛ2.
Отобранные признаки были подвергнуты статистическому анализу (СтА) с использованием многофакторного статистического анализа (МСтА).
Сравнение различий показателей информативности различных методов диагностики проводилось при помощи вычисления критерия ƛ2.
Результаты иобсуждение
Диагностика ОА по-прежнему практически полностью основывается на его клинических проявлениях (симптомах).
Более 100 лет хирургами всего мира накапливался практический опыт диагностики ОА. Выборка наиболее значимых клинических симптомов, лабораторных и УЗ-признаков ОДА с созданием на их основе диагностического алгоритма составляет основу ДШ ОДА, которые с организационно-правовой точки зрения являются клиническим диагностическим стандартом, что определяет их место и значимость в современной хирургии ОДА и необходимость дальнейшего совершенствования.
В настоящее время предложено около 20 вариантов ДШ ОА и их модификаций, имеющие как общее сходство, так и принципиальные различия [18].
До настоящего времени единых требований к формированию ДШ ОА и их алгоритмам, позволяющих осуществлять дальнейшее их совершенствование и производить сравнительную оценку не существует.
МА ДШ ОА показывает, что они представляют из себя перечень наиболее часто встречающихся клинических симптомов и инструментально-лабораторных признаков ОА с присвоенной каждому из них балльной оценкой, которая в ряде ДШ ОА отражает степень их диагностической значимости.
ДШ ОА является инструментом для получения суммы баллов у каждого обследуемого пациента. Дальнейшие действия врача определяет алгоритм использования ДШ ОА.
Обязательным для создаваемых алгоритмов является формирование групп пациентов, у которых на основании применения ДШ ОА и алгоритма её использования определяется наличие или отсутствие диагноза ОА. Формирование же промежуточных групп пациентов и действия врача в них является произвольным для каждого из авторов.
Ряд ДШ ОА разрабатывались на основе ограниченных по возрасту и территориальному принципу популяций и не могут быть использованы в других популяциях пациентов с ОА.
Во всех ранее предложенных ДШ ОА авторами приводятся резко завышенные оценочные показатели их клинической эффективности за счет выполнения аппендэктомий при недеструктивных формах ОА, доля которых по их же данным составила до 53,8 % [17].
Нами установлено, что оптимальным для принятия решения врачом на её основе является получение однозначного заключения о наличии или отсутствии ОА.
Большинство алгоритмов использования ДШ ОА имеют промежуточный результат, представляющий диапазон полученных значений ДШ ОА, не позволяющих однозначно высказаться о диагнозе ОА. Для его обозначения мы предлагаем для него понятие «серой зоны» результатов ДШ ОА. Считаем, что «серая зона» при клинической диагностике ОА является обязательной и её отсутствие неминуемо приводит к гипердиагностике ОА или выполнению «необоснованных» аппендэктомий. Размер «серой зоны» ДШ ОА, указывает на диагностическую значимость каждого из предложенных вариантов ДШ ОА и является одной из характеристик ДШ ОА.
Считаем необходимым ввести принцип направленности ДШ только на диагностику ОДА, который по общему признанию является показанием к хирургическому лечению [4]. Учет только ОДА является фактором оптимизации ДШ ОА.
Данные МА анализируемых ДШ ОА представлен в таблице 1.
Различие методов СтА ДШ ОА, характеристик входящих в них исследуемых групп пациентов, количество и формулировки интерпретаций результатов применения ДШ ОА, предполагают отсутствие их стандартизации и значительную вариабельность полученных результатов при использовании в других популяциях пациентов.
На основании МА существующих ДШ ОА нами сформулированы единые принципы их формирования:
1) Использование проспективного характера исследования.
2) Применение МСтА полученных результатов.
3) Разработка ДШ ОА для определённой популяции пациентов.
4) Однозначность интерпретации результата ДШ ОА (подтверждение, исключение, «серая зона»).
5) Определение показаний и противопоказаний к применению каждой из ДШ ОА.
6) Создание ДШ ОА только на результатах анализа лечения деструктивных форм ОА.
7) Чёткое определение в характеристике ДШ ОДА используемых методов диагностики (клинические, лабораторные (общеклинические, специальные биохимические) и инструментальные (соноскопические и т. д.)).
Проведенный нами МА ДШ ОА и их алгоритмов показал, что ни одна из них по совокупности составляющих не отвечает сформулированным нами единым методологическим принципам.
На основе этих принципов нами предложен алгоритм формирования ДШ ОА (Табл.2), который определяет этапность их формирования с конкретными задачами, методы исследования, объект исследования и изучаемые явления, параметры учета результатов каждого из этих этапов.
Наиболее часто оценка эффективности ДШ ОА в оригинальных статьях и в последующих работах, изучающих применение ДШ ОА производится на основании расчетов показателей чувствительности, специфичности и точности диагностики ОА [3,7,9,10,12,13,16,17,18], значения которых по данным авторов превышают 80–90 %.
Таблица 1
Методологический анализ ДШ ОА
|
Название ДШ ОА |
Параметры МА ДШ ОА |
||||||
|
Дизайн исследования |
Метод СтА |
Учет форм ОА |
Особенности популяции |
Наличие иструктура алгоритма ДШ |
Наличие «серой» зоны |
Кол-во заключений алгоритма ДШ |
|
|
Alvarado |
Ретроспективное |
Однофакторный |
Все формы ОА |
Нет |
Не указывается |
Имеется |
4 |
|
Eskelinen в модификации H. Sitter |
Проспективное |
Многофакторный (логистическая регрессия) |
Нет данных |
Нет |
Не указывается |
Имеется |
3 |
|
Tzanakis |
Проспективное |
Многофакторный (логистическая регрессия) |
Все формы ОА |
Нет |
Указывается, но не указаны критерии включения и исключения |
Отсутствует |
2 |
|
Натрошвили |
Ретроспективное |
Не известен |
Все формы ОА |
Нет |
Указывается |
Отсутствует |
3 |
|
Christian |
Проспективное |
Отсутствует |
Нет данных |
Нет |
Указывается |
Имеется |
3 |
|
Lintula |
Проспективное |
Многофакторный (логистическая регрессия) |
ОДА |
Дети |
Не определена тактика в «серой» зоне значений ДШ |
Имеется |
3 |
|
RIPASA |
Ретроспективное |
Многофакторный (логистическая регрессия) |
Нет данных |
Азиатская |
Не указывается |
Имеется |
4 |
Таблица 2
Алгоритм формирования ДШ ОА
|
№ |
Этапы формирования ДШ ОА иих задачи |
Метод исследования |
Объект исследования иизучаемое явление |
Результат исследования |
|
|
Объект исследования |
Изучаемое явление |
||||
|
|||||
|
1 |
Планирование ДШ (определение цели, характера популяции обследуемых пациентов, структуры ДШ по методам исследования, определение критериев включения и исключения) |
- |
Конкретная популяция пациентов |
Возможность применения ДШ |
Определение цели, показаний и противопоказаний использования ДШ ОА, структуры ДШ по методам исследования. |
|
2 |
Сбор клинического материала |
Проспективное исследование |
Популяция пациентов с подозрением на ОА |
Симптомы заболевания, лабораторные и инструментальные признаки |
Получение базы данных для СтА |
|
3 |
Сравнение частоты встречаемости учитывавшихся признаков |
Однофакторный СтА |
Результаты обследования пациентов из сформированной базы данных |
Клинические симптомы, лабораторные и инструментальные признаки. |
Отбор признаков, статистически значимо чаще встречающихся у пациентов с ОА |
|
4 |
Определение признаков ДШ определение симптомов, оказывающих наибольшее взаимное влияние на установку диагноза ОА) |
МСА |
Пациенты из сформированной базы данных |
Клинические симптомы, лабораторные и инструментальные признаки. |
Отбор признаков (компонентов) ДШ ОА |
|
5 |
Определение балльной оценки для отобранных признаков (компонентов) ДШ ОДА |
МСА |
Пациенты из сформированной базы данных |
Отобранные на предыдущем этапе признаки (компоненты) ДШ ОДА |
Присвоение баллов признакам (компонентам) ДШ ОА |
|
II. Формирование алгоритма использования ДШ ОА |
|||||
|
6 |
Интерпретация сумм баллов ДШ ОДА |
Сравнительный анализ чувствительности, специфичности ДШ ОА при различных суммах баллов |
Популяция обследованных пациентов |
Информативность ДШ ОДА при ее различных значениях |
Определение диапазонов баллов ДШ ОДА для заключения о наличии ОА, его отсутствии, выделение «серой» зоны ДШ ОА |
Однако ими учитываются как деструктивные, так и не деструктивные формы ОА. Не ясна методика их расчетов, учёт значения ДШ ОА, попадающих в «серую зону».
Использование авторами дополнительных методов обследования, позволивших установить диагноз, уже выходит за рамки ДШ ОА. Предполагаем, что случаи, попадающие в «серую зону» ДШ ОА при расчете этих показателей, следует учитывать только как ложно-положительные или ложно-отрицательные.
Традиционно используемый критерий оценки ДШ ОА «напрасная аппендэктомия» является неправомочным поскольку характеризует больше интраоперационную тактику, нежели диагностическую эффективность метода на дооперационном этапе обследования.
Несмотря на то, что в литературе неоднократно указываются факты зависимости диагностики ОА от возраста, ожирения, анатомического расположения ЧО и других обстоятельств, которые можно обозначить как «факторы риска» диагностических ошибок ОА, ни одним из авторов не исследована диагностическая информативность ДШ ОА от них и не сформулирован их перечень.
Считаем, что субпопуляции обследуемых пациентов должны формироваться с учётом «факторов риска» диагностических ошибок ОА, которые уже определены или ещё будут определены в дальнейших исследованиях.
Одним из важных критериев оценки диагностической эффективности ДШ ОДА и алгоритма её использования считаем оценку наличия и параметров «серой зоны», Чем больше размер «серой зоны», тем меньше диагностическая ценность рассматриваемой ДШ. Значение «серой зоны» ДШ ОА более 15 % обследуемых пациентов предлагаем считать неудовлетворительным результатом.
Дополнительно к размеру «серой зоны» важным критерием оценки ДШ ОДА предлагаем осуществлять расчет доли ОДА «серой зоны» от общего количества случаев ОДА, которая определяет эффективность выделения «серой зоны» и её сбалансированность.
На основе МА, нами предложен алгоритм сравнительной оценки ДШ ОДА (Табл. 3), который включает в себя структурный и функциональный анализ.
Структурный анализ оценивает как ДШ ОА, так и её алгоритма.
Разработка КСШ ОДА проводилась в соответствии с предложенным нами алгоритмом.
Модель пациента (возрастная категория) — взрослые. Нозологическая форма — ОДА. Код по МКБ-10 — K 35.3, К35.8. Фаза — острое состояние. Стадия — первое обращение. Осложнения — без разлитого перитонита, плотного аппендикулярного инфильтрата. Условия оказания — приемное отделение стационара. Показания — подозрение на ОДА.
Таблица 3
Алгоритм сравнительного анализа ДШ ОА иих алгоритмов применения
|
Вид сравнительного анализа |
Анализируемый элемент |
Показатели сравнительного анализа |
|
Структурный |
ДШ ОА |
Форма ОА (недеструктивные формы, деструктивные формы) Область применения Противопоказания (ограничения применения) Характер исследования (проспективное, ретроспективное) Характер методов обследования пациентов Характер популяции обследуемых Метод СтА (однофакторный, многофакторный). Характер определения баллов признаков ДШ |
|
Алгоритм ДШ ОА |
Количество и характер трактовки результатов ДШ ОА. Наличие «серой зоны» результатов ДШ ОА Размер «серой зоны» результатов ДШ ОА |
|
|
Функциональный |
ДШ ОА и ё алгоритм |
Чувствительность Специфичность Точность Количество недиагностированных случаев деструктивного ОА и их отношение (%) ко всем случаям деструктивного ОА Количество случаев деструктивного ОА в «серой зоне» и их отношение (%) ко всем случаям деструктивного ОА Наличие и перечень «факторов риска» диагностики ОА. |
Противопоказания к применению КСШ ОДА мы разделяем на 3 группы.
В первую входят критерии исключения для пациентов, принятые при проведении исследования: возраст <18, беременность. Во вторую группу противопоказаний входят условия, которые не позволяют обеспечить полноценное применение ДШ ОДА: отсутствие возможности выполнения УЗИ и лабораторного исследования; невозможность собрать анамнез у пациентов в результате психических нарушений, нарушения интеллекта; состояния алкогольного, наркотического опьянения и отравления токсическими веществами, нарушение сознания в 14 и менее баллов по шкале Glasgow, энцефалопатия 3 степени, языковой барьер (иностранные пациенты). В третью группу входят клинические синдромы, наличие которых снижает информативность ДШ: распространенный перитонит, пальпируемое опухолевидное образование в правой подвздошной области
КСШ ОДА предназначена для применения в условиях стационара.
Нами был обследован 201 пациент, в возрасте от 18 лет до 87 лет, поступивший в приемное отделение НУЗ «Дорожная клиническая больница на ст. Хабаровск-1 ОАО «РЖД» с диагнозом «ОА».
Средний возраст пациентов составил 34,9±15 лет. Из них мужчин было 86 (42,8 %) и женщин — 115 (57,2 %).
Средний ИМТ общей популяции пациентов составил 25±5,6 кг/м2 и пациентов с диагностированным ОДА — 25,9±5,2 кг/м2.
У 85 (42,3 %) пациентов был диагностирован ОДА и у 116 (57,7 %) пациентов этот диагноз был исключен.
Аппендэктомия была выполнена 106 (52,7 %) пациентам.
Из них аппендэктомия без диагностической лапароскопии была выполнена 85 пациентам, что составило 42,3 % от общего количества пациентов. Из них ОДА был подтвержден при ПГИ у 69 пациентов (81,2 % от первично оперированных). «Напрасная» аппендэктомия выполнена у 17 человек (20 % от выполненных аппендэктомий).
В 43 (21,4 %) случаях выполнена диагностическая лапароскопия, при которой у 15 (34,9 %) пациентов был диагностирован ОДА. Из них «напрасная» аппендэктомия выполнена у 8 (18,6 %) пациентов. У 2 (4,7 %) пациентов была выявлена другая острая хирургическая патология.
У 73 (36,3 %) пациентов ОДА был исключен только клинически. Из них в 1 (0,04 %) случае оказался не диагностированным ОДА.
Типичное расположение ЧО имелось у 62 пациентов (63,1 % от общего количества оперированных) и атипичное — у 38 (36,9 %) пациентов.
Далее нами были подвергнуты раздельному анализу результаты обследования пациентов с ОДА и без ОДА.
В исследуемой группе пациентов была изучена встречаемость таких клинических симптомов как миграция болей в правую подвздошную область из других отделов брюшной полости, симптом Кохера, снижение аппетита, субъективное ощущение локальной боли в правой подвздошной области, жалобы на тошноту или рвоту, постоянный характер боли в животе, локальная болезненность при пальпации в правой подвздошной области, напряжение в правой подвздошной области при пальпации; симптомы Щёткина-Блюмберга Ситковского, Бартомье-Михельсона, Коупа, Промптова, Образцова, Ровзинга; гипертермия > 37,4С при подмышечной термометрии, болезненность передней стенки прямой кишки при пальцевом ректальном исследовании.
У обследуемых пациентов так же были зарегистрированы такие изменения лабораторных показателей, как повышение количества лейкоцитов в ОАК >10*109/л, увеличение доли нейтрофильных лейкоцитов в лейкоцитарной формуле >74 %, увеличение доли палочкоядерных лейкоцитов в лейкоцитарной формуле >6 %, ЛИИ > 1,6, отсутствие патологических изменений в ОАМ.
Регистрировались такие УЗ признаки как увеличение диаметра ЧО >7 мм, несжимаемость ЧО при компрессии УЗ датчиком, симптом «мишени», наличие копролита в просвете ЧО, утолщение периаппендикулярной клетчатки, наличие свободной жидкость в брюшной полости, усиление кровотока в стенке ЧО при допплеровском исследовании, УЗ признаки неизмененного ЧО или другой патологии правого нижнего квадранта живота.
Для каждого регистрировавшегося признака ОДА была создана четырехпольная таблица, рассчитано отношение шансов с доверительным интервалом. Сравнение качественных признаков у пациентов с ОДА и без него произведено с помощью критерия Пирсона ƛ2.
Для разработки оригинальной КСШ ОДА и проведения МСтА были отобраны признаки ОДА, различия в которых между двумя подгруппами было статистически значимым с p < 0,001.
С целью отбора признаков, оказывающих наибольшее взаимное влияние надиагностику ОДА, с помощью модуля логистической регрессии в программе Statistica 6.0 Stat Soft Inc. проведен МСтА ранее выбранных признаков.
Наибольшее взаимное влияние, будучи включенными в уравнение логистической регрессии, продемонстрировали положительные симптомы Кохера, Щеткина-Блюмберга в правой подвздошной области, Бартомье-Михельсона; наличие жалоб на тошноту и/или рвоту у пациента; лейкоцитоз >10*109/л; выявленные УЗ признаки ОДА, выявление по данным УЗИ невоспаленного ЧО и/или другой патологии в правой подвздошной области.
Для каждого из вновь отобранных признаков были получены коэффициенты уравнения логистической регрессии (Табл. 4).
Для каждого случая в выборке были рассчитаны суммы полученных регрессионных коэффициентов, для которых соответственно была рассчитана вероятность диагноза ОДА.
Следующим этапом нами было выполнено определение балльной оценки для отобранных признаков КСШ ОДА
В клинической практике наиболее широко распространённым является использование суммы баллов, значение которых определено для каждого из симптомов ДШ.
В качестве «баллов» представляются коэффициенты уравнения логистической регрессии.
Для упрощения расчётов результатов применения оригинальной ДШ ОДА полученные коэффициенты уравнения логистической регрессии нами были округлены с шагом «0,5». В дальнейшем мы их стали называть «баллами».
При расчете уравнения логистической регрессии в выбранное уравнение был включен признак «УЗИ: Острый аппендицит», включавший в себя совокупность УЗ признаков ОА, встретившихся в том или ином соотношении (собирательный признак).
Учитывая многообразие УЗ признаков ОДА [13], был проведен дополнительный анализ информативности отдельных УЗ симптомов ОДА, который показал, что наибольшую чувствительность демонстрируют такие УЗ признаки ОДА, как несжимаемость ЧО при компрессии УЗ датчиком, увеличение диаметра ЧО более 7 мм. Эти УЗ признака ОДА показали также высокую специфичность (94,7 % и 95,1 % соответственно).
Несмотря на низкую чувствительность таких признаков, как копролит в просвете ЧО и утолщение периаппендикулярной клетчатки, они обладают высокой специфичностью и высоковероятно указывают на ОДА при отсутствии несжимаемости визуализированного ЧО и отсутствии визуализации ЧО, выявлении ЧО менее 7 мм в диаметре (в частности, в диапазоне 6–7 мм).
Таблица 4
Расчетные коэффициенты уравнения логистической регрессии для определения диагностической значимости признаков, формирующих КСШ ОДА
|
Статистические показатели |
Const. B0 |
Симптом Кохера |
Симптом Щеткина-Блюмберга вправой подвздошной области
|
Симптом Бартомье-Михельсона |
Тошнота/Рвота |
Лейкоцитоз >10*109/л |
УЗИ: другая патология и/или невоспаленный аппендикс |
УЗИ: Острый аппендицит |
|
В |
-3,5594 |
1,3575 |
1,62627 |
1,35445 |
1,074821 |
1,28329 |
-2,83614 |
2,86315 |
|
P |
0,00001 |
0,041 |
0,009 |
0,01 |
0,041 |
0,025 |
0,003 |
0,0001 |
|
ƛ2 |
31,7213 |
4,2 |
7,03 |
6,78 |
4,26 |
5,12 |
9,13 |
29,29 |
|
P |
0,00001 |
0,04 |
0,008 |
0,009 |
0,039 |
0,023 |
0,003 |
0,001 |
|
ОШ |
0,02845 |
3,89 |
5,08 |
3,87 |
2,93 |
3,6 |
0,06 |
17,52 |
|
-95 %ДИ |
0,00818 |
1,05 |
1,52 |
1,39 |
1,05 |
1,18 |
0,01 |
6,17 |
|
+95 %ДИ |
0,09896 |
14,34 |
17,05 |
10,8 |
8,19 |
11,04 |
0,37 |
49,72 |
В — коэффициент уравнения логистической регрессии
ОШ — отношение шансов ДИ — доверительный интервал
УЗ определение свободной жидкости в брюшной полости при ОДА показало крайне низкую чувствительность (32,2 %) и специфичность (77,8 %), являясь низкоинформативным симптомом.
На основании этих данных коэффициент («УЗ признаки ОА») был преобразован в отдельные коэффициенты со значением «2» — для увеличения диаметра ЧО более 7 мм, со значением «1» — для УЗ признака «несжимаемость ЧО при компрессии УЗ датчиком», со значением «1» — для копролита в просвете ЧО, со значением «1» — для утолщения периаппендикулярной клетчатки (Табл. 4).
Таблица 5
Оригинальная КСШ ОДА
|
№ |
Признак |
Оценка |
Баллы |
|
Клинические признаки |
|||
|
1 |
Симптом Кохера |
Положительный |
1,5 |
|
2 |
Тошнота и/или рвота |
Есть |
1 |
|
3 |
Симптом Щёткина-Блюмберга в правой подвздошной области |
Положительный |
1,5 |
|
4 |
Симптом Бартомье-Михельсона |
Положительный |
1,5 |
|
Лабораторные признаки |
|||
|
5 |
Лейкоцитоз ≥10*109/л |
Положительный |
1,5 |
|
УЗ признаки |
|||
|
6 |
Неизмененный ЧО и/или другая патология |
Выявлено |
-3 |
|
7 |
Увеличение диаметра ЧО > 7мм |
Выявлено |
2 |
|
8 |
Несжимаемость ЧО |
Выявлено |
1 |
|
9 |
Утолщение периаппендикулярной клетчатки |
Выявлено |
1 |
|
10 |
Копролит в просвете ЧО |
Выявлено |
1 |
|
Итого |
Max |
12 |
|
|
Min |
-3 |
||
Для определения диапазонов интерпретации оригинальной КСШ ОДА нами был построен график соотношения чувствительности и специфичности для различных порогов отсечения суммы округленных коэффициентов. На его основании были выделены были 3 группы пациентов соответственно трем диапазонам суммы баллов КСШ ОДА.
Наивысшую специфичность в установке диагноза ОДА оригинальная КСШ ОДА демонстрирует при сумме баллов от 3 до 12.
Наивысшую точность при исключении диагноза ОДА оригинальная КСШ ОДА демонстрирует при сумме баллов от -3 до 2.
Промежуточную группу составляет сумма баллов 2,5, где чувствительность оригинальной КСШ ОДА для постановки диагноза ОДА недостаточна и будет иметь место значительное количество «пропущенных» случаев ОДА. Так же низка специфичность для исключения диагноза ОДА, что обуславливает высокий риск осуществления «негативных» аппендэктомий (Рисунок 1).
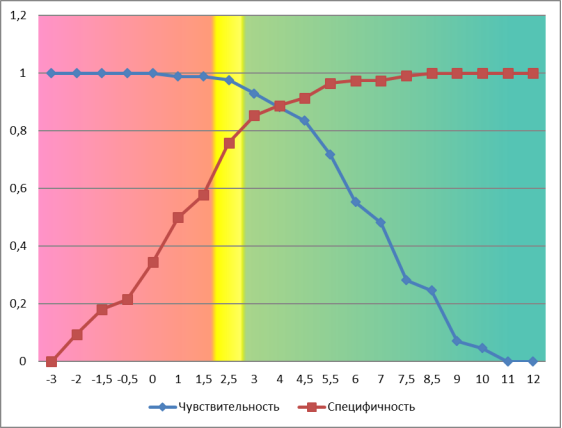
Рис. 1. График соотношения чувствительности и специфичности для различных порогов отсечения суммы баллов оригинальной КСШ ОДА
В этой группе, обозначаемой как «серая зона» оригинальной КСШ ОДА, необходимо применение дополнительных методов обследования, согласно её алгоритма применения.
В соответствии с указанными выделенными признаками ОДА и их баллами, а также определёнными при ROC-анализе диапазонами её интерпретации нами была представлена оригинальная КСШ ОДА и её алгоритм применения.
Алгоритм использования оригинальной КСШ ОДА носит этапный характер и проводится следующим образом (Рисунок 2).
При поступлении в стационар пациентов с подозрением на ОДА им проводится общеклиническое обследование с последующей оценкой клинических и лабораторных признаков оригинальной КСШ ОДА.
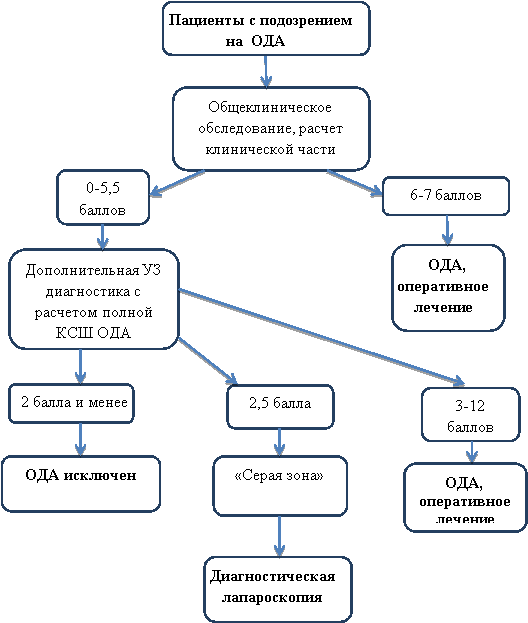
Рис. 2. Алгоритм применения оригинальной КС ДШ ОДА
Положительный симптом Кохера оценивается в 1,5 балла; Щёткина-Блюмберга в правой подвздошной области — в 1,5 балла; Бартомье-Михельсона — в 1,5 балла; наличие тошноты и/или рвоты — в 1 балл; увеличение количества лейкоцитов в общем анализе крови до 10×109/л и более — в 1,5 балла.
Далее производится последовательное суммирование полученных баллов. Если при суммировании баллов получается сумма в 6–7 баллов — устанавливается диагноз ОДА.
В этом случае проведение дополнительного УЗИ не требуется, так как его результат не повлияет на результат интерпретации КСШ ОДА. Пациенту устанавливается диагноз ОДА.
При сумме баллов клинической и лабораторной части КСШ ОДА менее 6, проводится УЗИ брюшной полости с дополнительным учетом УЗ признаков КСШ ОДА.
УЗ выявление ЧО диаметром более 7 мм оценивается в 2 балла; несжимаемость ЧО — в 1 балл; утолщение периаппендикулярной клетчатки — в 1 балл; копролит в просвете ЧО — в 1 балл; наличие ультразвуковых признаков неаппендикулярной острой патологии брюшной полости и/или соноскопическое выявление сжимаемого аппендикса, диаметром менее 7 мм — в «минус» 3 балла.
При получении общей балльной оценки УЗ признаков ОДА <2,5 баллов — диагноз ОДА исключается.
При получении общей балльной оценки УЗ признаков ОДА в 3 балла и более — диагноз ОДА высоковероятен и показано выполнение аппендэктомии.
При присвоении общей балльной оценки УЗ признаков ОДА в 2,5 балла диагноз ОДА возможен. Показано проведение диагностической лапароскопии.
С целью оценки эффективности оригинальной КСШ ОДА и её алгоритма нами был обследован 181 пациент, поступивший в приемное отделение НУЗ «Дорожная клиническая больница на ст. Хабаровск-1 ОАО «РЖД» с диагнозом «ОА».
Из них ОДА был выявлен по данным ПГИ у 51 (28,2 %) пациента.
По структуре пола и возраста данная группа пациентов была сопоставима с группой пациентов, на которой разрабатывалась оригинальная КСШ ОДА.
В качестве основного метода диагностики в данной группе применялась нестандартизованная КС диагностика ОДА, которая осуществлялась дежурным врачом на основе полученных им ранее знаний и профессиональных навыков при отсутствии обязательного стандарта исследования и алгоритма интерпретации полученных данных.
Обследование пациентов осуществлялось на том же диагностическом оборудовании.
Нестандартизованный КС метод включал себя применение общеклинического осмотра, лабораторных исследований (ОАК, ОАМ), УЗИ брюшной полости (наиболее часто — поиск свободной жидкости в брюшной полости) и по совокупности и характеру используемых методов диагностики и лечебно-диагностическому алгоритму формируемых групп пациентов данный метод был методологически аналогичен используемым методам исследования в оригинальной КСШ ОДА.
На основе проведенного обследования пациентов нами были выделены 3 группы пациентов: подлежащих экстренному оперативному вмешательству по поводу ОДА; у которых было недостаточно данных, как для исключения, так и для подтверждения ОДА («серая зона»); и у которых диагноз ОДА был исключён.
Из них 2 пациентов с исключённым ОДА повторно обратились в течение 48 ч после первичного осмотра и были оперированы по поводу ОДА.
В группе пациентов, у которых было недостаточно данных для исключения и для подтверждения ОДА 4 (2,3 %) пациента были госпитализированы в стационар, где в течение 72 ч проводилось динамическое наблюдение, и диагноз ОДА был исключен. У 27 (14,9 %) пациентов была выполнена диагностическая лапароскопия, по результатам которой 14 (%) пациентам выполнена аппендэктомия. Из них у 8 (29,6 %) пациентов был диагностирован ОДА. «Напрасная» аппендэктомия выполнена у 6 (22,2 %) пациентов. По результатам лапароскопии диагноз ОДА исключен у 13 (48,2 %) пациентов.
В группе пациентов с установленным диагнозом ОДА по результатам нестандартизованной КС диагностики аппендэктомия выполнена всем пациентам. При ПГИ ОДА подтвержден у 41 (73,2 % от числа первично оперированных) пациента. У 15 (26,8 %) человек выполнена «негативная» аппендэктомия.
Из 70 (38,7 %) оперированных пациентов ОДА при ПГИ подтвержден у 49 (70 %) человек.
Всего же ОДА был верифицирован при ПГИ у 51 (28,2 %) пациентов
Типичное расположение ЧО имелось у 58 (69,9 % от общего количества оперированных) пациентов и атипичное — у 25 (30,1 %) пациентов.
Параллельно нестандартизованной КС диагностике ОДА, на этой же группе пациентов нами осуществлялась балльная оценка симптомов ОДА согласно разработанной оригинальной КСШ ОДА.
Нами были получены следующие результаты оценки эффективности оригинальной КСШ ОДА: чувствительность — 94,1 %, специфичность — 73,8 %, точность — 79,6 %, размер «серой зоны» — 7,7 %, встречаемость ОДА в «серой зоне» — 7,1 %, доля ОДА «серой зоны» от общего количества ОДА — 2 %, доля недиагностированных случаев ОДА — 3,9 %.
Сравнительный анализ оригинальной КСШ ОДА и нестандартизованной КС диагностики показал лучшие показатели эффективности оригинальной КСШ ОДА в сравнении с таковыми при нестандартизованном КС методе диагностики ОДА.
Статистически значимыми оказались большая чувствительность КСШ ОДА (ƛ2 = 4,32; p<0,05), меньший размер «серой зоны» у КСШ ОДА (ƛ2 = 5,28; p<0,05) и меньшая доля случаев ОДА «серой зоны» от общего количества случаев ОДА (ƛ2 = 4,9; p<0,05).
Остальные показатели сравнения, такие как специфичность, точность, доля пропущенных случаев ОДА имели более высокие значения, но не показали статистически значимых различий при данных подходах. Тем не менее, отмечается тенденция к более высокой специфичности и точности КСШ ОДА (Табл. 6).
Таблица 6
Сравнительный анализ показателей эффективности нестандартизованнойКС диагностики ОДА иоригинальной КСШ ОДА
|
№ |
Показатель |
Нестандартизо- ванная КС диагностика |
КСШ ОДА |
ƛ2 |
Р |
|
1 |
Чувствительность |
80,4 |
94,1 |
4,32 |
<0,05 |
|
2 |
Специфичность |
66,9 |
73,8 |
1,49 |
>0,05 |
|
3 |
Точность |
70,7 |
79,6 |
3,78 |
>0,05 |
|
4 |
Размер «серой зоны» (%) |
15,5 |
7,7 |
5,28 |
<0,05 |
|
5 |
Встречаемость случаев ОДА в «серой зоне» |
21,4 |
7,1 |
2,07 |
>0,05 |
|
6 |
Доля случаев ОДА «серой зоны» от общего количества случаев ОДА |
13,7 |
2 |
4,9 |
<0,05 |
|
8 |
Доля недиагностированных случаев ОДА (%) |
3,9 |
3,9 |
- |
>0,05 |
В специальной литературе [1,4,5] указывается на объективные сложности клинической диагностики ОА у пациентов женского пола в сочетании с молодым возрастом, с атипичным расположением ЧО, ожирением, в пожилом и старческом возрасте. Это приводит как к ложноположительной, так и ложноотрицательной диагностике ОДА.
В связи с этим, считаем указанные обстоятельства «факторами риска» клинической диагностики ОДА.
В доступной литературе анализа эффективности ДШ ОА в зависимости от указанных «факторов риска» клинической диагностики ОА мы не нашли.
Нами была проведена оценка показателей эффективности оригинальной КСШ ОДА в субпопуляциях обследуемых пациентов с выделенными «факторами риска» клинической диагностики ОДА.
Сравнение показателей эффективности оригинальной КСШ ОДА было проведено с выделением из универсальной популяции группы сравнения субпопуляций женщин, моложе 40 лет, пациентов с ИМТ > 25 кг/м2, пациентов пожилого и старческого возраста.
Применение оригинальной КСШ ОДА для выделенных субпопуляций не показало статистически значимых различий показателей эффективности с таковыми для универсальной популяции.
Данный факт указывает на возможность универсального применения разработанной нами оригинальной КСШ ОДА на популяции пациентов, старше 18 лет (в том числе и в пожилом и старческом возрасте), исключая беременных и лиц с наличием поражений ЦНС, препятствующих сбору жалоб и анамнеза (с учетом критериев включения и исключения пациентов в оригинальное иссследование), а также у пациентов с ожирением (Табл. 7).
Чувствительность оригинальной КСШ ОДА при типичном расположении ЧО составила 97 %, при атипичном — 94,1 % (ОШ 2,0; 95 % ДИ 0,12–34,1; p>0,05).
Таким образом, атипичное расположение ЧО не оказало влияния на чувствительность оригинальной КСШ ОДА.
В связи с тем, что в «Национальных клинических рекомендациях по диагностике и лечению острого аппендицита» [4] для возможного применения рекомендуется ДШ ОА Alvarado нами был проведен сравнительный анализ эффективности применения КСШ ОДА и ДШ ОА Alvarado.
Для сравнительной оценки КСШ ОДА с ДШ Alavarado в программе PASW Statistics 18 был проведен ROC-анализ с построением соответствующих кривых (Рисунок 3).
Таблица 7
Результаты анализа эффективности КСШ ОДА всубпопуляциях по факторам риска клинической диагностики ОДА
|
№ |
Показатель |
Общая популяция |
Женщины, моложе 40 лет |
P* |
ИМТ >25 кг/м2 |
P* |
Пожилой истарческий возраст (> 60 лет) |
P* |
|
1 |
Чувствительность, (%) |
94,1 |
100 |
>0,05 |
93,8 |
>0,05 |
100 |
>0,05 |
|
2 |
Специфичность (%) |
73,8 |
74,6 |
>0,05 |
68,3 |
>0,05 |
90 |
>0,05 |
|
3 |
Точность (%) |
79,6 |
77,8 |
>0,05 |
79,5 |
>0,05 |
95 |
>0,05 |
|
4 |
Размер «серой зоны» (%) |
7,7 |
8,3 |
>0,05 |
5,5 |
>0,05 |
0 |
>0,05 |
|
5 |
Встречаемость ОДА в «серой зоне» (%) |
7,1 |
0 |
>0,05 |
25 |
>0,05 |
0 |
>0,05 |
|
6 |
Доля ОДА «серой зоны» от общего количества ОДА (%) |
2 |
0 |
>0,05 |
3,1 |
>0,05 |
- |
- |
|
7 |
Доля недиагностированных случаев ОДА (%) |
3,9 |
0 |
>0,05 |
3,1 |
>0,05 |
0 |
>0,05 |
*Статистическая значимость различия показателя с таковым в общей популяции
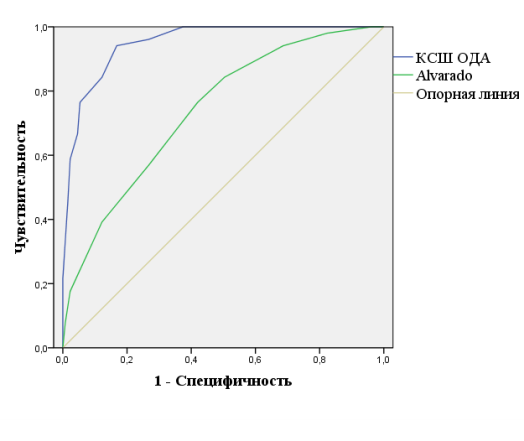
Рис. 3. ROC-кривые для сравниваемых ДШ ОА
Площадь под кривой для оригинальной КСШ ОДА оказалась статистически значимо большей, в сравнении с ДШ ОА Alvarado и составила 0,95, что соответствует показателю отличного качества статистической модели.
В результате сравнительного анализа оригинальной КСШ ОДА и ДШ ОА Alvarado согласно ранее определенным нами критериям сравнения было отмечено, что оригинальная КСШ ОДА показала статистически значимо большую чувствительность и меньшее количество недиагностированных случаев ОДА в сравнении с ДШ ОА Alvarado (Табл. 8).
Размер «серой зоны» оригинальной КСШ ОДА статистически значимо меньше данного показателя ДШ ОА Alvarado (p<0,001).
Встречаемость ОДА у пациентов в «серой зоне» не показала статистически значимых различий (p>0,05). Однако, доля ОДА «серой зоны» от общего количества ОДА при применении оригинальной КСШ ОДА было статистически значимо меньше (p<0,001).
Специфичность и точность диагностики при сравниваемых подходах не показала статистически значимых различий (p>0,05) оригинальной КСШ ОДА с ДШ ОА Alvarado.
Таблица 8
Сравнительный анализ показателей эффективности оригинальной КСШ ОДА сДШ Alvarado
|
№ |
Показатели |
Диагностические шкалы |
|
|
Оригинальная КСШ ОДА |
ДШ ОА Alvarado |
||
|
1 |
Чувствительность, (%) |
96 |
84,3* |
|
2 |
Специфичность (%) |
83,2 |
73,3 |
|
3 |
Точность (%) |
86,7 |
76,1 |
|
4 |
Размер «серой» зоны (%) |
7,2 |
24,9** |
|
5 |
Встречаемость ОДА в «серой зоне» (%) |
7,1 |
31,1 |
|
6 |
Доля ОДА «серой зоны» от общего количества ОДА (%) |
2 |
27,5** |
|
7 |
Доля пропущенных случаев ОДА (%) |
3,9 |
15,7* |
*p<0,01
** p<0,001
Выводы:
- ДШ ОА и их алгоритмы являются научно обоснованными стандартами диагностики ОА, формирование и сравнительный анализ которых должны осуществляться на основе единых методологических принципов.
- Единые методологические принципы создания и функционирования современных ДШ ОА и их алгоритмов заключаются в использовании проспективного характера исследования; многофакторного статистического анализа полученных результатов; на определённой популяции пациентов и на результатах анализа лечения только деструктивных форм ОА с чётким определением в характеристике ДШ ОА используемых методов диагностики; иметь однозначность интерпретации результата ДШ ОА; определение показаний и противопоказаний к применению каждой из ДШ ОА.
- Сравнительная оценка эффективности ДШ ОА и их алгоритмов должна осуществляться на основе предложенного алгоритма с оценкой их структуры и функциональности.
- Существующие ДШ ОА и их алгоритмы не отвечают требованиям большинства параметров единых методологических принципов их создания и функционирования.
- Оригинальная КСШ ОДА и алгоритм её применения направлены на диагностику ОДА, разработаны в соответствии с предложенными едиными методологическими требованиями по созданию и функционированию ДШ ОДА и их алгоритмов.
- Оригинальная КСШ ОДА и алгоритм её применения позволяет улучшить диагностику ОДА, поскольку обладает доказанной более высокой клинической эффективностью в сравнении с традиционно используемым нестандартизованным КС методом диагностики ОА и ДШ ОА Alvarado, не зависит от таких «факторов риска» диагностики ОДА как женский пол, пожилой и старческий возраст пациентов, ожирение.
Литература:
- Гринберг, А. А. Диагностика трудных случаев аппендицита: монография / С. В. Михайлусов, Р. Ю. Тронин, Г. Э. Дроздов. — Москва: Триада-Х, 1998. — 128 с.
- Кулезнева, Ю. В. Ультразвуковое исследование в диагностике и лечении острого аппендицита: практическое руководство / Ю. В. Кулезнева, Р. Е. Израилов, З. А. Лемешко — Москва: ГЭОТАР-Медиа, 2014. — 72 с.
- Натрошвили, А. Г. Результаты применения модифицированной диагностической шкалы у больных острым аппендицитом / А. Г. Натрошвили, А. М. Шулутко // Хирургия. — 2010. — № 8. — С. 24–27.
- Национальные клинические рекомендации по диагностике и лечению острого аппендицита [Электронный ресурс] / А. В. Сажин, И. И. Затевахин, А. В. Федоров, О. Э. Луцевич, А. М. Шулутко, А. С. Ермолов, А. А. Гуляев, М. И. Прудков, К. В. Лядов // 2016. — Режим доступа: http://xn----9sbdbejx7bdduahou3a5d.xn--p1ai/stranica-pravlenija/unkr/urgentnaja-abdominalnaja-hirurgija/ostryi-apendicit.html.
- Савельев, В. С. Руководство по неотложной хирургии органов брюшной полости / В. С. Савельев, В. А. Петухов, Б. Д. Савчук; под общ. ред. В. С. Савельева. — М.: Изд. «Триада–Х», 2005. — 640 с.
- Шапкин, Ю. Г. Эффективность лапароскопии в диагностике острого аппендицита / Ю. Г. Шапкин, Ю. В. Чалык, И. И. Майсков // Эндоскопическая хирургия. — 2008. — № 1. - С. 15–18.
- Addiss, D. The epidemiology of appendicitis and appendectomy in the United States / D. Addiss // Am. J. Epidemiol. — 1990. — Vol. 132, № 5. — P. 910–925.
- Alvarado, A. A practical score for the early diagnosis of acute appendicitis / A. Alvarado // Ann. Emerg. Med. — 1986. -Vol. 15. — Р. 557–564.
- Chong, C. F. Development of the RIPASA score: a new appendicitis scoring system for the diagnosis of acute appendicitis / C. F. Chong // Singapore Med. J. — 2010. Vol. 51, № 3. — P. 220–225.
- Christian, F. A simple scoring system to reduce the negative appendectomy rate / F. Christian, G. P. Christian //Ann. R. Coll. Surg. Engl. — 1992. — Vol.74. — P. 281–285.
- Flum, D. R. The clinical and economic correlates of misdiagnosed appendicitis: nationwide analysis / D. R. Flum, T. Koepsell // Arch. Surg. — 2002. — Vol. 137. — P. 799–804.
- H. Sitter S., Hoffmann I. Diagnostic score in appendicitis. Validation of a diagnostic score (Eskelinen score) in patients in whom acute appendicitis is suspected / S. H. Sitter, I. Hoffmann // Langenbecks Arch. Surg. — 2004. -Vol. 389. — P. 213–218.
- Lintula, H. A diagnostic score for children with suspected Appendicitis / H. Lintula, E. Pesonen // Langenbecks Arch. Surg. — 2005. — Vol. 390. — Р. 164–170.
- Luckmann, R. Incidence and case fatality rates for acute appendicitis in California. A population-based study of the effects of age / R. Luckmann // Am. J. Epidemiol. — 1989. — Vol. 129. — P.905–918.
- Rosen, M. P. Expert Panel on Gastrointestinal Imaging. ACR Appropriateness Criteria right lower quadrant pain — suspected appendicitis [Электронный ресурс] / M. P. Rosen, A. Ding, et al. // American College of Radiology. — 2010. — режим доступа: http://guideline.gov/content.aspx?f=rss&id=23816
- Teicher, I. Scoring system to aid in diagnoses of appendicitis / I. Teicher, B. Landa // Ann. Surg. — 1983. — Vol. 198. — Р. 753–759.
- Tzanakis, N. E. A New Approach to Accurate Diagnosis of Accute Appendicitis / N. E. Tzanakis, S. P. Efstathio // Word J. Surg. — 2005. — Vol.29. -P. 1151–1156.
- Wilasrusmee, C. Diagnostic Scores for Appendicitis: A Systematic Review of Scores’ Performance / C. Wilasrusmee, T. Anothaisintawee // British Journal of Medicine & Medical Research. — 2014. — Vol. 4, № 2. — P.711–730.







