Апоптоз представляет собой регулируемый процесс программируемой клеточной гибели и является необходимым условием нормально существования организма. Основная роль апоптоза состоит в поддержание клеточного гомеостаза. Апоптоз обеспечивает физиологическое соотношение клеток различных типов.
Процесс апоптоза обуславливается специфическими особенностями морфологии- ядро и цитоплазма уменьшаются в размерах, конденсируются, фрагментируются, клетка распадается на апоптические тельца, содержащие элементы ядра и органеллы [2,3,4]. Происходит фрагментация ядра с последующей их межнуклеосомной деградацией. Плазматическая мембрана становится узнаваемой для фагоцитов, в результате чего происходит фагоцитоз апоптических телец за счет макрофагов [2,3]. При апоптозе целостность биологических мембран ни нарушается, благодаря чему не происходит выход содержимого клетки во внеклеточную среду и предупреждает развитие воспаления [1,2]. Митохондриальный путь гибели клетки является одним из основных.
Митохондрии являются основным активизирующим и подавляющим фактором в гибели клеток. Митохондриальный путь апоптоза происходит за счет повреждения ДНК [5;6]. Важнейшим белком, регулирующим клеточную гибель, является p53, это транскрипционный фактор, регулирующий клеточный цикл. Активация белка p53 происходит в ответ на множество внешних раздражителей таких как: гипоксия, облучение, высокая концентрация монооксида азота [2;6]. Ген p53 активирует гены Bax и Bid, происходит образование свободных форм кислорода, что способствует выходу цитохрома-с из митохондрий [1;6]. Одним из самых важных моментов в митохондриальном пути клеточной гибели, является включение белков семейства Bcl-2. Белки семейства Bcl-2 имеют общую структуру, состоящую из гидрофобной α-спирали, окруженной алифатическими α-спиралями. Некоторые члены семейства имеют трансмембранные домены на своем c-конце, которые в основном функционируют, чтобы локализовать их в митохондрии. Семейство Bcl-2 объединяет группу белков со сходными морфофункциональными качествами. Семейство белков разделяют на две группы [1;5].
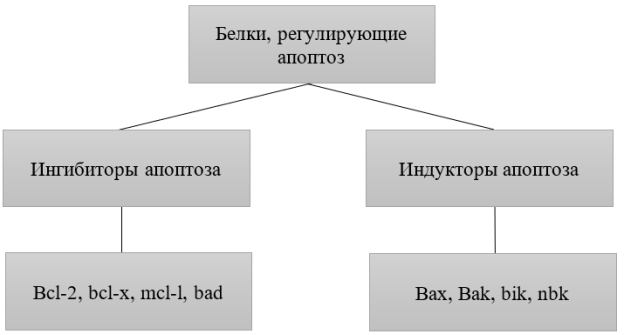
Bcl-2 регулирует клеточную смерть контролируя проницаемость митохондриальной мембраны. Bcl-2 локализуется на внешней мембране митохондрий, играет важную роль в клеточной выживаемости, так же Bcl-2 участвует в контроле метаболической активности, повышает уровень инсулина, что ведет к защитному метаболическому эффекту [7]. Лабороторные мыши, у которых ген BCL2 искусственно инактивирован, характеризуются замедленным ростом и умирают вскоре после рождения. Гематопоэз у таких мышей протекает нормально на ранних стадиях, но тимус и селезёнка подвергаются ярко выраженной апоптотической инволюции. Также у животных развивается почечная недостаточность и нарушается синтез меланина [7].
Bcl-x представляет собой трансмембранную молекулу в митохондриях, он является членом семейства белков Bcl-2, действует как антиапоптический белок, предотвращая выделение митохондриального содержимого. Дисфункция Bcl-x у мышей может привести к неэффективной выработке эритроцитов, тяжелой анемии, гемолиза и смерти.
Mcl-1 представляет собой белок кодируемый геном Mcl-1. Белок, кодируемый этим геном, принадлежит к семейству Bcl-2. Альтернативное сращивание происходит в этом локусе, и были определены два варианта транскрипта, кодирующих различные изоформы. Более длинный продукт гена повышает выживаемость клеток путем ингибирования апоптоза, в то время как альтернативный более короткий продукт гена способствует апоптозу и вызывает смерть.
Bad- частвует в инициации апоптоза. BAD является членом семейства BH3, [4] подсемейства семейства Bcl-2. Он не содержит С-терминального трансмембранного домена для наружной митохондриальной мембраны в отличие от большинства других членов семейства Bcl-2 [4]. После активации он способен образовывать гетеродимер с антиапоптотическими белками и предотвратить их остановку апоптоза. (Шиу Ю Хсу). Так существует множество белков, учавствующих в апоптозе, роль которых мало изучена.
Проапоптические белки группы Bcl-2 имеют концевой гидрофобный регион,который способствует прикреплению к мембранам органелл. У митохондрий существуют физиологические поры, мегаканалы, через которые в цитоплазму поступают цитохром C и другие факторы [1,5]. Известно, что данные факторы принимают участие как в процессе апоптоза, так и некроза. Механизм образования апоптических пор в митохондриях является процессом олигомеризацией на митохондриальной мембране белков Bax и Bak. Процесс формирование пор в митохондриях является регулируемым, под жестким контролем различных регуляторных систем клетки. Цитохром-c также выделяется из митохондрий из-за образования канала, индуцированного митохондриальным апоптозом. После выделения цитохрома c он связывается с активатором апоптотической протеазы — 1 (Apaf-1) и АТФ, которые затем связываются с прокаспазой-9, чтобы создать белковый комплекс, известный как апоптозома. Апоптосома расщепляет прокаспазу на ее активную форму каспазы-9, которая, в свою очередь, активирует эффекторную каспазу-3.
Митохондрии являются одним из важнейших компонентов в пути реализации клеточной гибели. Установлено что митохондрии обладают широким спектром белковых и не белковых факторов, активизирующим процесс клеточной гибели. В настоящее время существует гипотеза, предполагающая, что накопление нарушений в митохондриальном геноме, является одной из причин в различных патологиях. Актуальность изучения проблем Апоптоза определяется взаимосвязью нарушения регуляции процесса за программированной гибели клетки с большинством заболеваний. Так, к заболеваниям, связанным с усилением апоптоза, относятся опухолевые заболевания: фолликулярная лимфома, рак молочной железы, рак предстательной железы, рак яичников, аутоиммунные заболевания: системная красная волчанка, гломерулонефрит, вирусные инфекции, вызванные вирусом герпеса, аденовирусом, поксовирусами. К заболеваниям, ассоциированным с ингибированием апоптоза, относятся синдром приобретенного иммунодефицита, нейродегенеративные заболевания: болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, пигментный ретинит, хорея Гентингтона, мозжечковые дегенерации, апластическая анемия, токсические заболевания печени. Изучение механизмов регуляции различных этапов апоптоза позволяет определенным образом воздействовать на его отдельные этапы с целью их регуляции или коррекции. В настоящее время общепринято: если клетка погибает от апоптоза, подразумевается возможность терапевтического вмешательства, если вследствие некроза — нет. На основе знаний о программированной клеточной гибели используется широкий ряд препаратов с целью регуляции этого процесса в различных типах клеток. Через индукцию апоптоза осуществляется действие большинства цитотоксических химиопрепаратов, антиметаболитов нуклеиновых кислот, ингибиторов топоизомераз. С использованием андроген-блокирующей терапии лечат рак предстательной железы. Рак молочной железы часто подвергается регрессии при применении антагонистов эстрогеновых рецепторов.
Литература:
- Владимирская Е. Б. Механизмы апоптотической смерти клеток/Е. Б. Владимирская//Гематология и трансфузиология. -2002. -Т. 47, № 2. -С. 35–40.
- Григорьев М. Ю. Апоптоз в норме и патологии/М. Ю. Григорьев, Е. Н. Имянитов, К. П. Хансон/Медицинский академический журнал. -2003. -Т. 3, № 3. -С. 3–11.
- Нагорнев В. А. Апоптоз и его роль в атерогенезе В. А. Нагорнев, А. Н. Восканьянц//Медицинский академический журнал. -2003. -Т. 3, № 4. -С. 3–18.
- Робинсон М. В. Апоптоз клеток иммунной системы/М. В. Робинсон, В. А. Труфакин//Успехи современной биологии. -1991. -Т. 3, вып. 2. -С. 246–259.
- Adams J. M. Ways of dying: multiple pathways to apoptosis/J. M. Adams//Genes and Development. -2003. -N 17. -P. 2481–2495.
- Haupt S. Apoptosis -the p53 network/S. Haupt, M. Berger, Z. Goldberg, Y. Haupt//Journal of Cell Science. -2003. -N 116. -P. 4077–4085.
- Itoh K. Central role of mitochondria and p53 in Fas-mediated apoptosis of rheumatoid synovial fibroblasts K. Itoh, H. Hase, H. Kojima et al.//Rheumatology. -2004. -N 43. -P. 277–285.

