В проточном реакторе при атмосферном давлении и температурах 295–423 К изучена реакция гидрирования оксида углерода (II) на полупроводниковом катализаторе ZnTe. Установлено, что основным продуктом реакции является газообразный формальдегид. Идентификация формальдегида была проведена по УФ-спектрам.
Образование формальдегида с ростом температуры уменьшается, что указывает на протекание побочных экзотермических процессов, тормозящих основную реакцию. Побочными продуктами реакции гидрирования оксида углерода (II) в воздушной среде могут быть оксид углерода (IV) и муравьиная кислота. В результате реакции поверхность ZnTe частично очищается от оксида углерода (IV).
Подтверждена предложенная ранее схема механизма реакции гидрирования оксида углерода (II) на теллурид кадмия и других алмазоподобных полупроводниках.
Изученный катализатор может быть использован в электронных приборах — каталитических преобразователях для контроля загрязнения окружающей среды монооксидом углерода.
Ключевые слова: катализатор, монооксид углерода, гидрирование, реактор
Разнообразие и гигантские масштабы производства приводят к весьма существенному воздействию его на окружающую среду и вызывают изменение атмосферы и климата, состояния гидросферы и литосферы. Так, только за счёт сжигания химического топлива в атмосферу планеты ежегодно выбрасывается свыше ![]() тонн оксидов углерода, следствием чего происходит загрязнение атмосферы, парниковый эффект и разрушение озонового слоя [1]. В связи с этим, проблема очистка выбросов от оксидов углерода весьма актуальна.
тонн оксидов углерода, следствием чего происходит загрязнение атмосферы, парниковый эффект и разрушение озонового слоя [1]. В связи с этим, проблема очистка выбросов от оксидов углерода весьма актуальна.
Для удаления следов CO и CO2 из обогащённых водородом газов в промышленном синтезе аммиака, при синтезах метанола и Фишера-Тропша используется каталитическое гидрирование оксидов углерода. Смесь окиси углерода и водорода, известная под названием синтез — газ, используется для получения многих продуктов в промышленных масштабах, таких как метиловый спирт, формальдегид и др.
Особое влияние на выход и характер получаемых продуктов оказывают катализаторы. Для этой цели в настоящее время используют металлы: Сu, Fe, Co, Ru, Ni и окислы MgO, ZnO, A12O3, ThO2, K2O, Cr2O3 и др. [2].
В данной работе изучена реакция гидрирования монооксида углерода на порошковом катализаторе ZnTe при атмосферном давлении и температурах 293–423 К. Схема каталитической установки включала мембранный насос, трубчатый реактор диаметром 0,5 см с длиной слоя катализатора 3 см, помещённый в печь, расходомер, барботёр с водой для поглощения продуктов реакции.
Ввод смеси монооксида углерода и водорода в установку производили медицинским шприцем при одинаковом объёмном соотношении водорода и оксида углерода (II). Реакцию гидрирования проводили при объёмной скорости газа-носителя (воздуха) 0,5 л/мин. Анализ состава образующихся продуктов осуществляли путём отбора проб раствора из барботёра и их анализа методом УФ спектроскопии на приборе Specol 1500. Толщина кюветы — 1 см.
Учитывая, одним из продуктов гидрирования монооксида углерода может быть газообразный формальдегид, образование которого возможно при комнатной температуре без участия катализатора, степень превращения реакции оценивали по изменению интенсивности полосы поглощения в УФ-спектре при 185 нм, отвечающей
Химическое состояние поверхности катализатора до и после проведения реакции контролировали методами ИК-спектроскопии и измерения водородного показателя pH. ИК-спектры снимали на приборе InfraLUM FT-02 c использованием селеновой приставки МНПВО. Водородный показатель водных суспензий ZnTe измеряли с помощью комбинированного измерителя Seven Easy pH в комплекте с комбинированным электродом InLab 413.
УФ — спектроскопические исследования водных растворов, содержащих продукты гидрирования монооксида углерода показали, что без участия катализатора основным продуктом реакции является газообразный формальдегид (рис. 1). В водных растворах в УФ-спектре ему соответствуют две полосы поглощения 185 и 270 нм, которым отвечают ![]() и
и ![]() электронные переходы в молекуле формальдегида соответственно [3, 4]. Орбитали na и nb представляют собой несвязывающие молекулярные орбитали, на которых находится неподелённая пара электронов кислорода.
электронные переходы в молекуле формальдегида соответственно [3, 4]. Орбитали na и nb представляют собой несвязывающие молекулярные орбитали, на которых находится неподелённая пара электронов кислорода.
Степень превращения исходной газовой смеси в формальдегид составляет 33,56 %. Образование формальдегида при участии катализатора уменьшается с ростом температуры (таблица), что указывает на протекание побочных процессов, протекающих с выделением теплоты и тормозящих образование формальдегида.
Согласно предложенной в [5, 6] схеме механизма реакции гидрирования CO, первой стадией процесса является адсорбция молекулярного водорода на анионных вакансиях полупроводника с образованием частиц Н2+ и Н+. Во второй стадии атомы водорода взаимодействуют с поверхностными координационно-ненасыщенными атомами металла. На следующих стадиях путём внедрения СО по связям металл-водород образуется формильный лиганд, происходит присоединение молекулы водорода к металлическому центру, далее формальдегид восстанавливается и переходит в газовую фазу.
1) H2 (г) + V → Н2+ (адс) + F
Н2+ (адс) + V → 2 Н+ (адс) + F,
где V — вакансия, F — F-центр;
2) H + M → H ― M;
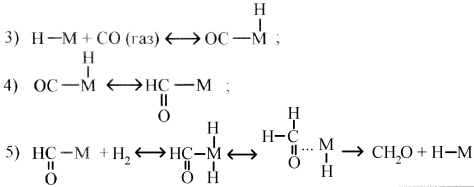
Побочными процессами гидрирования монооксида углерода могут быть реакции окисления формальдегида и монооксида углерода кислородом воздуха и др:
СН2О +1/2 О2 → НСООН + 270,4 кДж/моль
НСООН + ½ О2 → СО2 + Н2О +14,5 кДж/моль
НСООН → СО + Н2О — 53,7 кДж/моль
СН2О → СО + Н2 + 1,9 кДж/моль
2СН2О + Н2О → СН3ОН + НСООН + 122,0 кДж/моль
СО + ½ О2 → СО2 + 283,0 кДж/моль
2СН2 О → НСООН + 132,6 кДж/моль
ИК-спектроскические исследования (рис. 2) показали, что на исходной поверхности теллурида цинка присутствует оксид углерода (VI), адсорбированный на координационно-ненасыщенных атомах цинка с образованием линейной структуры ![]() (полосы 2372, 2341 см-1) и анионных вакансиях теллура с образованием карбоксилатной структуры
(полосы 2372, 2341 см-1) и анионных вакансиях теллура с образованием карбоксилатной структуры ![]() :
: ![]() (полосы 1496, 1542 см-1). После проведения реакции гидрирования интенсивность этих полос немного уменьшилась и появились новые полосы поглощения 937 и 1037 см-1, которые согласно [3], можно отнести к валентным колебаниям связи металл — углерод Me — C. Появление этих полос указывает на участие поверхностных металлических атомов в реакции гидрирования монооксида углерода и подтверждает предложенную схему механизма реакции.
(полосы 1496, 1542 см-1). После проведения реакции гидрирования интенсивность этих полос немного уменьшилась и появились новые полосы поглощения 937 и 1037 см-1, которые согласно [3], можно отнести к валентным колебаниям связи металл — углерод Me — C. Появление этих полос указывает на участие поверхностных металлических атомов в реакции гидрирования монооксида углерода и подтверждает предложенную схему механизма реакции.
Измерения водородного показателя образцов водных суспензий теллурида цинка показали, что в результате реакции гидрирования монооксида углерода поверхность подкисляется (рис. 3). Это может быть связано с образованием муравьиной и угольной кислот.
Таким образом, в результате выполненных исследований было установлено, что исходная поверхность теллурида цинка содержит адсорбированный из воздуха оксид углерода (VI), который образует линейные и карбоксилатные структуры. В результате реакции гидрирования CO происходит частичная очистка поверхности от CO2. Основным продуктом реакции гидрирования монооксида углерода на полупроводниковом катализаторе ZnTe является формальдегид. Образование формальдегида с ростом температуры уменьшается, что указывает на протекание побочных экзотермических процессов, тормозящих основную реакцию. Побочными продуктами реакции гидрирования оксида углерода (II) в воздушной среде могут быть оксид углерода (VI) и муравьиная кислота. Подтверждена предложенная ранее схема механизма реакции гидрирования оксида углерода (II) на CdTe и других алмазоподобных полупроводниках. Изученный катализатор может быть использован в электронных приборах — каталитических преобразователях для контроля загрязнения окружающей среды монооксидом углерода.
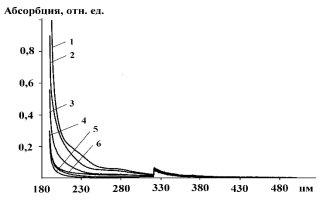
Рис. 1. УФ-спектры метанола (1), водных растворов продуктов взаимодействия CO + H2 (1:1) без участия катализатора при 295 К (2) и с участием катализатора ZnTe при 295 К (3), 373 К (4), 423 К (5), 388 К (6)
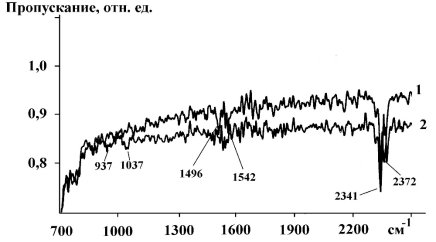
Рис. 2. ИК-спектры теллурида кадмия долгое время хранившегося на воздухе (1) и после реакции гидрирования монооксида углерода (2)
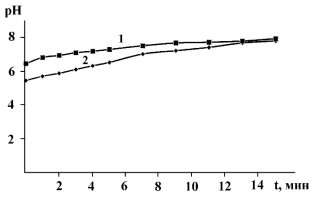
Рис. 3. Кривые изменения водородного показателя водной дисперсии теллурида цинка хранившегося на воздухе (1) и после реакции гидрирования монооксида углерода (2)
Таблица 1
Изменение интенсивности полосы поглощения 191 нм истепени превращения монооксида углерода иводорода вформальдегид на катализаторе ZnTe взависимости от температуры
|
Температура, К |
Интенсивность полосы 191 нм (I), отн. ед. |
Степень превращения,% |
|
295 |
0,4092 |
20,84 |
|
373 |
0,2089 |
10,64 |
|
388 |
0,2178 |
11,09 |
|
423 |
0,1718 |
8,75 |
Литература:
- Соколов Р. С. Химическая технология: Учеб. пособие для студ. высш. учеб. заведений: В 2т. –М.: Гуманит. изд. центр ВЛАДОС, 2000. — Т.1 Химическое производство в антропогенной деятельности. Основные вопросы химической технологии. Производство неорганических веществ. — 368 с.
- Общая химическая технология. Под редакцией докт. техн. наук профессора Мухленова И. П. — М.: Высш. шк., — 1964. С. 484–495.
- Драго Р. Физические методы в химии. Т.1. М.: Мир, 1981. — 423 с.
- Методические указания № 4525–87 по фотометрическому измерению концентраций формальдегида и метанола в воздухе рабочей зоны.
- Федяева О. А. Физико-химические свойства поверхности полупроводниковой системы CdXHg1-XTe. Монография. — Омск: Изд-во ОмГТУ, 2013. — 172 с.
- Федяева О. А. Совместная адсорбция монооксида углерода и водорода на поверхности твёрдых растворов CdXHg1-XTe / О. А. Федяева / Изв. Вузов. Химия и хим. технология. — 2012. — Т. 55. — № 5. — С. 85–88.







