В статье рассмотрены микроорганизмы квасильного раствора, которые образуются в процессе квашения. Приведены виды брожения в зависимости от культуры микроорганизмов, температуры, рН среды и других факторов, в результате которых образуются различные конечные и промежуточные продукты. Также приведено возникновение восстановительных реакций в квасильном растворе, способствующих ограничению развития посторонней микрофлоры.
Ключевые слова: крахмал, квашение, органическая кислота, температура, сахар, амилоза, мальтоза, раствор, бактерия, углевод, протеолитические ферменты.
In clause the microorganisms квасильного of a solution are considered which are formed in process. The kinds of fermentation(unrest) are given depending on culture of microorganisms, temperature, рН of environment(Wednesday) and other factors, as a result of which the various final and intermediate products are formed. Such the occurrence of reactions in квасильном a solution promoting restriction of development посторенней микрофлоры is given.
Key words: starch, organic acid, temperature, sugar, solution, bacterium, carbohydrates.
Крахмал является исходным продуктом, из которого при квашении образуются органические кислоты. Он представляет собой нерастворимые в холодной воде зерна кристаллического строения, размером 10–50 мк. В горячей воде крахмал набухает и переходит в коллоидное состояние, образуя клейстер. Температура клейстеризации находится в пределах 55–800С.
Крахмал — углевод (С6Н10О5)n; он состоит из двух родственных веществ: амилозы — внутренней части зерна и амилопектина — оболочки.
Образование сахаров под действием ферментов связано с клейстризацией крахмала. Неоклейстеризованный крахмал практически не осахаривается, на границе же возникновения клейстеризации (при температуры 55–600С осахаривание резко возрастает.
При обычном способе подготовки квасильного раствора (температурой 400С) клейстеризации крахмала не происходит; кислоты образуются главным образом при разрушении более простых углеводов. Таким образом, крахмал, составляющий большую часть муки, используется нерационально и представляет собой отход производства. Имеются указания, что крахмал овса легче переходит в мальтозу при обработке диастатическими ферментами, чем крахмал других злаков.
В результате действия на крахмал амилазы и мальтазы образуются сахара — мальтоза С12Н22О11 и глюкоза С6Н12О6.
Распад сахаров в квасильном растворе обусловливается жизнедеятельностью микроорганизмов. Этот процесс носит название брожения. Брожение есть разновидность ферментативных процессов, в которых ферменты вырабатываются в результате жизнедеятельности бактерий, дрожжей и плесеней.
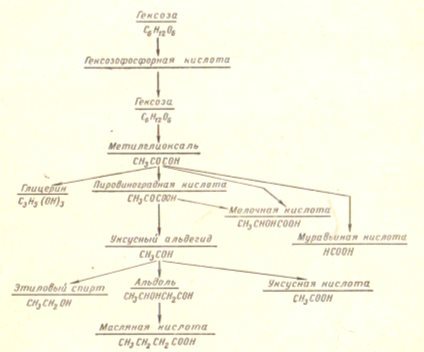
Виды брожения чрезвычайно разнообразны: в зависимости от культуры микроорганизмов, температуры, рН среды и других факторов образуются различные конечные и промежуточные продукты.
Различают следующие стадии брожения глюкозы: 1) фосфорилирование сахара при воздействии фосфорной кислоты, 2) распад глюкозы на две молекулы метилглиоксаля, 3) образование молочной кислоты из метилглиоксаля:
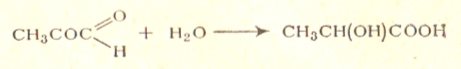
Метилглиоксаль может также переходить в пировиноградную кислоту СН3СОСООН, которая затем восстанавливается в молочную с одновременным окислением других промежуточных продуктов. Таким образом, молочнокислое брожение представляет собой окислительно-восстановительный процесс.
В результате брожения образуются органические кислоты, спирты и т. д., как это видно из схемы брожения, приводимой в сокращенном виде.
Кислоты квасильного раствора вырабатываются молочнокислыми бактериями.
Известно много видов молочнокислых бактерий; они различаются по форме колоний, температурному оптимуму и характеру сбраживания углеводов.
Например, бактерии Delbrucki и Bulgaricum дают следующее суммарное уравнение распада глюкозы до молочной кислоты:
С6Н12О6 = 2СН3СН (ОН) СООН.
Бактерии Esherichia Coli, кроме молочной кислоты, образуют углекислоту, этиловый спирт и водород:
2С6Н12О6 + Н2О = 2СН3СН (ОН) СООН + С2Н5ОН + СН3СООН + 2СО2 + 2Н2
Установлено, что кислотообразование в квасильных растворах определяется действием двух молочнокислых культур, характерных для заквасок кислого теста. Первая культура называется Streptobacterium plantarum, вторая — бактерия группы Ф (по классификации Кнудсена). Обе они факультативные анаэробы,т. е. развивающиеся как в присутствии кислорода воздуха, так и без него.
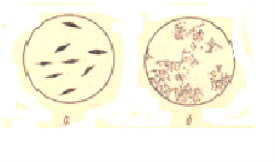
Рис. 1. Колонии молочнокислых бактерий: А — Streptobacterium plantarum; б — группы Ф
Бактерии группы Ф — это палочки длиной 3–4 мк и шириной 0,6–0,7 мк. Они встречаются соединенными в виде цепочек или по две, расположенные одна к другой под углом; образуют колонии. Оптимальная температура развития бактерий около 370С.
Культура Streptobacterium plantarum образует резко очерченные чечевицеобразные колонии. Они также представляют собой палочки длиной 1,3–2 мк, шириной 0,6–0,7мк, нередко соединяющиеся попарно; оптимальная температура развития их около 320С. По мере накопления в квасильном растворе кислот жизнедеятельность микрофлоры тормозится. Максимальный выход молочной кислоты — около 2 %.
Эти бактерии не вызывают газообразования, не разжижают желатин и не дают спор.
В качестве побочных продуктов брожения образуются уксусная, масляная и муравьиная кислоты в количестве до 14 % от общего содержания кислот.
Кроме этих, основных, культур бактерий в квасильных растворах встречаются дикие пленчатые дрожжи Mycoderma и Monilia Candida. Это типичные аэробы, наблюдаемые на поверхности старых квасов. Распад белковых веществ может быть вызван культурой бактерии Subtilis. В квасах она может развиваться только в первые часы брожения, поскольку прорастание ее спор происходит в нейтральной среде.
Выделены слизистые бактерии типа бактерии Lactis aerogenes, свертывающие молоко и образующие газы, но не разжижающие желатина.
В квасильных растворах наблюдается высокая устойчивость брожения, несмотря на то что для их приготовления не применяют специальных заквасок. Это объясняется следующим.
При богатом азотистом питании (белки муки и продукты их гидролиза) количество сахаров, способных сбраживать, невелико, так как основную массу углеводов составляет неосахаренный или медленно осахаривающийся крахмал. Температура раствора 35–400С способствует развитию преимущественно молочнокислых бактерий и ограничивает развитие дрожжей (дрожжи требуют менее высокой температуры и присутствия сахара); при остывании раствора развитие дрожжей тормозится вследствие почти полного отсутствия сахаров и повышения кислотности. Кроме того, некоторые молочнокислые бактерии, в частности типа Streptobacterium plantarum, способны проникать внутрь дрожжевых клеток и вызывать их разрушение.
Развитию гнилостных и маслянокислых бактерий препятствует кислотность среды. Этому способствует так же перемешивание, тормозящее развитие анаэробов, приготовление квасов в одной и той же посуде, содержащей в качестве закваски отработанные квасы.
Уже спустя 4–6 ч с момента приготовления квасильного раствора посторонние культуры подавляются и стимулируется развитие основной молочнокислой микрофлоры. Однако использование микробиологических процессов требует особой тщательности соблюдения режима обработки, и в практике известны случаи, когда вслествие неправильно проведенной подготовки квасильного раствора возникали ненормальности в ходе обработки шкур.
Маслянокислое брожение определяется суммарной реакцией:
С6Н12О6 = СН3СН2СН2СООН + 2Н2 + 2СО2.
Возбудителями брожения служат маслянокислые бактерии, относимые к споровым видам и являющиеся анаэробами. Появление в квасах запаха прогорклого масла может служить показателем отклонения от установленного режима.
Изменение в квасильном растворе состава углеводов во времени показано на рис. 1. За 3–4 ч брожения образуется максимальное количество сахаров, после чего общее содержание их убывает. Это время соответствует «скрытому периоду» развития кислотообразующей микрофлоры, которая вызывает уменьшение содержание сахаров в растворе, что видно по возникновению нарастания кислотности.
В дальнейшем жизнедеятельность бактерий настолько усиливается, что расходование сахаров идет быстрее, чем их образование вследствие распада крахмала.
Накопление кислоты свидетельствует о продолжающемся гидролизе углеводов, но обнаружить присутствие сахаров в растворе уже невозможно; они оказываются промежуточным продуктом.
Кислотность отработанных квасильных растворов составляет 10–12 г/л в пересчете на молочную кислоту, при этом следует учесть, что некоторое ее количество связывается с белками шкуры.
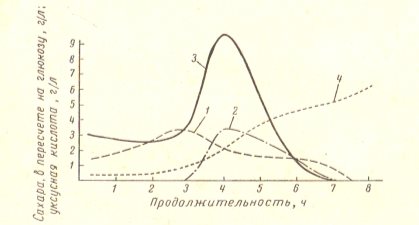
Рис. 2. Кривые изменения углеводного состава квасильного раствора (по И. П. Стефановичу): 1 — сахара типа глюкозы; 2 — дисахариды (5-минутный гидролиз соляной кислотой); 3 — мальтоза, декстрины (3-часовой гидролиз соляной кислотой); 4 — органические кислоты
Состав кислот в квасильном растворе показан в табл. 1, откуда видно, что со временем возрастает преимущественное содержание молочной кислоты.
Таблица 1
Образование кислот в квасильном растворе в зависимости от времени
|
Кислота |
Количество кислоты,%, по истечении | |
|
2 суток |
6 суток | |
|
Молочная Уксусная Муравьиная Масляная |
55,2 25,2 15,0 4,6 |
65,1 28,6 5,9 0,4 |
Выделение газов — преимущественно углекислоты — в первые часы закисания квасов не характерно для основной молочно-кислой флоры.
Происхождение газов объясняется жизнедеятельностью дрожжей или слизистых бактерий, а также возможным увлечением в квасильное оборудование воздуха при загрузке муки.
В результате преимущественного развития молочнокислой микрофлоры образование газов прекращается. Поэтому газовыделение (в особенности в конечной стадии квашения), а также возможное выделение водорода, характеризует нормальное протекание брожение, связанное, например, с развитием маслянокислой микрофлоры.
Молочнокислое брожение сопровождается окислительно-восстановительными процессами.
Если в закисающие квасы добавить серу, она восстановится до сероводорода; в квасах, где брожение приостановлено, выделения сероводорода не наблюдается.
Окислительно-восстановительные свойства химических растворов характеризуются величиной окислительно-восстановительного потенциала, подобно тому как величина рН определяет активную кислотность среды. Если рН является функцией содержания в растворе свободных водородных ионов, окислительная или восстановительная сила определяется концентрацией молекулярного кислорода или водорода.
В закисающем квасильном растворе в результате реакции брожения создается восстановительная среда, равноценная 0,2 %-ному раствору гидросульфита — одного из наиболее сильных восстановителей.
Деятельность факультативных бактерий, к которым относятся молочнокислые бактерии, не зависит от восстановительных свойств раствора. Для жизнедеятельности аэробных микроорганизмов требуется присутствие кислорода. Они могут развиваться в растворах, обладающих слабой восстанавливающей способностью. Наоборот для развития анаэробных микроорганизмов требуется восстановительная среда.
Таким образом, возникновение восстановительных реакций в квасильном растворе способствует ограничению развития посторонней микрофлоры, так как в начале закисания тормозится развитие анаэробных, а в последующем — аэробных микроорганизмов.
Восстановительная среда повышает активность протеолитических ферментов муки. Восстановители могут непосредственно действовать на белки шкуры, в том числе на ретикулиновые волокна, способствуя их разрыхлению.
Литература:
- Стефанович И. П. Технология меха, Легкая индустрия, Москва 1967.
- Аронина Ю. Н., Ефремева П. Я. Технология меха, Гизлегпром, 1963.
- Зайдес А. Л. Структура коллагена и ее изменения при обработках, Ростехиздат, 1960.
- Кавказов Ю. Л. Взаимодействие кожи с влагой, Гизлегпром, 1962.
- Михайлов А. Н. Химия дубящих веществ и процессов дубления, Гизлегпром, 1953.
- Химия и технология кожи и меха: Учебник для вузов. — 4-е изд., перераб.и доп./И. П. Страхов, И. С. Шестакова, Д. А. Куциди и др., М., Легпромбытиздат 1985.

