Рассмотрены действия солей, кислот и щелочей на коллаген. Приведены обводнение, нажор и обезвоживание шкур. Обсужден суммарный эффект теории осмотического давления, основанного на уравнении Доннана, электростатических сил и ион-дипольного взаимодействия.
Ключевые слова: соль, кислота, щелочь, электролит, раствор, коллаген, нажор, температура, концентрация, белок, аминокислота, осмотическое давление, электростатические силы, ион-дипольное взаимодействие, ион, диффузия, дерма.
Is considered actions of salt, acids and alkalis on. Is given obvobnen, najor and of skins. The total effect the theory osmotic of pressure, osnovon on the equation Donnan, electrostatic forces and ion — dipol of interaction is discussed.
Key words: salt, acid, alkali, solution, temperature, concentration, fiber, osmotic pressure, electrostatic forces, ion — dipol of interaction, ion, diffuziya, derma.
Подготовительные физико-химические процессы обработки кожевенного и мехового сырья протекают в растворах электролитов: солей, кислот и щелочей.
Коллаген шкуры отличается большой гидрофильностью. Шкура в парном состоянии содержит значительное количество влаги: влагу гидратации и влагу набухания.
Влага гидратации связана с ионизированными группами белка (–NH3+, –COO– и др.) за счет ион-дипольного взаимодействия или же с пептидными и гидроксильными группами белка водородными связями.
С помощью ядерного магнитного резонанса доказано, что диполи воды связаны трехспиральной частицей коллагена межмолекулярно и что структура связанной воды ориентирована так же строго, как и структура льда. Влага гидратации органически входит в структуру коллагена и в определенной степени ее стабилизирует. Поэтому она не выделяется даже при механическом давлении в несколько десятков миллионов паскалей, не способна растворять другие вещества, и ее диэлектрическая константа близка к константе льда.
Количество влаги гидратации, по данным различных исследователей, составляет 20–60 % от массы сухого белка.
Влага набухания представляет собой остальную часть влаги, содержащейся в шкуре. Полярные группы белка способны с постепенно уменьшающейся энергией притягивать до шести молекул воды, поэтому при погружении дермы даже в чистую воду она набухает. Особенно сильное набухание дермы происходит в растворах щелочей и кислот.
Влага набухания удаляется из белка гораздо легче, чем влага гидратации. Внедрение ее в дерму связано с увеличением объема последней, а удаление, наоборот, — с его уменьшением. По своим свойствам влага набухания не отличается от обычной воды.
В щелочной и кислой среде происходит дополнительное усиленное обводнение белков дермы, которое в практике кожевенного и мехового производства называют нажором. Степень нажора дермы в подготовительных процессах существенно влияет на качество готовой продукции.
Классической теорией, объясняющей причины нажора, является осмотическая, основанная на уравнении Доннана. В кислой и щелочной среде белок ионизируется (рис 1).
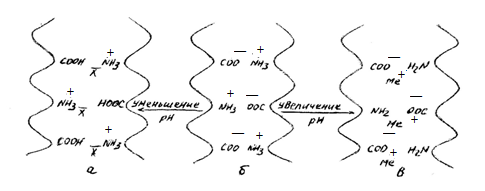
Рис. 1. Схема изменения зарядов в коллагене в зависимости от рН: а — кислая среда; б — изоэлектрическая точка; в — щелочная среда.
Дерму шкуры рассматривают как систему, в которую вода, низкомолекулярные вещества и их ионы способны диффундировать и в которой заряженные центры (группы) белка фиксированы, поэтому возможно только односторонняя диффузия, т. е. явление осмоса. Следовательно, возникает осмотическое давление.
При погружении дермы в раствор щелочи ионы последней диффундируют внутрь дермы до достижения равновесного состояния. Если обозначить концентрацию катиона и аниона во внешнем растворе х, концентрацию неподвижных ионов в дерме и компенсирующих их ионов z, а концентрацию ионов щелочи, пропитывающих дерму, у, то равновесное состояние выразится следующей схемой:
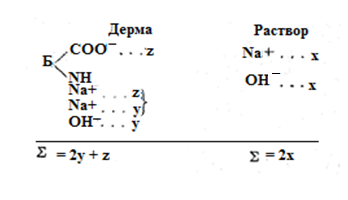
По теории Доннана в состоянии равновесия для правой и левой частей схемы должно соблюдаться равенство произведений концентраций ионов (строго говоря, активностей ионов): xx= y(z+y).
С помощью элементарного математического приема можно доказать, что сумма концентраций ионов внутри дермы (2у+z) больше суммы концентраций ионов во внешнем растворе (2х). Примем, что х — сторона квадрата, а у и (у+z) — cтороны прямоугольника:
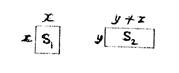
По условию уравнения х2=у(у+z), т. е. S1=S2. Периметр неравностороннего прямоугольника всегда больше приметра квадрата равновеликой площади: 4х<2у+2 (у+z), или 2х<2у+z; следовательно, внутри дермы имеется избыточное количество ионов е = 2у+z — 2x.
Благодаря избытку ионов внутри дермы вода будет впитываться в дерму, как во внутреннюю ячейку осмометра. Под влиянием этого избытка внутри дермы возникает осмотическое давление, что и является причиной нажора. Для объяснения кислотного нажора применимы все эти положения с той лишь разницей, что белок будет иметь положительный заряд, компенсирующим будет кислотный анион, а х и у будут соответственно выражать концентрацию ионов кислоты.
Однако осмотическая теория не может полностью объяснить причины нажора. Из практики кожевенного производства хорошо известно, что с повышением температуры нажор уменьшается, а согласно осмотической теории он должен увеличиваться. Исследования показали, что осмотическое давление, создающееся внутри дермы, в несколько раз меньше фактического давления, возникающего при нажоре. В возникновении нажора существенная роль принадлежит электростатическим силам.
В трехспиральной структуре коллагена аминокислоты, имеющие заряженные боковые цепочки, концентрируются в определенных полярных зонах (рис.2, а), которые чередуются с гидрофобными зонами (рис.2, б). В нативном состоянии разноименные заряды взаимно компенсируются. Если же шкура обрабатывается раствором электролита, то это равновесие нарушается.
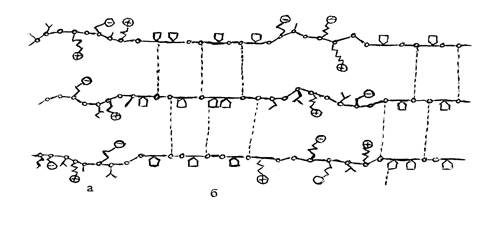
Рис. 2. Схема расположения полярных (а) и неполярных (б) аминокислот в молекуле коллагена
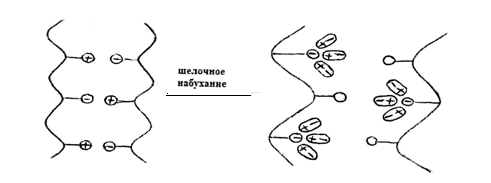
Рис. 3. Схематическое изображение электростатического фактора нажора.
В кислой среде благодаря протонированию карбоксильные группы становятся незаряженными, а положительно заряженные аминогруппы придают белку положительный заряд; в щелочной среде — наоборот. Так как в щелочной или кислой среде в структуре белка сохраняются лишь одноименные заряды (рис 3), то между ними возникает электростатическое отталкивание, облегчающее проникание воды внутрь структурных элементов и приводящее к их деформации; происходят сокращение их в продольном направлении и резкое увеличение в поперечном. Одновременно заряженные центры белка интенсивно притягивают полярные молекулы (диполи) воды — возникает ион-дипольное взаимодействие. Это также является причиной усиленного нажора дермы.
Таким образом, нажор является суммарным эффектом трех факторов:
- осмотического давления, возникающего вследствие неравномерного распределения ионов между дермой и внешним раствором;
- ион-дипольного взаимодействия молекул воды с заряженными группами белка;
- электростатического отталкивания одноименно заряженных групп, вызывающего деформацию структурных элементов белка.
Внешне нажор дермы выражается в резком увеличении ее толщины (на 30÷100 % в зависимости от топографического участка), массы и объема. При сильном нажоре структура дермы становится гомогенной и стекловидной — вода образует с белком единую систему. В результате нажора дерма становится чрезвычайно упругой; степень упругости ее часто используется в качестве критерия величины нажора.
Введение нейтральной соли во внешний (кислый) раствор не сопровождается дополнительной ионизацией белка, а избыточное количество анионов, внесенное солью, подавляет диссоциацию основных групп белка — уменьшается электростатический фактор нажора. Величина z в уравнении снижается, и одновременно растет величина х, вследствие этого уменьшается величина е, уменьшается и осмотический фактор нажора. Поэтому при добавлении в определенном количестве нейтральной соли к раствору кислоты (процесс пикелевания) нажора полуфабриката не происходит.
Степень нажора зависит от температуры. Повышение температуры, с одной стороны, повышает осмотическое давление (р=сРТ) и связанное с ним набухание, а с другой — снижает ион-дипольное взаимодействие между заряженными центрами белка и диполями воды. Преобладание последнего фактора является причиной уменьшения степени нажора с повышением температуры.
При действии кислот и щелочей на коллаген происходит также химическое связывание их с аминными и карбоксильными группами белка, образовавшимися вследствие нарушения электровалентных связей в его структуре; чаще всего этот процесс обратим, но в некоторых случаях, например, при обработке гидроксидом кальция Са(ОН)2, образуется слабодиссоциирующее соединение, причем Са (II) блокирует два заряженных центра (–СОО–), принадлежащих либо одной полипептидной цепочке, либо двум смежным цепочкам.
Количественно способность химического связывания характеризуется кислотной или щелочной емкостью.
Водородные связи, присутствующие в большом количестве в коллагене, в кислой и особенно в щелочной среде в значительной степени нарушаются. При интенсивном воздействии кислот и щелочей возможно разрушение даже ковалентных связей (гидролиз пептидных групп). Частичная дезагрегация структуры коллагена, происходящая в подготовительных процессах, способствует проведению последующего дубления и является одним из факторов, регулирующих физико-механические и упругопластические свойства готовой кожи в желаемом направлении.
Выше указывалось, что при производстве кожи и меха в качестве регуляторов степени нажора используют соли. Степень набухания или обезвоживания зависит от вида соли и ее концентрации в растворе.
По способности солей вызывать набухание или обезвоживание дермы их разделяют на три группы. Эта способность обусловлена двумя одновременно действующими в противоположном направлении факторами:
- взаимодействием ионов соли, приводящим к ослаблению межмолекулярных связей в структуре белка и вследствие этого к набуханию и понижению температуры сваривания дермы. Местом присоединения соли к белку в первую очередь являются боковые амино- и карбоксильные группы, а также гидроксильные группы. Возможна адсорбция солей пептидными группами, которые имеют слабо выраженный амфотерный характер.
- обезвоживающим действием аниона или катиона соли, способствующим сближению элементов структуры, усилению межмолекулярного взаимодействия в коллагене и повышению температуры сваривания.
Если преобладает первый фактор, то при добавлении соли к раствору кислоты или щелочи нажор дермы в системе уменьшаться не будет, а при добавлении некоторых солей даже возрастает.
Преобладание второго фактора типично для сульфатов, растворы которых вызывают обезвоживание дермы и резкое снижение нажора при добавлении к растворам кислот и щелочей.
Хлорид натрия NaCl, широко используемый в кожевенном и меховом производстве, занимает промежуточное положение, преобладание первого или второго фактора зависит от его концентрации в растворе.
При малых (2 %) концентрациях эта соль способствует набуханию дермы, а при больших (более 5 %) концентрациях оказывает обезвоживающее действие как сама по себе, так и вместе с раствором кислоты.
Поглощение ионов соли в большинстве случаев происходит избирательно, т. е. преимущественно связывается катион или анион. Например, из раствора хлорида кальция поглощается главным образом ион Са2+. Вследствие этого создается неуравновешенность зарядов, т. е. незначительный избыток положительно или соответственно отрицательно заряженных групп, что и является причиной набухания белка под действием рассмотренных выше факторов. Однако анионы и катионы солей сами имеют сродство к воде. В зависимости от вида соли и поляризующей способности входящих в нее ионов интенсивность взаимодействия соли с водой может оказаться выше, чем у белка.
В этом случае набухание уменьшается вплоть до обезвоживания. Например, анион SO42+ cпособен гидратироваться с присоединением до 40 диполей воды; он меньше других адсорбируется дермой, но обладает наибольшей обезвоживающей способностью.
В результате обезвоживания объем дермы уменьшается, сопротивление ее деформации сжатия значительно возрастает, происходит сближение структурных элементов — мельчайшие капилляры сжимаются, а межпучковые пространства увеличиваются, и проницаемость дермы возрастает.
Литература:
1. Lasek W. Kolagen, Warzawa, WNT, 1978.
2. Павлов С. А., Шестакова И. С., Касьянова А. А. Химия и физика высокомолекулярных соединений в производстве искусственной кожи, кожи и меха. М., Легкая индустрия, 1976.
3. Михайлов А. Н. Химия и физика коллагена кожного покрова. М., Легкая индустрия, 1980.
4. Schmidt A., Heidemann des Veranderung des Quellungsverhaltens von Kollagen nach Sausbehandlung. — Das Leder, 1976, N 4, S. 61–64.
5. Химия и технология кожи и меха: Учебник для вузов. — 4-е изд., перераб.и доп./И. П. Страхов, И. С. Шестакова, Д. А. Куциди и др., М., Легпромбытиздат, 1985.







