В данной работе рассмотрена гипотеза о вкладе явления волнового резонанса в химическую кинетику и его возможное влияние на скорость химической реакции. Главной идеей предложенной гипотезы является явление резонанса между молекулами-реагентами, согласно принципу корпускулярно-волнового дуализма проявляющими так же волновые свойства. В качестве математического аппарата для описания этого физического явления использованы формулы де Бройля. Также в работе приведены конкретные примеры возможного вклада волнового резонанса в химическую кинетику.
Ключевые слова: химическая реакция, волновой резонанс, длина волны, химическая кинетика, скорость.
Введение
Согласно принципу корпусклярно-волнового дуализма, предложенному в 1924 году французским физиком Луи де Бройлем, любая материальная частица обладает как свойствами волны, так и свойствами частицы. У каждого физического тела или системы тел (планета, человек, молекула, атом, электрон и т. п.) более ярко выражено одно из этих свойств (либо волновое, либо корпускулярное), но и противоположное свойство тоже присутствует, хотя менее выражено.
Рассмотрим формулу де Бройля для длины волны:
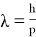
где h — постоянная Планка.
Согласно данной формуле, любой частице, обладающей импульсом, соответствует длина волны, связанная с импульсом частицы тем же соотношением, что и для фотона. С одной стороны, длина волны вычисляется по формуле (1)
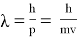
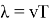
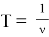
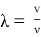
Тогда
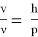
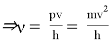
где h — постоянная Планка. [1]
Покажем, что у любого физического тела более ярко выражено только одно из свойств — волновое либо корпускулярное. Вычислим частоту электрона, движущегося со скоростью
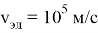
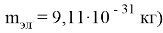
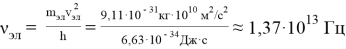
Тогда длина волны
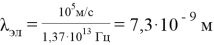
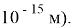
Вычислим «частоту» и «длину волны» человека c массой
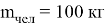
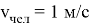
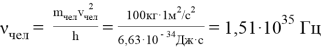
При этом длина волны равна
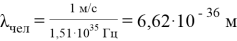
Таким образом, у электрона более ярко выражены волновые свойства, а у человека корпускулярные. Гипотеза де Бройля объяснила некоторые эксперименты, не имеющие объяснения в рамках классической физики, такие как дифракцию нейтронов на кристаллах, опыт Томсона по дифракции электронов на фольге, дифракцию электронов на кристаллах никеля (опыт Дэвиссона — Джермера), аномальное уменьшение сечения рассеяния электронов атомами аргона (Эффект Рамзауэра) и др. [2]
Гипотеза влияния волнового резонанса на скорость химических реакций
Существуют факторы, влияющие на скорость химической реакции: концентрация реагентов и продуктов, природа реагентов и продуктов реакции, давление (для случая газов), площадь поверхности соприкосновения (для случая твёрдых веществ и жидкостей), температура, при которой происходит реакция, наличие веществ, влияющих на ход реакции (катализаторы, ингибиторы, промоторы, каталитические яды). Некоторые из этих факторов были известны ещё в 19 веке. Например, закон действующих масс, описанный в 1867 году норвежскими учёными Ове Гульдбергом и Петером Вааге, гласит, что скорость химической реакции прямо пропорциональна действующим массам, т. е. концентрациям реагирующих веществ. Правило Вант-Гоффа, сформулированное в 1884 году нидерландским химиком Якобом Хенри Вант-Гоффом, утверждает, что при повышении температуры на каждые 10 градусов в ходе химической реакции её скорость увеличивается в 2–4 раза. [3] Предположим, что волновой резонанс наряду с другими факторами также влияет на скорость химической реакции. Рассмотрим технологию синтеза аммиака в колонне синтеза [4]. Известно, что тепловая скорость молекул газа является усреднённой величиной. Молекула газа имеют различные скорости, сильно варьирующие по значению. В газе найдутся молекулы-реагенты, имеющие одинаковые импульсы
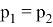
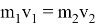
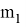
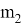
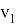
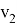
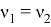
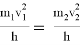
При совпадении частот колебаний волн молекул-реагентов произойдёт явление резонанса, заключающееся в усилении колебаний волн [5], что может привести к увеличению скорости взаимодействия реагентов, то есть повлияет на кинетику химической реакции.
Также можно привести аналогию с химическими реакциями между энзимами. Возможно, именно за счёт волнового резонанса скорость реакций между некоторыми энзимами по не известным на настоящее время причинам выше скорости диффузии [6].
Заключение
Таким образом, в данной работе предложена гипотеза влияния явления волнового резонанса на скорость химических реакций, обоснованием которой является концепция корпускулярно-волнового дуализма. Согласно этой гипотезе, интерференция волн де Бройля, отражающих волновую природу частиц, может влиять на кинетику химической реакции.
Литература:
- Фейнман Р., Лейтон Р., Сэндс М. Фейнмановские лекции по физике. — Москва: Мир, 1976.- 496 с.
- Мартинсон Л. К., Смирнов Е. В. Квантовая физика. — Москва: МГТУ им. Н. Э. Баумана, 2004.- 496 с.
- Романовский Б. В. Основы химической кинетики. — Москва: Экзамен, 2006.- 415 с.
- Широносов В. Г. Резонанс в физике, химии и биологии.- Ижевск: Издательский дом “Удмуртский университет”, 2000.- 92 с.
- Кузнецов Л. Д., Дмитренко Л. М., Рабина П. Д., Соколинский Ю. А. Синтез аммиака. — Москва: Химия, 1982.- 296 с.
- Hsieh M., Brenowitz M. Comparison of the DNA association kinetics of the Lac repressor tetramer, its dimeric mutant LacIadi, and the native dimeric Gal repressor. J. Biol. Chem.: journal. — 1997. — August (vol. 272, no. 35).

