Железо является одним из самых распространённых химически элементов на планете Земля и занимает второе место после алюминия. По своей важности трудно переоценить роль железа в жизни человека, из сплавов которого изготавливаются большинство технических устройств, машин, станков и изделий бытового назначения. Археологические находки говорят о том, что железо люди стали использовать для изготовления предметов ещё 4 тысячи лет до н. э. и сегодня это «металл № 1" в мире [3].
Сам по себе химический элемент — железо — в чистом виде находится только в ядре земли, в мантии нашей планеты накапливается закисное железо — FeO. В коре земли, наиболее доступной для использования живыми существами, чаще всего накапливается окисное трёхвалентное железо Fe2O3 в составе осадочных пород. Источником железа служат такие руды и минералы, как железняк (гематит — Fe2O3), магнитный железняк (магнетит — FeFe2O4, Fe3O4), бурый железняк или лимонит (гётит — FeOOH), которые содержат до 70–72,4 % железа в своём составе. В природе также широко распространены сульфиды железа (пирит — FeS2), карбонат железа (сидерит — FeCO3), соединения с мышьяком и серой (лёллингит — FeAs, миспикель — FeAsS), гидросульфаты и гидрофосфаты железа (мелантерит — FeSO4·7H2O), а также около двух десятков минералов, открытых в ХХ и XXI веке (ильменит, ярозит, фиброферрит, магномагнетит, кокимбит, рёмерит, гиперстен, эгирин, андрадит, нонтронит и другие). В целом содержание железа в земной коре составляет около 5 % и его количество увеличивается в местах естественной вулканической активности. Железо в виде растворов солей встречается в водных источниках, при этом в морской воде его концентрация составляет 0,002–0,02 мг/л, а в речной воде его уровень достигает 2 мг/л [3, 6, 7].
По химическим свойствам железо чаще всего имеет две степени окисления +2 и +3. Двухвалентное железо и его соединения имеют основный характер и проявляют свойства слабого восстановителя. Трёхвалентное железо и его соединения имеют амфотерные свойства и проявляют способности слабого окислителя. Также существуют соединения шестивалентного железа (ферраты), которые имеют окислительные свойства. Реже встречаются соединения, где железо проявляет степени окисления: -2, -1, 0, +1, +4, +5. В последние десятилетия проводят исследования восьмивалентного железа [4, 6].
Железо играет большую роль в биохимических процессах живых клеток. Недостаток этого химического элемента может привести к нарушениям жизнедеятельности растений, животных и человека. В тоже время и переизбыток железа в продуктах питания, в воде, в почве отрицательно сказывается на биохимических процессах живых клеток или, например, даёт конкурентное преимущество железобактериям над другими видами живых существ и нарушает баланс экосистем в целом [1, 2]. По этой причине в настоящее время приняты санитарные нормы уровня железа в воде, используемой для питья, который составляет не более 0,3 мг/л, вода с уровнем железа 0,4–1 мг/л считается условно пригодной, а при концентрации железа более 1 мг/л использовать воду для питья считается опасным для здоровья [8].
Для определения содержания железа в водных растворах или природной воде в настоящее время используются три основных индикатора: 1) для определения соединений двухвалентного железа — гексацианоферрат (III) калия (К3 [Fe(CN)6] — красная кровяная соль); 2) для определения соединений трёхвалентного железа — гексацианоферрат (II) калия (К4 [Fe(CN)6] — жёлтая кровяная соль) и калия роданид (KSCN). Прибавление данных индикаторов к подкисленному раствору солей железа сопровождается выпадением синего осадка турбуленовой сини (двухвалентное железо), берлинской лазури (трёхвалентное железо) или интенсивным красным окрашиванием раствора (c роданидом калия) [8, 9].
Качественные (цветные) реакции на наличие соединений железа наиболее чувствительны при его высоких концентрациях. При этом, чем ниже содержание вещества в растворе, тем окраска становится слабее. На определённом достаточно низком уровне содержания железа, изменение окраски индикатора может быть незаметно невооружённым взглядом и в лабораторных условиях для таких случаев используют методику фотометрии. Суть этого метода заключается в том, что при низком уровне содержания железа едва заметное изменение окраски растворов после добавлении соответствующих индикаторов можно уловить, пропуская через этот раствор свет определённой волны. Изменение волновой характеристики света, которое происходит при его прохождении через раствор, отличающийся от стандартного, регистрируется в приборах — фотометрах и преобразуется в электрические импульсы, которые исследователь получает в виде цифрового отображения результата. Для точного определения концентрации исследуемого вещества в растворе, первоначально строится график полученных значений фотометрии от 0 до некоторого максимального уровня концентрации вещества, порог значения которое определяется исследователем. В последующем результат постановки реакции с раствором с неизвестным уровнем исследуемого вещества сопоставляется с графиком фотометрии и по нему определяется уровень содержания данного соединения [5, 6].
Методика фотометрии требует соответствующего лабораторного оснащения, в которое входит дорогостоящий аппарат и расходные химические реагенты, а также требует навыков работы и интерпретации полученных данных. Этот метод приемлем для исследовательских лабораторий, но является достаточно сложным и затратным для определения концентрации соединений железа в обыденной жизни для определения пригодности воды для питья, а также в условиях школьной химической лаборатории при выполнении исследовательских работ по направлению химия, экология или биохимия. Это стало основными причиной для поиска практического решения и создания эффективной упрощённой методики определения уровня соединений железа в воде и водных растворах, которая была бы доступной для выполнения юными химиками, а также для быстрого определения пригодности воды для питья в полевых условиях.
Цель исследования — упростить и усовершенствовать методику визуально-колориметрического определения уровня содержания соединений двухвалентного и трёхвалентного железа в питьевой воде и исследуемых водных растворах.
Материалы и методы исследования. Для усовершенствования методики определения концентрации соединений железа в водных растворах были использованы общепринятые реагенты. Для определения соединений двухвалентного железа применяли 2 % раствор гексацианоферрата (III) калия (красная кровяная соль), который в присутствии ионов железа (II) образует осадок турбуленовой сини (1):
FeCl2 + К3 [Fe(CN)6] КFe [Fe(CN)6] + KCl (1)
Для определения в водных растворах соединений трёхвалентного железа использовали 2 % раствор гексацианоферрата (II) калия (жёлтая кровяная соль) и 50 % раствор калия роданида. В ходе реакции с жёлтой кровяной солью происходит образование синего осадка берлинской лазури, что соответствует схеме реакции (2):
FeCl3 + К4 [Fe(CN)6] КFe [Fe(CN)6] + KCl (2)
Прибавление к растворам железа (III) роданида калия сопровождается реакцией обмена и появлением красного окрашивания раствора различной интенсивности (3):
FeCl3 + KSCN FeSCN + KCl (3)
Указанные реакции позволяют выполнить качественное определение содержания соединений железа (II) или железа (III) в том или ином исследуемом растворе. Для определения концентрации того или иного соединения железа, помимо изменения цвета раствора, было необходимо оценить особенности изменения его окраски в зависимости от его уровня содержания. С этой целью нами были использованы аптечные препараты железа с точно известной дозой. В качестве стандартного реагента двухвалентного железа использовали Сорбифер, одно драже которого содержит 100 мг двухвалентного железа (в составе 320 мг сульфата железа). В качестве стандартного реагента трёхвалентного железа использовали препарат Феррум Лек, 2 мл которого содержат 100 мг трёхвалентного железа (в составе комплекса гидроксида железа (III) с декстраном).
В соответствии с необходимыми условиями постановки качественной реакции на соединения железа для его ионизации в водной среде к растворам реагентов чаще всего добавляют растворы кислот. В литературе с этой целью предлагают использовать соляную, уксусную, аскорбиновую и другие кислоты [5, 6, 7]. В ходе исследований для постановки реакций мы использовали более доступную 9 % уксусную кислоту.
Для получения результатов изменения цвета раствора при изменении концентрации железа в нём, исходные стандартные реагенты — соединения двухвалентного и трёхвалентного железа были растворены в 50 мл дистиллированной воды. При этом драже препарата Сорбифер предварительно было измельчено до мелкого порошкообразного состояния в мраморной ступке, а затем соединено с водой и тщательно растворено до полного исчезновения осадка. После растворения 100 мг соединений железа (II) и железа (III) для постановки реакции из каждого раствора взяли по 1 мл, который содержал соответственно 2 мг двухвалентного или 2 мг трёхвалентного железа (рис. 1).
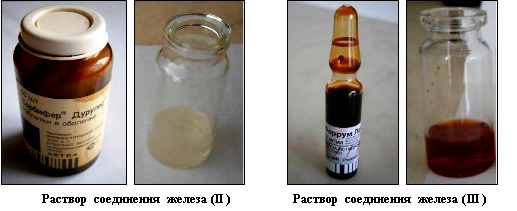
Рис. 1. Внешний вид растворов соединений двухвалентного и трёхвалентного железа
Результаты исследований. Для получения представлений об изменении цвета раствора после реакции с соответствующим индикатором было выполнено 11 кратное разбавление исходных растворов. Для этого из флакона с исходным объёмом 1 мл (2 мг соединений железа) с помощью шприца извлекали 0,5 мл раствора (1 мг соединения железа), перемещали во второй флакон и доводили объём до 1 мл. На следующем этапе из второго флакона забирали 0,5 мл раствора (0,5 мг соединений железа), который перемещали в третий флакон и вновь доводили объём до 1 мл. Согласно такому принципу производили 11 поэтапных разведений исходного раствора, содержащего 2 мг железа, до достижения концентрации железа, равной 0,001 мг/мл (1 мг/л), что считается пороговым значением для условно-безопасного уровня железа в питьевой воде (рис. 2).

Рис. 2. Внешний вид флаконов 2 серий после 11-кратного разведения исходного раствора соединения железа (III) до постановки реакции
Для получения более точных результатов разведения растворов двухвалентного и трёхвалентного железа производили в двух сериях (контроль — исследование), чтобы была возможность сравнить изменение цвета растворов после реакции во флаконах с добавлением кислоты и индикаторов (исследование) и во флаконах с добавлением только раствора кислоты. Каждую серию опыта с разведением и добавлением индикаторов для определения двухвалентного и трёхвалентного железа повторили по 5 раз и получили идентичные изменения окраски растворов.
После проведённых серий опытов наиболее чёткие изменения окраски были получены при использовании жёлтой и красной кровяной соли, а реакция с роданидом калия и изменение окраски раствора оказались менее заметными, так как исходно раствор трёхвалентного железа имел оттенки красно-коричневого и желтоватого цвета и после добавления индикатора их интенсивность и оттенок менялись незначительно. Результат изменения окраски серии разведений раствора трёхвалентного железа при реакции с жёлтой кровяной солью представлен на рисунке 3.

Рис. 3. Изменение окраски раствора при реакции железа (III) с жёлтой кровяной солью (15 минута опыта)
Окраска раствора во флаконах изменилась с желтовато-оранжевой на оттенки салатного и болотного цветов, интенсивность которых была максимальной на 15–20 минуте опыта. Результат изменения окраски серии разведений раствора двухвалентного железа представлен на рисунке 4.

Рис. 4. Изменение окраски раствора при реакции железа (II) с красной кровяной солью (1 и 15 минута опыта)
Качественную реакцию на наличие двухвалентного железа с красной кровяной солью отличает более чёткое и быстрое изменение цвета на оттенки от нежного зелёно-голубого до интенсивного ярко-голубого и синего тонов. При этом изменения цвета становились максимальными и более не изменялись на 15–20 минуте постановки опыта.
При выполнении качественной реакции в каждом из флаконов с различными разведениями были использованы одни и те же объёмы и соотношения реагентов: на каждый 1 мл раствора соединений железа (II) или железа (III) добавляли 0,5 мл 9 % раствора уксусной кислоты и 1 мл 2 % красной кровяной или 2 % жёлтой кровяной соли. Равные соотношения и время постановки реакции (20 минут), позволили получить наиболее достоверный результат, так как цвет растворов после добавления реактивов оставался одинаковым при различных концентрациях соединений железа при 5-кратном повторении опыта с 12 разведениями растворов.
На заключительном этапе работы для практического удобства была создана цветная колориметрическая шкала соответствия оттенков окраски раствора после реакции с индикатором при различной концентрации соединений железа. При этом цвет растворов при реакции красной кровяной соли с железом (II) придавал растворам оттенки от светло-зелёного до синего цветов, а реакция железа (III) с жёлтой кровяной солью изменяла цвет растворов от ярко жёлтого и жёлто-зелёного до буро-зелёного или синего цвета (рис. 5).
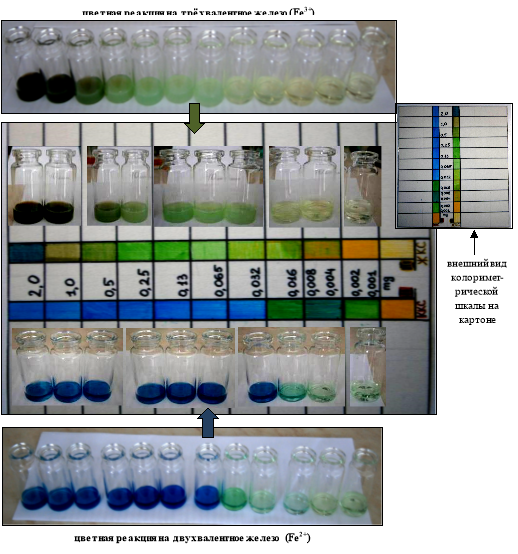
Рис. 5. Внешний вид и принцип создания колориметрической визуальной шкалы для определения концентрации железа (II) и железа (III) в воде
Колориметрическая шкала-планшет была изготовлена из белого картона, на котором в таблице были перечислены концентрации железа, и рядом с этими значениями ячейки таблицы были окрашены с помощью фломастеров в оттенки цветов, соответствующих окраске растворов в результате серии опытов. Применение данной колориметрической шкалы позволяло упростить количественное определение уровня железа в любой жидкости, за счёт исключения необходимости постановки опыта с разведениями стандартного раствора соединений железа для последующего сравнения результатов с исследуемой жидкостью и определения его уровня.
Опыт с практическим применением колориметрической шкалы-планшета. После завершения работы над созданием визуальной колориметрической шкалы для проверки возможности практического использования были выполнены 3 опыта с образцами воды, которые были получены в разные сроки после ремонта квартирной водопроводной системы.
Первые два образца воды отличались наличием явных признаков присутствия соединений железа (№ 1 — интенсивный запах железа, тёмно-коричневый цвет, № 2 — ощутимый запах железа, желтоватый цвет) (рис. 6).

Рис. 6. Результаты исследования питьевой воды на содержание соединений железа (II) и железа (III) сразу после завершения ремонта водопроводной системы
При постановке реакции отмечено наличие соединений трёхвалентного железа в обеих пробах воды, при этом цвет растворов в пробах № 1 и № 2 в ходе реакции соответственно прибрёл оттенки зелёно-голубого и серо-изумрудного (светло-бурого) цветов, что соответствовало содержанию трёхвалентного железа (железо III), равного 0,25 мг/мл (проба № 1) и 0,065 мг/мл (проба № 2).
Через 1 сутки после ремонта водопроводной системы вода стала прозрачной, а присутствие характерного железного запаха было едва заметным. При исследовании пробы этой воды (проба № 3) было выявлено присутствие ионов трёхвалентного железа. При этом раствор с добавлением жёлтой кровяной соли приобрёл чёткий жёлто-зелёный оттенок, что по колориметрической шкале-планшету соответствовало уровню трёхвалентного железа, равному 0,016 мг/мл (рис. 7).

Рис. 7. Результат исследования воды на содержание соединений железа (II) и железа (III) через 1 сутки после ремонта водопроводной системы
Через 7 суток после проведённого ремонта вкус и запах воды изменился в лучшую сторону и потерял ранее имеющийся металлический оттенок. В этот момент было проведено повторное исследование воды (проба № 4), которое не выявило изменений цвета раствора с добавлением и отсутствием (контроль) индикаторов, что в равной степени могло соответствовать как полному отсутствию соединений железа, так и наличию его в концентрациях ниже верхней границы условно-безопасного уровня содержания в питьевой воде, равного 1 мг/л (0,001 мг/мл). Этот уровень оказался нижним пороговым значением концентрации железа, возможным для определения с помощью созданной нами шкалы-планшета и разработанной упрощённой методики визуально-колориметрической оценки уровня соединений железа в воде и водных растворах (рис. 8).
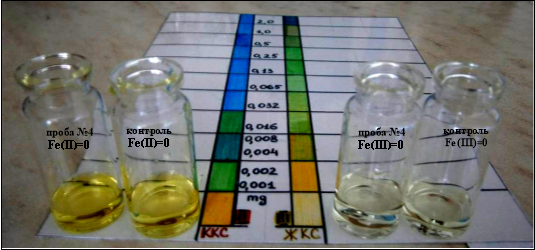
Рис. 8. Результат исследования воды на содержание соединений железа (II) и железа (III) на 7 сутки после ремонта водопроводной системы
Анализируя полученные результаты и учитывая современные принятые нормы содержания соединений железа в питьевой воде не выше 0,3–1 мг/л, концентрация соединений железа в пробах воды № 1 (0,25 мг/мл — 250 мг/л), № 2 (0,065 мг/мл — 65 мг/л), № 3 (0,016 мг/мл — 16 мг/л) в первые и вторые сутки после ремонта водопроводной системы, превышали установленный нормальный порог в 53–217 раз, а условно-безопасный уровень в 16–250 раз.. При этом через 7 дней после ремонта водопровода (проба № 4) содержание соединений железа было ниже 1 мг/л (ниже 0,001 мг/мл), что позволяло признать воду условно-безопасной для питья. Попытки определить более низкие концентрации железа, включая пороговое значение 0,3 мг/л (0,0003 мг/мл)? оказались безуспешными, так как не позволяли после завершения реакции невооружённым взглядом выявить отличий окраски исследуемого раствора и контроля и требовали для этого изменения условий постановки реакции и объёмов реагентов.
Заключение. Железо является достаточно широко распространённым химическим элементом, который имеет важное биологическое значение. Наряду с недостатком железа важное значение для человека, животных и растений имеет и его высокое содержание в пище, почве и воде. Биологическая и химическая активность двухвалентного и трёхвалентного железа отличаются и могут оказывать как положительное влияние, так и отрицательное, вредное воздействие на живые организмы. Для предупреждения этих воздействий достаточно актуальным является разработка наиболее простых и легко используемых методик определения концентрации соединений железа в питьевой воде и водных растворах. Использование стандартных индикаторов наличия двухвалентного и трёхвалентного железа позволяет выполнить качественную реакцию, отвечающую на вопрос о наличии или отсутствии железа с той или иной степенью окисления. Для определения точной концентрации соединений железа необходимо дополнительно использовать специальные аппараты — фотокалориметры или спектрографы, что усложняет методику постановки реакции и увеличивает материальные затраты для исследований. Предложенный нами способ визуально-колориметрического определения концентрации соединений железа в водных растворах с помощью разработанной колориметрической шкалы-планшета позволяет упростить методику определения железа, снизить материальные затраты, включающие расходные реагенты и расширить возможности практического использования методики. Такой метод позволяет быстро оценить условно-безопасный уровень содержания железа в питьевой воде, а также может быть использована юными исследователями — школьниками при изучении химического состава различных водных источников, водных растворов и извлечений из продуктов питания, растений, образцов почвы, минералов и так далее. Разработанная визуально-колориметрическая шкала-планшет и методика индикации ионов двухвалентного и трёхвалентного железа может быть использована в полевых условиях для быстрого определения уровня железа и степени безопасности водных источников питьевой воды при невозможности использования или отсутствии специализированной аппаратуры.
Литература:
- Грин Н., Стаут У., Тейлор Д. Биология: В 3-х томах. Т.1.: Пер с англ. /Под ред. Р. Сопера. — М.: Мир, 1990. — 368 с.
- Грин Н., Стаут У., Тейлор Д. Биология: В 3-х томах. Т.2.: Пер с англ. /Под ред. Р. Сопера. — М.: Мир, 1990. — 325 с.
- Карл Бакс. Богатства земных недр. М.: Прогресс, 1986. — 467 с.
- Киселёв Ю. М., Копелев Н. С., Спицын В. И., Мартыненко Л. И. Восьмивалентное железо // Доклады АН СССР. — 1987. — Т. 292. — С. 628–631
- Кнорре Д. Г. Биологическая химия. — Москва: Высшая школа, 2003. -479 с.
- Химическая энциклопедия: в 5 тт. / Редкол.: Кнунянц И. Л. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с.
- Хомченко Г. П. Пособие по химии для поступающих в вузы. — 4-е изд. испр. и доп. — М.: РИА «Новая волна»: Издатель Умеренков, 2016. — 480 с.
- http://rospotrebnadzor.ru/documents/details.php «Нормы физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации».

