Актуальность
Вокруг нас окружают соединения и вещества различных цветов, в том числе самым интересным явлением в природе является возникающая на небе радуга [10]. Почему вещества имеют разные цвета, а некоторые соединения изменяют свою окраску подобно хамелеонам? Возможно ли получить материал-хамелеон, способный изменять окраску? Это актуально в свете развития новых разработок в области нанотехнологий.
Цель: Исследовать свойства неорганических веществ-хамелеонов.
Задачи:
- Ознакомиться с соединениями, имеющими специфическую окраску.
- Выяснить области применения соединений различной цветовой гаммы.
- Определить от каких факторов зависит цвет различных соединений.
- Подобрать соответствующие реактивы и провести последовательно химические реакции с изменением окраски раствора в одной колбе в цвета радуги.
- Попробовать получить материал-хамелеон.
Рабочая гипотеза. Возможно, с использованием реактивов, содержащих соединения хрома, ванадия, марганца и меди в результате химических реакций осуществить последовательность превращений, в ходе которых будет изменяться окраска раствора в пробирке в порядке цветов радуги.
Новизна Практическим путем осуществлена последовательность химических реакций в одной колбе в порядке цветов радуги. Попытка получения материала-хамелеона.
Объект исследования. Соединения d-элементов: марганца, хрома и ванадия.
Сроки и место проведения исследований. Исследования проводились в лаборатории МОАУ «Лицей № 1» г. Нефтекамск в 2017–18 годах.
Методы исследования: поисково-исследовательский, наблюдение, сравнение, эксперимент.
Практическая часть
Эксперимент 1. Цветная радуга в пробирках. [1], [5], [6], [9], [14].
Для получения цветов радуги в разных пробирках в 7 пробирок сливаем попарно следующие растворы:
В 1-ю пробирку хлорид железа (III) и роданид калия (красный цвет):
FeCl3 + 3KCNS = Fe(CNS)3 + 3KCl
Во 2-ю пробирку: раствор хромата калия подкисляем H2SO4 (оранжевый цвет):
2К2CrO4 + Н2SO4 = К2Cr2O7 + К2SO4 + Н2О
В 3-ю пробирку: нитрат свинца и иодид калия (желтый цвет)
Pb(NO3)2 + 2KI = PbI2 + 2KNO3
В 4-ую пробирку: сульфат никеля (II) и гидроксид натрия (зеленый цвет);
NiSO4 + 2NaOH = Ni(OH)2 + Na2SO4
В 5-ую пробирку: сульфат меди (II) и гидроксид натрия (голубой цвет);
CuSO4 + 2NaOH = Cu(OH)2 + 2Na2SO4
В 6-ую пробирку: сульфат меди (II) и раствор аммиака (синий цвет);
CuSO4 + 4NH3 = [Cu(NH3)4]SO4
В 6-ую пробирку: хлорид кобальта (II) и роданида калия (фиолетовый цвет)
CoCl2 + 2KCNS = Co(CNS)2 + 2KCl



Эксперимент 2. Радуга в 1-ой колбе. [1], [5], [6], [11], [12], [13], [14], [15].
В одной колбе провели реакции, в результате которых происходило изменение окраски раствора в последовательности цветов радуги.
1) Получение красного цвета. В химическую колбу добавили небольшое количество кристаллов оксида хрома (VI) и воду: CrO3 + H2O = H2CrO4
В результате реакции получилась хромовая кислота H2CrO4 красного цвета.
2) Получение оранжевого цвета. Затем в эту же колбу дополнительно добавили кристаллы CrO3: H2CrO4 + CrO3 = H2Cr2O7 дихромовая кислота оранжевого цвета
3) Получение желтого цвета. К полученной дихромовой кислоте добавили избыток щелочного раствора NaOH:
H2Cr2O7 + 4NaOH(изб.) = 2Na2CrO4 + 3H2O получили хромат натрия желтого цвета.
4) Получение зеленого цвета. Затем в колбу добавили сероводородную кислоту. В результате реакции получается зеленый осадок Cr(OH)3, благодаря которому раствор становится зеленым. 2Na2CrO4 + 3H2S + 2H2O = 2Cr(OH)3↓ + 3S + 4NaOH
5) Получение голубого цвета. Если в нашу колбу добавить сульфат меди, то гидроксид натрия, который присутствует в растворе, прореагирует с ним
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4
В результате реакции должен получиться синий осадок Cu(OH)2, но так как в растворе присутствует Cr(OH)3 зеленого цвета, то раствор приобретает голубую окраску.
6) Получение синего цвета. Далее добавили в полученный нами раствор серной кислоты, а затем- гидроксид аммония Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
CuSO4 (изб.) + 4NH4OH = [Cu(NH3)4]SO4 + 4H2O
Получится раствор сульфата тетраамина меди (II) [Cu(NH3)4]SO4 синего цвета.
7) Получение фиолетового цвета. Чтобы получить раствор фиолетового цвета, надо к нашему раствору добавить перманганат калия, который прореагирует с избытком сульфата меди. CuSO4 + 2KMnO4 =Cu(MnO4)2 + K2SO4
Получили раствор перманганата меди Cu(MnO4)2, который имеет фиолетовый цвет — завершающий цвет нашей радуги.
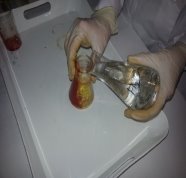







Эксперимент 3. «Постадийное восстановление VO3─ до V2+ металлическим цинком в кислой среде» [4], [11], [14],
Поместили в колбу 0,25г. ванадата аммония NН4VO3 и добавили 20 % раствор соляной кислоты. Получили прозрачный раствор желтого цвета. При добавлении 6–7 гранул цинка к полученному раствору, выделяется атомарный Н2, который постепенно восстанавливает ванадий V до II валентного через промежуточные стадии. Раствор постепенно меняет окраску на голубую, зеленую, и фиолетовую.
Сначала метаванадат аммония восстанавливается до хлорида ванадила VOCl2
голубого цвета: 2 NН4VO3 + Zn + 8HCl = 2VOCl2 + ZnCl2 + 2NH4Cl + 4H2O
Затем хлорид ванадила восстанавливается до хлорида ванадия (Ш) VCl3 зеленого цвета:
2VOCl2 + Zn + 4HCl = 2VCl3 + ZnCl2 + 2H2O
И, наконец, хлорид ванадия (Ш) восстанавливается до хлорида ванадия (II), фиолетового цвета: 2VCl3 + Zn = 2VCl2 + ZnCl2
Реакции восстановления ванадия V+5 протекают ступенчато с образованием промежуточных ионов с характерной окраской: +5 (желтая), +4 (голубая), +3 (зеленая), +2 (фиолетовая).




Эксперимент 4. «Химический хамелеон» (зависимость от рН среды) [6], [9], [11], [14].
В три химических стакана налили малиновый раствор перманганата калия. Прилили немного в первый цилиндр разбавленной соляной кислоты, во второй — воды, а в третий –раствор гидроксида натрия. Затем добавили во все стаканы сульфит натрия и хорошо перемешали стеклянной палочкой. В первом цилиндре мгновенно обесцвечивается раствор, во втором наряду с обесцвечиванием выпадает бурый хлопьевидный осадок, а в третьем малиновая окраска меняется на ярко — зеленую. Можно еще рядом с ними поставить для сравнения малиновый раствор перманганата калия.
В этих опытах видно, как ведет себя перманганат калия в различных средах.
Так в кислой среде он восстанавливается до иона Mn2+(бесцветный раствор):
2КМnО4 + 5Na2SO3 + 6HСl = 2MnСl2+ 3H2O + 5Na 2SO4 + 2KСl
В нейтральной среде восстановление идет до оксида марганца (IV) (бурый осадок):
2КМnО4 + 3 Na 2SO3 + H2О = 2MnO2↓ + 2КOН + 3 Na 2SO4
В сильнощелочной среде образуются ионы MnО42-(зеленый цвет)
2КМnО4 + Na 2SO3 + 2NaOН = 2 Na2MnO4 + K 2SO4 + H2O



Эксперимент 5. Попытка получения материала-хамелеона
Поскольку химический состав каждой поверхности уникален, то он поглощает различные длины волн света [7], [8]. Изменение цвета поверхности требует изменений в химическом составе. Но если попробовать внедрить в наноструктуру углерода (графена) атомы и ионы хрома, который может принимать практически все цветовые гаммы, может удаться получить материал-хамелеон, который будет изменять свою окраску. Тогда такой материал можно было бы использовать и в качестве «плаща-невидимки».
Конечно, для получения такого материала нужны специальное оборудование. Но мы попробовали получить такой материал из активированного угля, соединений хрома и на основе силикона.
1 вариант. Получили материал на основе углерода и соединений хрома. Для этого измельчили уголь в ступке, затем перемешали его с соединениями хрома, разложили как можно тонким слоем на огнеупорную поверхность и нагревали. В результате получили неоднородную смесь темного цвета.
2 вариант. Изготовили материал на основе силикона и соединений хрома. Для этого расплавляли силикон и растирали в ступке со смесью соединений хрома. После охлаждения материал довольно хорошо отделяется от ступки. Полученный материал пока довольно толстый. Под микроскопом видны отдельные кристаллы разноцветных соединений хрома. На свету материал хорошо отражает свет, но окраски различных цветов пока не слишком выявляются. Вот что у нас получилось:



Конечно, это пока только гипотезы и пробные эксперименты, требуется дальнейшее изучение процесса и предстоит довольно трудоемкая и кропотливая работа над получением материала.
8) Результаты исследования
- Изучены свойства соединений, обладающих цветовой гаммой радуги и веществ-хамелеонов [3], [5], [7], [9], [10], [11], [15].
- Ознакомились с областями применения соединений хрома, марганца и ванадия. Химические соединения различной окраски используются в живописи, аналитической химии для определения качественного и количественного состава веществ, текстильной, стекольной, лакокрасочной промышленности и т. д. [1], [3], [5], [7], [9].
- Выяснили, что цвет различных соединений зависит:
1) от взаимодействия света с молекулами вещества [7];
2) у органических веществ цвет возникает в результате возбуждения электронов элемента и их перехода на другие уровни, важно состояние системы электронов всей большой молекулы [2].;
3) у неорганических веществ цвет обусловлен электронными переходами и переносом заряда от атома одного элемента к атому другого, большую роль играет внешняя электронная оболочка элемента [7];
4) на окраску соединения влияет внешняя среда [11];
5) важную роль играет число электронов в соединении [7].
- Подобрали соответствующие реактивы и провели последовательно химические реакции с изменением окраски раствора в одной колбе в порядке цветов радуги.
- Попытались получить материал-хамелеон на основе силикона с соединениями хрома и углерода с соединениями кремния.
Вывод
Исследовали свойства веществ-хамелеонов.
К веществам, способным в результате химических реакций образовывать соединения различных цветов радуги, относятся d-элементы: хром, ванадий.
Марганец, хром и ванадия являются «химическими хамелеонами», способными изменять окраску при переходе в различные степени окисления.
Перспективы исследований. Дальнейшее изучение свойств соединений элементов хрома, меди и марганца.
В перспективе создать такой материал-хамелеон на основе хрома и углерода (или силикона) с использованием новейших разработок в области нанотехнологии, который мог бы изменять окраску по желанию человека, возможно регулируемого через нервные импульсы. Тогда может даже удастся создать материал вроде «плаща-невидимки» или хотя бы материал, который может служить в качестве камуфляжа.
Практическая значимость. Использование полученных знаний на уроках химии при изучении тем «ОВР» [11], «d-элементы» и др., демонстрация опытов на уроках и внеклассных мероприятиях [4]; применение в аналитической химии при проведениях качественного и количественного анализа веществ [1], [6]; [при реставрации картин [3].
Литература:
- Аналитическая химия. Качественный анализ. Г. М. Жаркова, Э. Е. Петухова, Санкт-Петербург «Химия», 1993.(стр.235–236).
- Артеменко А. И. «Органическая химия и человек» (теоретические основы, углублённый курс). Москва, «Просвещение», 2000.
- Киплик Д. И. Техника живописи- М.:СВАРОГ и К, 1998.
- Методическая разработка «Ванадий. Ниобий. Тантал». / Сост. Ю. Е. Еллиев, Ю. Б. Зверев, С. Г. Чеснокова. — Н.Новгород
- Неорганическая химия, Л. Г. Балецкая, Ростов -на-Дону, «Феникс», 2010 (стр272–288).
- Практикум по качественному химическому полумикроанализу. М. В. Михалева, Б. В. Мартыненко, М.: Дрофа, 2007. (стр.72–75).
- Фадеев Г. Н. «Химия и цвет» (книга для внеклассного чтения). Москва, «Просвещение», 1977
- Материал-«хамелеон», изменяющий цвет NanoNewsNet.ru› news/2015/material-khameleon-…
- Наука и жизнь. Занимательно о химии. Из книг В.В Рюмина https://www.nkj.ru/archive.
- Сколько цветов в радуге? Какие цвета в радуге http://fb.ru/article.
- Усова Надежда Терентьевна. Муниципальное общеобразовательное учреждение гимназия № 24 г. томска. Усова Надежда Терентьевна. Химические хамелеоны. Методическая разработка Томск 2006. Usova2.pdf
- Химические опыты с хромом и его соединениями kristallikov.net
- Химия для любознательных | Цветные осадки с хромом alhimik.ru
- Химия в уравнениях реакций. Ж. А. Кочкаров, Ростов -на-Дону, «Феникс», 2017, (стр.182–211, 226–229,213–223).
- Хром и его соединения https://www.tutoronline.ru/blog/hrom-i-ego-soedinenij.

