Органические производные двухвалентной меди — это, прежде всего, соли карбоновых кислот (карбоксилаты), а также различные комплексы меди с многоатомными спиртами, аминокислотами и другими органическими веществами. Хорошо известно, что соединения меди подавляют жизнеспособность живых организмов, причем отрицательное воздействие катионы Cu2+ оказывают как на растения и грибы, так и на животных и человека. Особенно ядовиты соединения меди для микроорганизмов, и в этой связи препараты меди широко используются в качестве наружных лекарственных средств для лечения бактериальных, грибковых поражений кожи [1–4]. Поэтому нами была поставлена цель: изучить реакции синтеза некоторых органических производных двухвалентной меди. В качестве реагентов выбраны легкодоступные и практически важные органические кислоты — винная, лимонная и салициловая (в виде калиевых и натриевых солей). Стартовым соединением меди послужил также легкодоступный и устойчивый медный купорос — пятиводный кристаллогидрат сульфата меди.
Синтез тартрата меди (виннокислой меди).
Исходными веществами для синтеза виннокислой меди (тартрата меди) были двойная соль — виннокислый калий-натрий (сегнетова соль) и медный купорос:
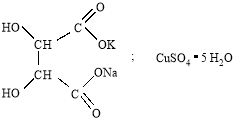
Тартрат меди получали реакцией обмена между виннокислым калием-натрием (сегнетовой солью) и медным купоросом по следующей схеме:
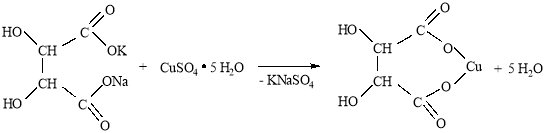
Методика синтеза. Вначале получали водные растворы исходных веществ. Для этого навески сегнетовой соли (10,5 г; 0,05 моль) и медного купороса (12,5 г; 0,05 моль) растворяли в 50 мл дистиллированной воды в химических стаканах на 100 мл (вместо стаканов можно использовать плоскодонные конические колбы). Полученные растворы сливали, в результате чего выпадал осадок виннокислой (тартрата) меди. Осадок отфильтровывали на воронке с бумажным фильтром, промывали 20 мл дистиллированной воды и сушили на воздухе. Масса полученной соли — 10,5 г.
Как известно, соли меди кристаллизуются и образуются в реакциях в виде кристаллогидратов. Поэтому нами проведен анализ полученного соединения на содержание кристаллизационной воды. Для этого навеску соли массой 2,7 г на часовом стекле помещали в сушильный шкаф и выдерживали при температуре 85–90оС до постоянной массы (4–5 часов). При этом происходило обезвоживание навески, и ее масса оказалась равной 2,2 г. Следовательно, масса кристаллизационной воды была равна 0,5 г.
Из полученных данных рассчитывали состав полученного кристаллогидрата:
n (H2O) = m (H2O)/M (H2O) = 0,5 г/18 г/моль = 0,028 моль;
n (соли) = m (соли)/M (соли) = 2,2 г/212 г/моль = 0,01 моль;
отсюда n (соли): n (H2O) = 0,01: 0,028 ≈ 1: 3, следовательно, полученная соль — виннокислая (тартрат) медь представляет собой трехводный кристаллогидрат состава CuC4H4O6 · 3 H2O:
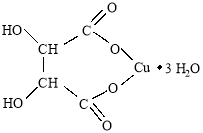
Затем рассчитывали массовую долю выхода соли. Из уравнения реакции находили теоретический выход — масса продукта составила 13,3 г; тогда, как практически получили 10,5 г. Поэтому практический выход трехводного кристаллогидрата тартрата меди: 10,5 г/13,3 г ≈ 0,8 (80 %) от теоретически возможного.
Экспериментально нами установлено, что при повышении температуры выход продукта уменьшался. Это можно объяснить тем, что при нагревании растворимость продукта в воде возрастала и он гидролизовался водой, а скорость гидролиза, как известно, при повышении температуры увеличивается, что и приводило к снижению массовой доли выхода продукта реакции.
Синтез цитрата меди (лимоннокислой меди).
Исходными веществами для синтеза лимоннокислой меди (цитрата меди) были лимонная кислота и медный купорос:
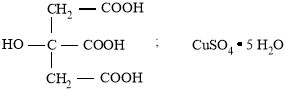
Лимонная кислота не способна реагировать с медным купоросом, так как она намного слабее вытесняемой серной кислоты, поэтому лимонную кислоту вначале переводили в соль реакцией с гидроксидом калия. Для этого навеску лимонной кислоты массой 9,6 г (0,05 моль) растворяли в 20 мл воды и в полученный раствор добавляли при перемешивании 8,4 г (0,15 моль) гидроксида калия. Полученный цитрат калия (его теоретическая масса равна 15,3 г; количество 0,05 моль) использовали без предварительного выделения и очистки:
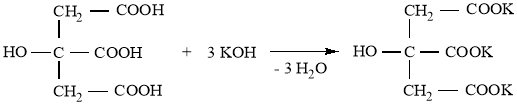
Цитрат меди получали реакцией обмена между лимоннокислым калием и медным купоросом по следующей схеме:
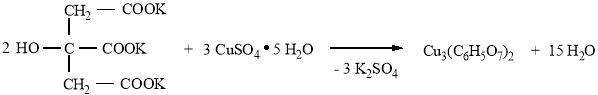
Методика синтеза. Навеску медного купороса (18,7 г; 0,075 моль) растворяли в 50 мл дистиллированной воды в химическом стакане на 100 мл (вместо стакана можно использовать плоскодонную коническую колбу). Приготовленный раствор смешивали с раствором цитрата калия (15,3 г; 0,05 моль). Полученную смесь помещали в холодильник на ночь. При охлаждении смеси выпадали изумрудно-зеленые кристаллы цитрата меди, которые отфильтровывали на воронке с бумажным фильтром, промывали 20 мл дистиллированной воды и сушили на воздухе.
Далее нами проведен анализ полученного соединения на содержание кристаллизационной воды. Для этого навеску соли массой 2,0 г на часовом стекле помещали в сушильный шкаф и выдерживали при температуре 85–90 оС до постоянной массы (4–5 часов). При этом происходило обезвоживание навески, и ее масса оказалась равной 1,5 г. Следовательно, масса кристаллизационной воды была равна 0,5 г.
Из полученных данных рассчитывали состав полученного кристаллогидрата:
n (H2O) = m (H2O)/M (H2O) = 0,5 г/18 г/моль = 0,028 моль;
n (соли) = m (соли)/M (соли) = 1,5 г/570 г/моль = 0,0026 моль;
отсюда n (соли): n (H2O) = 0,0026: 0,028 ≈ 1: 10, следовательно, полученная соль — лимоннокислая (цитрат) медь представляет собой десятиводный кристаллогидрат состава Cu3(C6H5O7)2 · 10 H2O.
Фильтрат после отделения выпавших кристаллов десятиводного цитрата меди использовали для изучения свойств полученного соединения. Так было выяснено, что при нагревании этого фильтрата из него выпадает осадок голубого цвета. Этот осадок отфильтровывали и сушили на воздухе. Высушенный осадок разделили на две части. К одной из них добавили раствор серной кислоты: осадок сразу растворился с образованием голубого раствора. К другой части добавили избыток 7 %-ного раствора гидроксида аммония: осадок растворился с образованием темно-синего раствора. Данные испытания позволили сделать вывод о том, что этот осадок — гидроксид меди (II). Вторичный фильтрат содержал кислоту: лакмусовая бумажка в нем окрашивалась в красный цвет. Полученные экспериментальные данные свидетельствовали о том, что при незначительном нагревании цитрат меди в растворе полностью гидролизовался до гидроксида меди (II) и лимонной кислоты. Поэтому синтезировать его можно только при сравнительно низкой температуре, используя насыщенные растворы исходных веществ для более эффективной кристаллизации продукта.
Синтез салицилата меди (салициловокислой меди).
Исходными веществами для синтеза салициловокислой меди (салицилата меди) были натриевая соль салициловой кислоты (салицилат натрия) и медный купорос:
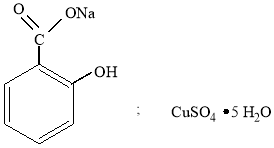
Салицилат меди получали реакцией обмена между салициловокислым натрием и медным купоросом по следующей схеме:
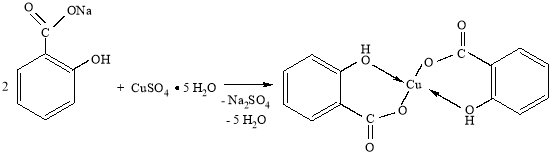
Методика синтеза. Вначале получали водные растворы исходных веществ. Для этого навески салицилата натрия (8,0 г; 0,05 моль) и медного купороса (6,25 г; 0,025 моль) растворяли в 50 мл дистиллированной воды в химических стаканах на 100 мл (вместо стаканов можно использовать плоскодонные конические колбы). Полученные растворы медленно сливали при перемешивании, в результате чего выпадал осадок салициловокислой (салицилата) меди, который отфильтровывали на воронке с бумажным фильтром, промывали 20 мл дистиллированной воды и сушили на воздухе. Масса полученной соли — 7,4 г.
Затем нами проведен анализ полученного соединения на содержание кристаллизационной воды. Для этого навеску соли массой 1,7 г на часовом стекле помещали в сушильный шкаф и выдерживали при температуре 85–90 оС до постоянной массы (4–5 часов). При этом происходило обезвоживание навески, и ее масса оказалась равной 1,4 г. Следовательно, масса кристаллизационной воды была равна 0,3 г.
Из полученных данных рассчитывали состав полученного кристаллогидрата:
n (H2O) = m (H2O)/M (H2O) = 0,3 г/18 г/моль = 0,016 моль;
n (соли) = m (соли)/M (соли) = 1,4 г/338 г/моль = 0,004 моль;
отсюда n (соли): n (H2O) = 0,004: 0,016 = 1: 4, следовательно, полученная соль — салициловокислая (салицилат) медь представляет собой четырехводный кристаллогидрат состава CuC14H10O6 · 4 H2O:
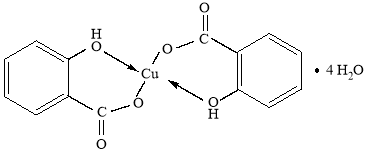
Затем рассчитывали массовую долю выхода соли. Из уравнения реакции находили теоретический выход — масса продукта составила 10,2 г; тогда, как практически получили 7,4 г. Поэтому практический выход четырехводного кристаллогидрата салицилата меди: 7,4 г/10,2 г = 0,73 (73 %) от теоретически возможного.
Экспериментально также было установлено, что при повышении температуры выход продукта значительно уменьшался. Так при сливании горячих растворов (температура выше 70 оС) салицилата натрия и медного купороса наблюдалось интенсивное образование осадка тягучей полимерной массы темно-зеленого цвета. Вероятно, это связано со способностью соединений Cu2+ катализировать поликонденсацию активированных ароматических соединений, в частности исходного салицилата натрия. Предположительная схема процесса поликонденсации может быть такой:
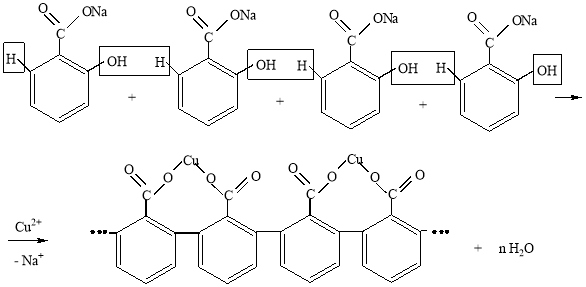
Таким образом, полученные экспериментальные данные свидетельствуют о том, что салицилат меди можно получить реакцией обмена только при невысоких температурах.
Нами осуществлен синтез в условиях школьного химического кабинета органических солей меди: тартрата (виннокислой), цитрата (лимоннокислой) и салицилата (салициловокислой). Полученные соединения выделены в чистом виде, доказано, что они представляют собой кристаллогидраты. Химическим путем установлен состав кристаллогидратов синтезированных веществ. А также исследованы реакции пятиводного кристаллогидрата медного купороса с органическими кислотами (винной, лимонной и салициловой) и их солями. Установлено, что при повышении температуры реакции резко снижается выход целевых продуктов, что связано либо с их гидролизом, либо с предполагаемыми побочными процессами поликонденсации.
Литература:
- Диланян Э. Р., Овсепян Т. Р., Арсенян Ф. Г., Степанян Г. М., Гарибджанян Б. Т. Противоопухолевая активность некоторых бистиосемикарбазонов метилглиоксаля и их хелатов с ионами меди (II). // Химико-фармацевтический журнал. 2008. Т. 42. № 9. С. 9–11.
- Цапков В. И., Присакарь В. И., Бурачева С. А., Лазакович Д. В., Гуля А. П. Синтез и противомикробная активность сульфазинсодержащих комплексов меди (II) с бензоилгидразонами замещенных производных салицилового альдегида. // Химико-фармацевтический журнал. 2008. Т. 42. № 9. С. 28–31.
- Пулина Н. А., Собин Ф. В., Краснова А. И., Юшкова Т. А., Юшков В. В., Мокин П. А., Яценко К. В., Бабушкина Е. Б. Синтез, гипогликемическая и противовоспалительная активность комплексных соединений на основе N-гетериламидов 4-арил-2-гидрокси-4-оксо-2-бутеновых кислот. // Химико-фармацевтический журнал. 2011. Т. 45. № 5. С. 18–21.
- Stephen B. Howell, Roohangiz Safaei, Christopher A. Larson, and Michael J. Sailor. Copper Transporters and the Cellular Pharmacology of the Platinum-Containing Cancer Drugs // Molecular Pharmacology. 2010. Vol. 77, № 6. P. 887–894.

