Преподавание курса химии и практические работы по решению экспериментальных задач
Авторы: Шарипов Шавкат Рахмонович, Шеранова Марьиям Базарбаевна, Алимкулов Сирожиддин Олимжон угли, Рустамов Абдусамат Шукруллаевич
Рубрика: Общие вопросы
Опубликовано в Школьная педагогика №1 (1) апрель 2015 г.
Дата публикации: 01.04.2015
Статья просмотрена: 369 раз
Библиографическое описание:
Шарипов, Ш. Р. Преподавание курса химии и практические работы по решению экспериментальных задач / Ш. Р. Шарипов, М. Б. Шеранова, С. О. Алимкулов, А. Ш. Рустамов. — Текст : непосредственный // Школьная педагогика. — 2015. — № 1 (1). — С. 8-10. — URL: https://moluch.ru/th/2/archive/2/110/ (дата обращения: 23.04.2024).
Решение экспериментальных задач способствует развитию мышления учащихся, так как они постоянно прибегают к различным логическим приемам: сравнению и аналогии, анализу и синтезу, систематизации и обобщению.
Дидактическая функция экспериментальных задач выражается в контроле знаний и практических умений учащихся. Задачи следует решать всем учащимся одновременно под руководством учителя.
Решение задач слагается из следующих этапов: 1. Осмысление задачи. 2. Теоретическое решение задачи, выяснение условий протекания реакций, их сущности. 3. Подготовка реактивов и оборудования. 4. Практическое решение задачи.
Рассмотрим пример решения задачи: «Исходя из оксида магния, получите хлорид магния». Чтобы от оксида магния перейти к хлориду магния, нужно такое сложное вещество, которое содержит химический элемент хлор и которое реагирует с оксидом. Ученики могут предложить соляную кислоту (они знают, что кислоты реагируют с оксидами металлов) или поваренную соль. Учащимся неизвестно, реагируют ли оксиды металлов с солями, в частности с поваренной солью. Для того чтобы доказать отсутствие такой реакции, учитель проводит опыт. Итак, для реакции нужно взять соляную кислоту.
Далее ученики пишут уравнение реакции между оксидом магния и соляной кислотой, подписывая под каждой формулой вещества их агрегатное состояние и цвет:
MgO+2HCl=MgCl2+H2O
Учитель выясняет с учащимися условия протекания реакции: нужно ли нагревать смесь или нет? Этот вопрос учащиеся решают в процессе выполнения опыта. Затем выясняют вопросы: в каком виде получается соль? Как выделить соль из раствора?
Прежде чем выполнять опыт, учитель указывает, сколько нужно взять оксида магния (одну стеклянную лопаточку), сколько нужно капель соляной кислоты (примерно). Только после таких пояснений учащиеся приступают к выполнению экспериментальной задачи.
Экспериментальные задачи можно предложить учащимся после изучения оснований. Например:
1. Получите реакцией обмена гидроксид железа (III) и выделите его из смеси.
2. В двух пробирках под номерами имеются растворы кислоты и щелочи. Определите, в какой пробирке кислота, а в какой — щелочь.
При решении первой задачи выясняют такие вопросы:
а) Какие реакции называются реакциями обмена?
б) Какие необходимы растворы веществ для получения гидроксида железа (III)? Предложите несколько реакций для получения этого вещества.
Учащиеся могут назвать различные соли и различные основания. Например:
FeCl3+NaOH=? Fe2(SO4)3+KOH=? FeCl3+Cu(OH)2=?
В ходе беседы проводят теоретический анализ предложенных реакций, а если необходимо, ставят опыты. В результате анализа учащиеся приходят к таким выводам: для реакции можно взять любую растворимую соль железа (III) и любое растворимое основание — щелочь; реакция должна осуществляться при комнатных условиях.
Далее решается вопрос, как выделить гидроксид железа (III) из смеси. В связи с этим повторяют прием фильтрования. Фильтрование лучше всего проводить фронтально.
При решении второй задачи нужно научить учащихся отбирать пипеткой пробу (примерно 5 капель) в пробирку или в углубление пластины (платы), объяснить, почему необходимо так поступить.
Обучать решению задач следует не только фронтально, но и путем вызова отдельных учеников к демонстрационному столу. При этом учащиеся класса принимают участие в обсуждении задачи, в составлении плана ее решения, а выполняют опыты вызванные учащиеся. Учителю необходимо проследить за тем, какие ошибки допускают ученики в процессе выполнения опытов, исправлять ошибки, привлекая для этого учащихся.
В VII классе, согласно программе, имеется одна практическая работа по решению экспериментальных задач: «Обобщение сведений о важнейших классах неорганических соединений». Это первая работа такого характера для учащихся. Чтобы для них не было неожиданностей, необходимо тщательно готовить учащихся к решению экспериментальных задач. Для этого следует на уроках, предшествующих практической работе, предлагать сходные задачи, обращать внимание на подходы к решению задач.
В последующих классах необходимо продолжать обучать учащихся решению экспериментальных задач, так как их содержание усложняется в связи с усложнением курса химии. В VII классе проводится распознавание классов неорганических соединений (кислоты, основания), осуществляются превращения в одну стадию (например, оксид металла — соль), распознаются преимущественно два конкретных вещества с помощью одного реагента, используются качественные реакции на соляную кислоту, хлориды, бромиды, иодиды.
В процессе изучения темы «Галогены» можно предложить учащимся экспериментальные задачи, которые решаются фронтально или путем вызова отдельных учеников к демонстрационному столу. Приведем пример решения задачи следующего содержания: «В трех пробирках под номерами 1, 2, 3 даны растворы соединений: хлорида натрия, иодида натрия и соляной кислоты. Определите, какое вещество в какой пробирке».
Решение задачи следует начать с анализа. Из трех предлагаемых веществ одно — кислота, ее можно обнаружить индикатором. Остальные вещества можно определить при приливании растворов ацетата свинца или нитрата серебра: в одном случае образуется белый осадок, в другом — желтый осадок. Ход рассуждений учащиеся могут оформить в виде плана-таблицы:
Таблица 1
План задачи
|
Вещество |
Реактив |
Пробирка № |
|
|
Лакмус |
Рb(СН3СОО)2 |
||
|
HCl NaCl NaI |
Раствор красного цвета — — |
PbCl2↓ осадок белого цвета
PbI2↓ осадок желтого цвета |
|
Затем учащиеся практически решают задачу, беря пробу из каждой пробирки. Установив содержимое каждой пробирки, они проставляют соответствующие номера в таблице и записывают уравнения реакций.
Каждая практическая работа по решению экспериментальных задач требует предварительной домашней подготовки учащихся, которая заключается в повторении материала темы (или нескольких тем), проведении анализа всех задач предстоящей работы и подготовке плана их решения.
Иногда отдельные учащиеся недооценивают предварительную подготовку. В результате этого они оказываются в большом затруднении, успевают в течение занятия решить одну задачу.
Предлагаемые задачи можно условно подразделить на две группы: задачи на воспроизведение и задачи продуктивного характера. Решение задач на воспроизведение требует применения известных учащимся теоретических знаний и практических умений. Например, задачи на разделение смесей, приготовление растворов, проведение характерных или качественных реакций и др.
Задачи на воспроизведение в процессе обучения постепенно усложняются, увеличивается число действий, повышается теоретический аппарат, необходимый для решения экспериментальных задач.
Выполнение задач продуктивного характера связано с переносом знаний в новые ситуации, применением обобщенных теоретических знаний. Сюда можно отнести получение определенного вещества несколькими способами; осуществление цепочки превращений, состоящей из двух-трех реакций; распознавание веществ, изученных в различное учебное время, и др. При решении задач продуктивного характера учащиеся проявляют полную самостоятельность.
Некоторые задачи, носят творческий характер (высший продуктивный уровень). При их решении требуются глубокие теоретические знания. Сюда можно отнести: избрание оригинального пути решения экспериментальной задачи, умение предложить несколько способов решения задачи, обосновать наиболее оптимальный из них.
Приведем пример: «Не прибегая к дополнительным реактивам, распознайте растворы веществ: карбоната натрия, соляной кислоты и хлорида бария». При решении этой задачи важно вначале установить одно вещество, с помощью которого затем можно определить остальные вещества. Для удобства рассуждения воспользуемся такой схемой:
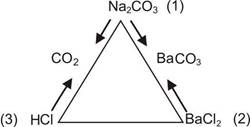
Рис.1.
Пробирки с растворами веществ условно обозначим цифрами 1, 2, 3.
Если при сливании проб из двух пробирок, например 1 и 2, образовался осадок, то это указывает, что прореагировали хлорид бария и карбонат натрия. Однако назвать номера пробирок, в которых находится каждое из этих веществ, нельзя. Тем не менее можно утверждать, что в пробирке 3 содержится соляная кислота. При действии ее на вещество пробирки 1 выделяется оксид углерода (IV), что доказывает наличие карбоната натрия; приливание соляной кислоты в пробирку 2 не дает реакции; следовательно, это хлорид бария.
Возможно, что при сливании проб из двух пробирок, например 1 и 3, выделится газ (см. схему). Этот результат позволяет заключить, что в пробирке 2 находится хлорид бария. С его помощью распознают содержимое пробирок 1 и 3.
Зная содержание задач, учитель сумеет дифференцированно подойти к их распределению между учащимися с различной успеваемостью.
Решение экспериментальных задач следует рассматривать как проверку, контроль знаний и умений учащихся. Поэтому, как отмечалось, решение задач должно быть строго индивидуализировано. Каждый ученик должен выполнять свой вариант, состоящий обычно из 3–4 задач. Варианты задач по степени трудности определяет учитель. В процессе занятия учитель определяет степень подготовленности учеников к занятиям по выполняемым действиям, быстроте работы, записям. Следует предупредить учащихся, что результаты решения задач будут проверяться учителем. Поэтому пробирки (или пластины), в которых проводились опыты, должны сохраняться некоторое время, пока не проверит результаты учитель.
При выставлении оценки за решение экспериментальных задач необходимо учитывать:
а) наличие правильного плана решения задачи;
б) выбор рационального пути решения задачи (использование минимального числа реагентов);
в) четкое оформление отчета — запись уравнений реакций, указание на условия их осуществления, характеристика веществ до и после реакции (цвета растворов, осадков) и др.
Также необходимо учитывать владение теми или иными практическими умениями (если удалось проследить).
Иногда ученик, решив две задачи, не успел выполнить третью задачу, хотя план ее решения правильный. Считаем, что наличие правильного плана, составленного самостоятельно учеником (что легко установить),— это уже решение задачи на 50 %. Данный момент следует учитывать при выставлении оценки за решение задач на практическом занятии.
Литература:
1. Коротов В. М. Общая методика учебно-воспитательного процесса; Учеб. пособия. — М.: Просвещение, 1983. — 223 с.
2. Пасечкин Б. Н. Набор реактивов для химического кабинета // Химия в школе. — 1978. — № 6.
3. Чертков И. Н. Организация практической деятельности учащихся и развитие их интереса к химии // Химия в школе. — 1979. — № 5.
Похожие статьи
Конкурсные задачи по химии на закон электролиза Фарадея
Среди великого множества разнообразных химических задач наибольшие затруднения вызывают задачи, для решения которых помимо прочных химических
Необходимо учитывать, что такого типа задачи будут интересны и доступны для восприятия не всем учащимся.
Метапредметная игра «Биомастер» | Статья в журнале...
Задачи игры-конкурса
- принимает решение о составе экспертной комиссии; - координирует работу команд в аудитории
Задания 4 тура (химия). Напиши уравнения реакций. 1. Школьник провел опыт.
Он растворил магний в соляной кислоте.
Эффективное использование отходов химических опытов на...
Далее ученики пишут уравнение реакции между оксидом магния и соляной кислотой, подписывая под каждой. Учитель выясняет с учащимися условия протекания реакции: нужно ли нагревать смесь или нет?
Методические особенности обучения учащихся решению задач...
Основные термины (генерируются автоматически): решение задач, серная кислота, учащийся, масса алюминия, обучение учащихся
Преподавание курса химии и практические работы по решению... Задачи следует решать всем учащимся одновременно под руководством учителя.
Некоторые элементы организации химического эксперимента...
При решении современных учебно-воспитательных задач
Гидроксид натрия — лакмус синеет (среда щелочная). Соляная кислота — красный цвет индикатора (среда кислая).
Задача 2. В двух пробирках находятся раствор хлорида калия и дистиллированная вода.
Качественное определение анионов в почве на внеурочных занятиях
Затем учащиеся практически решают задачу, беря пробу из каждой пробирки. О влиянии выбросов алюминиевого завода на содержание...
Преподавание курса химии и практические работы по решению... Итак, для реакции нужно взять соляную кислоту.
Эффект влияния концентрации оксида магния на...
Концентрация оксида магния оказывает решающее влияние на селективность продуктов реакции и распределение изомеров цимолов.
Для решения многих задач... Превращение природного газа и метанола на цеолитах типа...
Дидактические игры на современном уроке химии | Молодой ученый
Между тем много образуется хлорида кальция при получении оксида углерода (IV) из карбонатов действием соляной кислоты.
Преподавание курса химии и практические работы по решению... При действии ее на вещество пробирки 1 выделяется оксид углерода (IV), что...
Проблемы извлечения компонентов при проведении...
В качестве задачи химико-аналитического исследования
Азотная кислота оказывает более агрессивное воздействие по сравнению с соляной и серной.
Эффект влияния концентрации оксида магния на... ч. в муфельной печи при 550°C. Для исследования катализаторов...
Похожие статьи
Конкурсные задачи по химии на закон электролиза Фарадея
Среди великого множества разнообразных химических задач наибольшие затруднения вызывают задачи, для решения которых помимо прочных химических
Необходимо учитывать, что такого типа задачи будут интересны и доступны для восприятия не всем учащимся.
Метапредметная игра «Биомастер» | Статья в журнале...
Задачи игры-конкурса
- принимает решение о составе экспертной комиссии; - координирует работу команд в аудитории
Задания 4 тура (химия). Напиши уравнения реакций. 1. Школьник провел опыт.
Он растворил магний в соляной кислоте.
Эффективное использование отходов химических опытов на...
Далее ученики пишут уравнение реакции между оксидом магния и соляной кислотой, подписывая под каждой. Учитель выясняет с учащимися условия протекания реакции: нужно ли нагревать смесь или нет?
Методические особенности обучения учащихся решению задач...
Основные термины (генерируются автоматически): решение задач, серная кислота, учащийся, масса алюминия, обучение учащихся
Преподавание курса химии и практические работы по решению... Задачи следует решать всем учащимся одновременно под руководством учителя.
Некоторые элементы организации химического эксперимента...
При решении современных учебно-воспитательных задач
Гидроксид натрия — лакмус синеет (среда щелочная). Соляная кислота — красный цвет индикатора (среда кислая).
Задача 2. В двух пробирках находятся раствор хлорида калия и дистиллированная вода.
Качественное определение анионов в почве на внеурочных занятиях
Затем учащиеся практически решают задачу, беря пробу из каждой пробирки. О влиянии выбросов алюминиевого завода на содержание...
Преподавание курса химии и практические работы по решению... Итак, для реакции нужно взять соляную кислоту.
Эффект влияния концентрации оксида магния на...
Концентрация оксида магния оказывает решающее влияние на селективность продуктов реакции и распределение изомеров цимолов.
Для решения многих задач... Превращение природного газа и метанола на цеолитах типа...
Дидактические игры на современном уроке химии | Молодой ученый
Между тем много образуется хлорида кальция при получении оксида углерода (IV) из карбонатов действием соляной кислоты.
Преподавание курса химии и практические работы по решению... При действии ее на вещество пробирки 1 выделяется оксид углерода (IV), что...
Проблемы извлечения компонентов при проведении...
В качестве задачи химико-аналитического исследования
Азотная кислота оказывает более агрессивное воздействие по сравнению с соляной и серной.
Эффект влияния концентрации оксида магния на... ч. в муфельной печи при 550°C. Для исследования катализаторов...







