Ключевые слова: гидролиз, гидратация ионов, константы ионизации кислоты и основания, функциональные зависимости.
Под гидролизом солей понимают взаимодействие составных частей соли с составными частями воды. Иногда под гидролизом солей понимают реакцию ионного обмена ионов соли с ионами воды. Гидролиз соли может рассматриваться как обратимая реакция реакции нейтрализации.
Для того чтобы охарактеризовать интенсивность процесса гидролиза используют представления о химическом равновесии и константе химического равновесия. Запишем в общем виде уравнение реакции гидролиза соли:
MeXn +nH2O ⇄ Me(OH)n + nHX,
где Me — катион основания, X — анион кислоты.
Теперь можно воспользоваться выражением константы химического равновесия, которая в нашем случае может быть названа константой гидролиза. Для приведенного уравнения гидролиза соли константа гидролиза будет выглядеть следующим образом:

При этом для разбавленных растворов концентрацию воды следует считать постоянной величиной. Поэтому она обычно входит в числовое значение константы гидролиза.
Гидролизу наиболее подвержены соединения с наиболее выраженным ковалентным характером химической связи.
Обычно при написании уравнений гидролиза учитывается сила кислоты и основания, из которых получена соль. Для корректного учета силы электролита следует пользоваться использовать понятие константы ионизации кислоты и основания. Напомним, что константа ионизации, в отличие от степени ионизации не зависит от концентрации электролита.
В результате гидролиза соли происходит изменение концентрации иона водорода, т. е. изменяется водородный показатель pH. В табл. 1 сопоставлены значения констант ионизации кислоты, основания и рН.
Таблица 1
Сопоставление констант ионизации кислоты и основания, pH
|
Константы кислоты и основания |
Результат процесса |
Значение pH |
Среда |
|
Ккислоты = Коснования |
Гидролиз не происходит |
7 |
Нейтральная |
|
Ккислоты > Коснования |
Гидролиз происходит |
<7 |
Кислая |
|
Ккислоты < Коснования |
Гидролиз происходит |
>7 |
Щелочная |
Таким образом, можно точно указать возможную причину отсутствия гидролиза соли. Однако невозможно подобрать такие кислоты и основания, для которых бы выполнялось условие Ккислоты = Коснования.
Поскольку взаимодействию с водой подвергаются ионы солей, то важно найти связь константы гидролиза и параметров, несущих ответственность за гидратацию ионов. К ним можно отнести изменение энтальпии и энтропии гидратации ионов. Связь константы гидролиза с энтальпией гидратации катионов ∆Нгидр и энтропией гидратации ∆Sгидр для катионов Na+, Li+, Ba2+, Sr2+, Ca2+, Mg2+, Ag+, Cd2+, Mn2+, Zn2+, Fe2+, Al3+, Cr3+, Ga3+, Fe3+ иллюстрирует табл. 2.
Таблица 2
Функциональные зависимости логарифма константы гидролиза катионов lgK от энтальпии гидратации ∆Нгидр и энтропии гидратации ∆Sгидр
|
Функциональная зависимость |
Коэффициент корреляции |
|
lgК= -15,45+0,01∆Нгидр |
0,94 |
|
lgК= -12,72 ‒ 0,12∆Sгидр |
0,93 |
Приведенные значения коэффициента корреляции указывают на тесноту связи рассматриваемых параметров. Функциональные зависимости можно считать достоверными, если значение коэффициента корреляции превышает величину 0,7. В нашем случае значение коэффициента корреляции превышает величину 0,9, что указывает на превосходную функциональную зависимость.
На рис. 1 приведена зависимость логарифма константы гидролиза катионов [1, с. 128] от энтальпии гидратации катиона [1, с. 123]. Эта зависимость описывается прямой линией с достаточно высоким значением коэффициента корреляции 0,94.
Надо сказать, что для однотипных элементов, например s-элементов I группы (Li, Na, K, Rb, Cs) и II группы (Mg, Ca, Sr, Ba) связь константы гидролиза с энтальпией и энтропией гидратации становится еще более тесной. В этих случаях коэффициент корреляции принимает значение 0,974 и 0,940 соответственно.
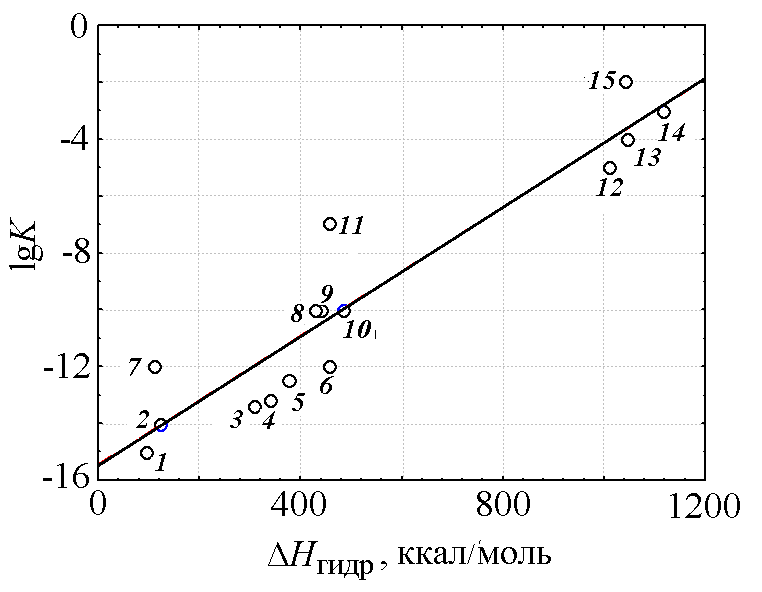
Рис. 1. Зависимость логарифма константы гидролиза катионов от энтальпии гидратации катиона. Катионы: 1 — Na+, 2 — Li+, 3 — Ba2+, 4 — Sr2+, 5 — Ca2+, 6 — Mg2+, 7 — Ag+, 8 — Cd2+, 9 — Mn2+, 10 — Zn2+, 11 — Fe2+, 12 — Al3+, 13 — Cr3+, 14 — Ga3+, 15 — Fe3+
Энтальпия гидратации, в свою очередь, тесно связана с такими параметрами как кажущейся обратный радиус катиона r-1 [2, с. 75] (рис. 2) и электроотрицательность элемента χ [2, с. 79] (табл. 3).
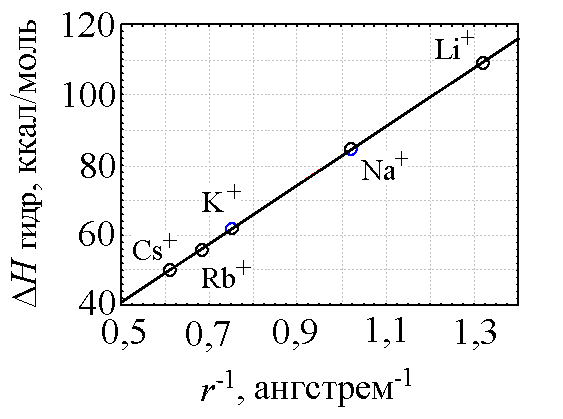
Рис. 2. Зависимость энтальпии гидратации ΔНгидр катионов s-элементов I группы от величины обратного радиуса катиона r-1. Коэффициент корреляции — 1
Таблица 3
Зависимость энтальпии гидратации катиона ΔНгидр от электроотрицательности элемента х
|
Функциональная зависимость |
Коэффициент корреляции |
Элементы |
|
ΔНгидр = -152,64+235,31χ |
1 |
Na, K, Rb, Cs |
|
ΔНгидр = -233,44+329,57χ |
0,82 |
Li, Na, K, Rb, Cs |
Литература:
- М. Сиенко, Р. Плейн, Р. Хестер. Структурная неорганическая химия. М.: Мир, 1968.– 344 с.

