Плазмолифтинг как инновационный метод лечения хронических воспалительных заболеваний тканей пародонта
Авторы: Микляев Станислав Валерьевич, Леонова Ольга Михайловна, Сметанина Олеся Владимировна, Сущенко Андрей Валерьевич
Рубрика: 6. Клиническая медицина
Опубликовано в
VI международная научная конференция «Медицина и здравоохранение» (Казань, март 2018)
Дата публикации: 26.02.2018
Статья просмотрена: 1938 раз
Библиографическое описание:
Микляев, С. В. Плазмолифтинг как инновационный метод лечения хронических воспалительных заболеваний тканей пародонта / С. В. Микляев, О. М. Леонова, О. В. Сметанина, А. В. Сущенко. — Текст : непосредственный // Медицина и здравоохранение : материалы VI Междунар. науч. конф. (г. Казань, март 2018 г.). — Казань : Молодой ученый, 2018. — С. 28-37. — URL: https://moluch.ru/conf/med/archive/303/13866/ (дата обращения: 24.04.2024).
В настоящее время вопросы диагностики и лечения хронических воспалительных заболеваний тканей пародонта неизменно находятся в центре внимания отечественных и зарубежных исследователей. Данная патология крайне сложно поддается лечению, а устранить дальнейшее развитие заболевания практически невозможно, что требует внедрения в стоматологическую практику новых методов лечения. Одним из таких методов на сегодняшний день является инъекционный метод с использованием тромбоцитарной аутоплазмы (ТАП), получивший оригинальное название Plasmoliftingтм. Целью исследования стало изучение эффективности применения плазмолифтинга. При лечении хронического генерализованного пародонтита легкой степени (ХГПЛСТ) (70 пациентов). В результате было установлено, что применение ТАП в комплексной терапии пародонтита легкой степени, по сравнению с традиционным методом, стабилизирует воспалительный процесс, дает более стойкий клинический эффект и способствует длительной ремиссии заболевания. Метод является простым, безопасным и эффективным.
Ключевые слова: пародонтит, плазмолифтинг, лечение пародонта, ХГПЛСТ, ТАП
Анализ эпидемиологии ипатогенеза хронических воспалительных заболеваний пародонта. Хронические воспалительные заболевания тканей пародонта (ХВЗПТ) относятся к болезням, известных с давних времен. С развитием и прогрессом человечества распространенность воспалительных заболеваний пародонта резко увеличивается. Если еще в начале 20 века данное заболевание встречалось у лиц 40 лет и старше. То уже в 80–90 годах ХВЗПТ, во всем мире заметно «помолодели». Это было выявлено в результате эпидемиологических обследований населения, анализ предусматривающий определение показателей характеризующих состояние тканей пародонта.
Основываясь на различных эпидемиологических исследованиях и данных, в последние годы появилось резкое увеличение числа хронических воспалительных заболеваний пародонта среди населения нашей страны и всего мира. Увеличение распространенности возникновения ХВЗТП приходится в основном на возраст от 30 до 50 лет, и к 45 годам достигает 96 %. Среди молодежи в возрасте от 16 до 20 лет распространенность заболеваний тканей пародонта резко увеличивается и встречается в 50−85 %. Прогрессированию воспалительных заболеваний тканей пародонта способствуют различные факторы, как местного, так и общего характера. Они вызывают и поддерживают воспалительные процессы в тканях пародонта на протяжении длительного времени.
Учитывая широкую распространенность воспалительных заболеваний тканей пародонта и неблагоприятное влияние на организм в целом, возникает необходимость разработки новых как диагностических, так и лечебных комплексов, которые могли бы помочь врачу распознать этиологические и патогенетические факторы заболевания, а так же провести их коррекцию на начальной стадии возникновения заболевания [3].
Генерализованный пародонтит является не только заболеванием пародонта, но и всего организма. У большинства больных наблюдается сочетание различных заболевания внутренних органов. Многие авторы указывают зависимость тяжести заболевания пародонта от заболевания желудочно-кишечного тракта. Помимо этого прослеживается взаимосвязь между заболеваниями тканей пародонта и болезнями сердечно-сосудистой системы, органов дыхания, гинекологической патологии.
Многие авторы отводят ведущую роль в воспалении тканей пародонта бактериальным продуктам, вызывающие деструкцию ткани. Гистологические и биохимические исследования показали, что нарушение обмена веществ в пародонте способствует изменению антигенного спектра десны.
Согласно данным Байбакова О. В., 2009, анализ иммунных реакций не дает четкую картину: с одной стороны происходит увеличение Т-хелперов и Т-супрессоров, с другой стороны снижение Т-хелперов и повышение Т-супрессоров. Прогрессирование воспалительного заболевания в прадонте обуславливается пролиферацией В-лимфоцитов, с продуцированием соответствующих антител, которые вызывают поражение тканей пародонта [5].
Патогенетическое значение также имеет и наличие циркулирующих иммунных комплексов, поступая в ткани, повреждают их. При проведении реакции иммунофлюорисценции выделяются в стенках сосудов иммуноглобулины M и G, что подтверждает их участие в патогенезе заболевания пародонта.
В развитии мнений на возникновение заболеваний тканей пародонта выделяют три направления:
- В основе клинических поражений пародонта лежит единственный патологический процесс — дистрофия ткани пародонта. И. О. Новик (1964) полагал: «независимо от формы заболевание начинается с дистрофических изменений, воспаление при котором явление вторичное», отрицая воспалительные формы течения пародонта.
- Наличие симптоматических поражений пародонта при заболеваниях внутренних органов и систем.
- Учет основных патологических процессов — воспалительных, опухолевых и дистрофических. Воспалительное поражение ткани пародонта характеризуется проявлениями экссудации, пролиферации и альтерации. А воспаление ткани пародонта является следующей стадией развития процесса.
На данный момент времени пародонтит рассматривают как заболевание иммунно-воспалительного деструктивного характера, первоначало которого является наличие анаэробной микрофлоры. Пародонтопатогены и их вирулентные факторы вызывают хроническое воспаление с выраженным воспалительным действием. Экзо- и эндотоксины пародонтопатогенных бактерий, инициируют изменение макрофагов в пенистые клетки, вызывая воспалительные явления в тканях пародонта. Любое хроническое заболевание — это заключительный этап длительного патологического процесса, возникновение которого в организме проявилось под действием неблагоприятных факторов. Этот воспалительный и деструктивный процесс, вовлекает ткани пародонта и приводит к резорбции костной ткани. Скорость резорбции в 80 % случаев составляет от 0,05 до 0,5 мм в год. Все это зависит от количественного состава микрофлоры ПК, уровня гигиенического состояния полости рта, и присутствия факторов риска и другой различной патологии.
ХВЗТП служат клинической картиной полного перехода состояния тканей пародонта от относительного клинического здоровья до полной потери зубов, следствием которого является полное разрушение основных частей пародонтального комплекса (от легкого гингивита до тяжелого пародонтита) [7].
Начальным этапом в развитии ХГПЛСТ лежит различной степени тяжести гингивит, который с возрастом затрагивает все большее число людей. Наиболее важным причинным фактором в развитии заболевания пародонта большое количество авторов приводят наличие зубного налета (бляшки) и ее микробный состав. Патогенная и условно-патогенная микрофлора полости рта является основным фактором в возникновении ХВЗТП. Результаты микробиологических исследований поддесневого зубного налета свидетельствует о разнообразном составе микрофлоры при данном воспалительном заболевании.
Экзо− и эндотоксины приводят к дисбалансу клеточного обмена, что приводит к альтерации тканей пародонта и следствием развитию воспалительного процесса. Начало и развитие воспаления в тканях пародонта, и переход в хроническую стадию, определяются не только видовым и количественным составом микрофлоры, так и состоянием иммунной системы. Иммунная защита имеет основную роль в развитии воспалительного процесса. Производит индукцию противовоспалительной экспрессии тканевых цитокинов, активирование хемоаттрактантов и вовлечение противовоспалительных клеток, которые приводят изменениям местного и общего обмена веществ, гемодинамики, иммунологическим нарушениям и сдвигам микробиоцинозов.
История становления метода применения тромбоцитарной аутоплазмы. Актуальным направлением в пародонтологии являются методики прицельной стимуляции регенеративных процессов. Единственным методом в настоящее время является инъекционный метод с применением тромбоцитарной аутоплазмы (ТАП), т.е крови полученной от самого пациента, который является высоко активным биологическим стимулятором процессов регенерации за счет содержащихся в α-гранулах тромбоцитов различных факторов роста, которые оказывают свое влияние на все структурные единицы окружающих тканей и стимулирующих процессы регенерации.
Первое сообщение о применении нативной крови при обработке раны было получено в 1876 г. (Schede, Германия), когда врачом было отмечено более скорое заживление раны при нахождении в ней некоторого количества крови. Далее в общих источниках упоминается опыт шведских врачей Grafstrom и Elfstrom. В 1898 г. в США при пневмонии и туберкулезе впервые в мире были проведены инъекции аутопламы в растворе поваренной соли. В 1905 г. немецкий хирург Август Бир установил, что собственная кровь пациента, введенную в бедро, представляла собой раздражающий фактор для организма, который позволял добиться ускорения заживления переломов. Согласно его наблюдениям скорость заживления возросла при до 30 % по сравнению с обычными методами лечения.
В годы Русско-Японской войны (1904–1905 гг.) Валенти́н Фе́ликсович Во́йно-Ясене́цкий работал хирургом в составе медицинского отряда Красного Креста, в военном госпитале в Чите, где впервые применил метод аутогемотерапия (др. греч. αὐτός — сам + αἷμα — кровь + терапия—подкожное или внутримышечное введение пациенту собственной крови, взятой из вены) для лечения солдат армии Российской Империи. И описал его в книге «Очерки гнойной хирургии». Он обратил внимание на то, что раны, сопровождающиеся кровоподтёками, заживают на 30 % быстрее. В 1934 г. В. Ф. Войно-Ясенецкий опубликовал «Очерки гнойной хирургии», где была описана методика аутогемотерапии в виде инфильтраций цельной аутокрови очага воспалительного процесса мягких тканей. Аутокровь применялась при лечении фурункулов и карбункулов. Оценивая положительно терапевтический эффект введения аутокрови, В. Ф. Войно-Ясенецкий отмечал выраженную болезненность при инъекциях, ему приходилось прибегать к оглушающему наркозу [1].
Следующим этапом в развитии методов, использующим аутокровь, стало применение плазмы части крови, свободной от эритроцитов и богатой тромбоцитами. Причиной применения аутоплазмы с тромбоцитами стало открытие того факта, что тромбоциты содержат белковые факторы (PRP-factors), факторы роста (ФР), инициализирующие регенеративный процесс в тканях при обычной травме. Идея заключалась в биохимической «имитации» кровоподтека и локальной травмы при введении аутоплазмы с тромбоцитами. Следующим этапом в развитии данной методики стало применение плазмы в виде геля.
При удалении дефектов на нижней челюсти длиной от 5 см и более, после иссечения опухолей в начале 90 годов была отмечена эффективность применения гелеобразной формы аутоплазмы. Проводилось нанесение плазмогеля на костный трансплантат и замещение дефектов нижней челюсти до 5 см и более после резекции опухолей. Авторы в исследуемой группе применяли аутогенную кость, смешанную с гелеобразной формой аутоплазмы, тогда как в контрольной использовалась только аутогенная кость. После проведенного лечения было доказано, что при использовании богатой тромбоцитами аутоплазмы в гелевой форме произошло ускоренное образование кости и улучшение ее структуры, а также наличие в аутогенной кости рецепторов к факторам роста, находящимся в тромбоцитах.
Технология изготовления геля из плазмы, обогащенной тромбоцитами, была предложена преимущественно для стоматологов (компания «Harvest», США). Другими исследователями гелевая форма богатая тромбоцитами плазма применялась в области лунок удаленных зубов. После анализа данных было обнаружено, что лунки, которые заполнялись аутоплазмой гелеобразной формы, увеличение сформированной кости было лучше и в более маленькие сроки, эпителизация раны также протекала быстрее. Тогда как при использовании аутоплазмы в виде геля после замещения костного дефекта кость была в 2 раза более зрелой, чем в контрольной группе при наблюдении за пациентами на сроках 2, 4, 6 месяцев.
Также есть работы, посвященные использованию аутоплазмы при синус-лифтинге в качестве подсадки на аллогенную кость. Но необходимо отметить, что обогащенная тромбоцитами плазма, полученная в виде геля, представляет собой свернувшейся фибриноген и выполняет роль разграничительной мембраны при оперативных вмешательствах в челюстно-лицевой области. Получаемая плазма густая и ее невозможно набрать в шприц.
Новым этапом в развитии регенеративной медицины стало создание и применение инъекционной формы тромбоцитарной аутоплазмы, которую разработали российские ученые: профессор, доктор медицинских наук Ренат Рашитович Ахмеров и кандидат медицинских наук Роман Феликсович Зарудий. После чего было предложено оригинальное название методики — Plasmolifting™. Весомое преимущество использования инъекционной формы тромбоцитарной аутоплазмы заключается в удобстве применения и возможностях причинения не только в хирургической, но и в терапевтической практике.
Важно отметить, что технология Plasmolifting™ не требует применения хлористого кальция и двойного центрифугирования, оставаясь при этом максимально эффективной, удобной и безопасной. В классической методике PRP- терапии применяется гель, введение которого в ткани возможно при наличии операционной раны. Применение же инъекций возможно до оперативного вмешательства, после, во время и вместо.
Преимущество инъекционной формы тромбоцитарной аутоплазмы, заключается в простоте применения, возможностях использования в различных областях медицины, как хирургии, так и терапии. Именно инъекционная форма аутологичной плазмы содержащей тромбоциты позволяет значительно расширить области применения.
Теоретические основы действия тромбоцитарной плазмы. Терапевтический эффект аутологичной плазмы объясняется присутствием тромбоцитов и содержащихся в них факторов роста (ФР), но эффект плазмы крови может быть основан и на других качественных составляющих, например, микро- и макроэлементах, витаминах, находящихся в наиболее биодоступном для тканей состоянии. Поэтому автор метода проф. Ахмеров Р. Р. не отвергает и другие гипотезы действия плазмы (нутриентную, средовую и т. п.).
Гипотезы действия плазмы: 1. Тромбоцитарная; 2. Средовая; 3. Гомеопатическая; 4. Нутриентная; 5. Гормональная
В 1980-х гг. при стимуляции процессов регенерации основное внимание уделяли роли оксигенации тканей. Безусловно, оксигенация тканей остается фундаментальным фактором, поскольку она улучшает фагоцитарную и бактерицидную способность иммунных клеток организма, а также поддерживает синтез коллагена и других белков.
В настоящее время основной целью исследований процессов регенерации является необходимость идентификации ФР, знания механизма их действия и возможностей применения для улучшения регенерации раневой поверхности.
Использование тромбоцитарной аутоплазмы сегодня представляет одну из немногих возможностей запускать и ускорять естественные механизмы регенерации за счет содержащихся в тромбоцитах ФР. Кроме того, она не токсична и не иммунореактивна. Получение аутоплазмы подразумевает разделение плазмы и тромбоцитов от эритроцитов как по градиенту плотности, так и с использованием специализированных лабораторных фильтров.
Тромбоцитарная аутоплазма модулирует и регулирует функцию первичных, вторичных и третичных ФР, влияя на все стадии регенерации одновременно. Упомянутое свойство отличает ФР тромбоцитарной аутоплазмы от рекомбинантных ФР, отвечающий за отдельный механизм регенерации.
Тромбоциты в своем составе имеют разнообразные ФР и цитокины, которые способствуют восстановлению поврежденных тканей. В α-гранулах тромбоцитов находятся свыше 30 ФР, которые влияют на процессы регенерации тканей периодонта одновременно. Наибольшее значение имеют: IGF (инсулиноподобный ФР) — способствует дифференцированию стволовых клеток, увеличивает метаболизм костной ткани и продуцирование коллагена. PDGF (тромбоцитарный ФР) — стимулирует пролиферацию и перемещение мезенхимальных (остеогенных) клеток, стимулирует ангиогенез. PDEGF (тромбоцитарный ФР эндотелиальных клеток) — вызывает стимулирующее действие на эндотелиальные клетки и обладает ангиогенным эффектом. VEGF или PDAF (ФР эндотелия сосудов): — имеются 4 вида фактора VEGF-A, -B, -C и -D. Участвуют в ангиогенезе, индуцируют пролиферацию эндотелиальных клеток сосудов. EGF (эпидермальный ФР) — способствует пролиферации фибро- и остеобластов, увеличивает синтез фибронектина. TGF-ß («Семейство» трансформирующего ФР) — многофункциональные факторы, т. к. не только индуцируют дифференцирование мезенхимальных клеток, а также вызывает большое количество клеточных и межклеточных ответов, включая продукцию других ФР. К трансформирующим ФР относятся костные морфогенетические белки, часть которых (КМБ-2, остеогенин или КМБ-3, КМБ-4,-5,-7,-8 и -9) — являются выраженными остеоиндукторами, модулируют клеточную пролиферацию и дифференцировку малодифференцированных клеток в остеобласты. PLGF-1/-2 (плацентарные ФР) — потенцируют действие VEGF, повышают проницаемость сосудистой стенки. FGF (фибробластный ФР) — вызывает экспрессию в костной ткани, ангиогенеза, оссификации, индуцирует продукцию TGF в остеобластных клетках Остеонектин «культуральный шоковый протеин»: составляет 15 % органического компонента костного матрикса, регулирует пролиферацию и взаимодействие клеток с матриксом. Тромбоспондин — опосредует адгезию костных клеток. ФР доставляются в ткани при инъекционной форме аутоплазмы и концентрируются при помощи введения большего количества аутоплазмы — это повышает активность фибробластов и стимулирует их образование. Фибробласты продуцируют коллагеновые волокна, гиалуроновую кислоту и эластин. Все это приводит к образованию новой соединительной ткани, росту капилляров. ФР также блокируют остеокласты и стимулируют пролиферацию остеобластов, что сдерживает дальнейшую убыль костной ткани и способствует ее регенерации. В итоге восстанавливаются обменные процессы, улучшаются микроциркуляция и метаболизм в клетках тканей, нормализуется тканевое дыхание, активизируется местный иммунитет.
Активируя все процессы регенерации одновременно и действуя на них синергетически, тромбоцитарная аутологичная плазма становится простым и безопасным биологическим методом, ускоряющим регенеративные процессы.
Богатая тромбоцитами плазма является безвредной для собственных тканей человека, биодоступной в биохимическом соотношении компонентов, которое свойственно данному организму.
Патофизиологический (патологический — так как «имитируется» патологическое состояние) процесс действия тромбоцитарной аутологичной плазмы упрощенно можно представить следующим образом: вследствие потери контакта тромбоцита с эндотелием при выходе из кровяного потока он меняет свою форму, стимулирует α-гранулы, выбрасывающие, в свою очередь, в рану ФР.
Согласно работе S. E. Haynesworth было показано что увеличение количества тромбоцитов до 1 млн/мкл усиливает фазу восстановления ткани. Исходя из полученных даных, необходимо получать не только тромбоцитарную аутологичную плазму, но и добиваться увеличения абсолютного количества тромбоцитов в тканях.
Принципиальным преимуществом метода Plasmolifting™ является возможность увеличивать количество тромбоцитов в тканях путем увеличения объема вводимой плазмы. Данное свойство присуще только естественному, жидкому состоянию плазмы в соответствии с законом m=Vq, где m — масса абсолютного количества тромбоцитов, V — объем плазмы, q — концентрация тромбоцитов. На практике это означает введение не 0,2–0,3 мл, а 1–2 чл. что совершенно легко исполняется в мягких тканях и крупных суставах.
Материально-техническое обеспечение метода Plasmoliftingтм. Выбор аппаратуры и расходных материалов исходит изтеоретических предпосылок технологии Plasmolifting™ и принципиальной позиции разработчиков технологии P. P. Ахмерова и Р. Ф. Зарудия. Позиция сформулирована следующим образом.
- Центрифуга лабораторная настольная с возможностью центробежной силы 800–1200G, или скоростью вращения 3200 оборотов в минуту.
- Специализированные пробирки Plasmolifting™ 9 мл (стерильные, содержащие натрия гепарин по технологии in vivo со специализированным тиксотропным гелем по технологии Plasmolifting™).
- Периферические венозные катетеры диаметром не менее 1,1 мм.
- Стерильные одноразовые медицинские шприцы (системы luer- lock) объемом от 2,0 мл до 5,0 мл.
- Иглы для инъекций.
Забор крови мы производили в объеме 9–36 мл при помощи периферического венозного катетера диаметр которого составлял 1,1 мм. и зависит от локализации введения при осуществлении лечения. Вся полученная кровь помещалась в 1–4 специализированные пробирки Plasmolifting™.
Получение ТАП:
Пробирки укладываются в центрифугу (мы использовали ЕВА 20 (Германия), которая настраивается на параметры вращения 3200 оборотов в минуту в течение 5 минут, или 1000G.
В процессе работы центрифуги вся кровь делится на две фракции: эритроцитарно-лейкоцитарный сгусток и плазму, которая содержит тромбоциты, микро- и макроминералы, витамины, аминокислоты. При помощи шприца (2,0–3,0 мл) забираем тромбоцитарную аутологичную плазму (супернатант), которая находится в верхней части пробирки над разделительным гелем.
Для инъекций использовались инсулиновые иглы. Объем и область введения плазмы: область зубодесневых сосочков 0,1–0,2 мл, область переходной складки 0,3–0,5 мл. Каждому пациенту процедура проводится 5 раз. При первом посещении были проведены инъекции в двух сегментах с верхней челюсти (в 1-м и 2-м), во второе, через 3 дня, на нижней челюсти (в 3-м и 4-м), третье посещение через 1 неделю, 4-е через 1 месяц, 5-е через 6 месяцев. Начиная с 3-го посещения, инъекции проводятся во всех четырех сегментах.
Таким образом, тромбоцитарную аутологичную плазму (ТАП) получают с помощью центрифугирования крови пациента и с применением специальных пробирок, а также определенным режимом центрифугирования. Нижняя часть пробирки, заполнена адсорбционным гелем, не влияющим на свойства плазмы, что позволяет получать плазму высокой очистки с терапевтическим содержанием тромбоцитов и производящим во время процедуры центрифугирования адсорбцию эритроцитов и низкомолекулярных жирных кислот, стабилизирующим эритроцитарно-лейкоцитарный сгусток.
Для исключения свертывания крови в верхней и средней части пробирки на стенках имеется гепарин натрия высокой степени. Полученная в результате центрифугирования ТА содержит тромбоциты в высокой концентрации.
Применение ТАП показало хороший клинический эффект при лечении воспалительных и воспалительно-деструктивных заболеваний пародонта: уменьшение выраженности хронического воспаления, предотвращение обострения воспалительной реакции, препятствует развитию некротически-деструктивных процессов; приводит практически к полной регенерации эпителиальной выстилки; предотвращает развитие склероза.
Применение инъекций ТАП в комплексном лечении пародонтита дает стойкую клиническую ремиссию, стабильный уровень значений пародонтальных индексов, редукцию глубины пародонтального кармана.
Для инъекций использовались инсулиновые иглы. Объем и область введения плазмы: область зубодесневых сосочков 0,1–0,2 мл, область переходной складки 0,3–0,5 мл.
Материалы иметоды исследования. Для определения групп обследования был произведен анализ распространенности хронического генерализованного пародонтита. На стоматологическом приеме после анализа клинических данных и по результатам осмотра было обследовано 70 пациентов, страдающих хроническим генерализованным пародонтитом легкой степени тяжести (ХГПЛСТ) в возрасте от 20 до 60 лет, из которых 37 (52,85 %) мужчин и 33 (47,14 %) женщины, у которых лечение проходило с применением обогащенной тромбоцитами аутоплазмы.
Для постановки диагноза мы анализировали данные развития заболевания, наличие жалоб, а также дополнительных методов обследования. Для проводимого исследования учитывался стоматологический статус каждого пациента — лица с ортодонтической патологией и сопутствующей патологией не включались в проводимую работу.
Обследование всех пациентов проводилось:
- На базе стоматологической клиники Федерального Государственного Бюджетного Образовательного Учреждения Высшего Профессионального Образования Воронежский Государственный Медицинский Университет им. Н. Н. Бурденко на кафедре госпитальной стоматологии.
- На базе Медицинского института Федерального Государственного Бюджетного Образовательного Учреждения Высшего Профессионального Образования Тамбовский Государственный Университет им. Г. Р. Державина на кафедре стоматологии.
Критериями исключения больных из дальнейшего исследования явились: сахарный диабет I или II типа, наличие остеопороза и различных инфекционных заболеваний, проживание в районах техногенных катастроф, профессиональная деятельность связанна с вредными для организма физическими, химическими факторами, наличие отягощенного аллергологического анамнеза, беременность, наличие новообразований, прием различных лекарственных препаратов которые оказывают влияние на уровень костной резорбции и гипертрофию десен.
В соответствии с поставленными задачами данной работе применялись клинические, практические и статистические методы исследования. Проводилось анкетирование, опрос, анализ истории болезни. Анализ гигиенических индексов: ИГР-У по J. C. Green — J. R. Vermillion (1964) (OHI-S), индекс API (Lange, 1977), индекс PHP (Podshadley, Haley, 1968). Анализ пародонтальных индексов: Индекс CPITN (ВООЗ, 1989), Индекс Muhleman H. R. (1971), Индекс РМА.
Результаты исследования. При первичном обследовании пациентов преобладали следующие жалобы: наличие неприятного запаха изо рта, при чистке зубов и при приеме твердой пищи кровоточивость десен, изменение цвета десны, наличие налета (зубного камня), оголение шеек зубов, наличие ПК, отделяемое из десен. На основании клинических данных был поставлен диагноз ХГПЛСТ (К05.31 по МКБ-10).
Всем пациентам было проведено комплексное пародонтальное лечение: обучение и контроль правильной гигиене полости рта, выбор индивидуальных средств гигиены, общая и местная антибактериальная, противовоспалительная, десенсибилизирующая терапия, витаминотерапия, местная и общая иммунокоррекция, фитотерапия (ротовые ванночки с отварами ромашки, шалфея, коры дуба и др.), удаление разрушенных зубов, физиотерапевтическое лечение. Пациентам была осуществлена профессиональная гигиена полости рта аппаратом Vector (Германия) [3,4].
Объективно у всех пациентов обоих групп преобладала цианотичность десневых сосочков и края десны, подвижность отсутствует, отмечается кровоточивость, рыхлая консистенция десны, наличие ПК и серозно-гнойный экссудат. Наблюдается значительное количество налета и зубного камня в большей степени поддесневого. При проверке гигиены полости рта значение индекса API (Lange, 1977) и индекса PHP (Podshadley, Haley, 1968) показало недостаточный уровень гигиены. Индексную оценку проводили до лечения, на 3-й день, через 7 дней, через 1 месяц, через 6 месяцев и через 1 год
На начальном этапе лечения всем представителям была произведена индексная оценка. (рис.1) При анализе полученных данных мы столкнулись с весомой разницей показателей у «старшей» группы, по сравнению с «молодой». Что может свидетельствовать о прямой зависимости значения индекса от возраста пациента [7].
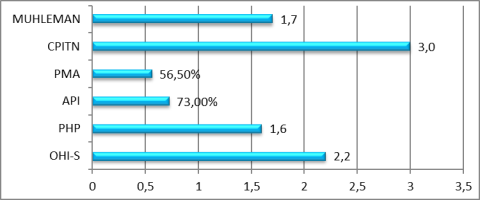
Рис. 1. Средняя индексная оценка до лечения
Улучшение клинического состояния десны отмечалась уже на второе посещение (через 3 дня), что свидетельствовало о снижении уровня кровоточивости десны индекс Мuhllemann и по продолжению нашего лечения снижался. Все пациенты обеих групп отмечали значительное улучшение [7,8]. Большинство пациентов не предъявляло жалоб. У всех пациентов отмечалось уменьшение уровня гигиенических индексов. Согласно нашим наблюдениям после проведения лечебных мероприятий снизилось не только распространенность ХГП, а так же интенсивность воспалительного процесса [15]. (рис.2)
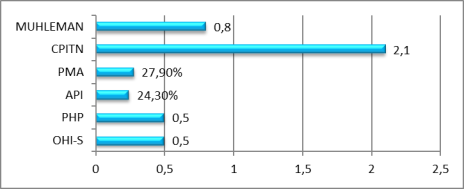
Рис. 2. Изменения средней индексной оценки через 3 дня
Через 7дней (третье посещение) проведенного лечения произошло закрепление результатов в виде небольшого снижения значений индексов. (рис.3)
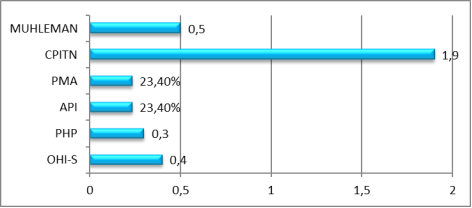
Рис. 3. Индексная оценка через 7 дней после начала лечения
Обратное незначительное увеличение произошло через 1 и 6 месяцев в границах норм оптимальной гигиены. Через 1 месяц после проведения лечебно-профилактических мероприятий в группе пациентов зубной налет вновь образовался у 7 человек (10 %) [4,6]. (рис.4)
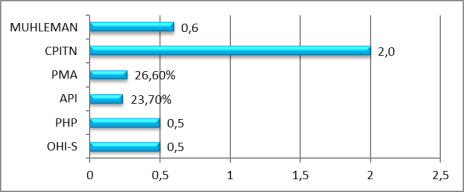
Рис. 4. Индексная оценка через 1 месяц после начала лечения
Через 6 месяцев от начала исследований в группе зубной налет вновь образовался у 9 человек (12,85 %), а зубной камень у 3 человек (4,28 %). Кровоточивость десны вновь появилась у 3 человек (4,28 %) (представители 45–60 возрастной группы).(рис.5)
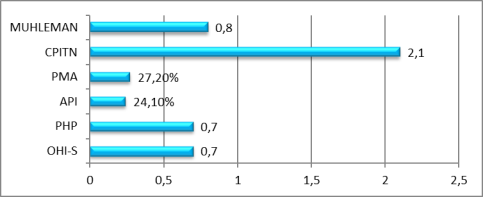
Рис. 5. Индексная оценка через 6 месяцев после начала лечения
При обследовании пациентов через 1 год (контрольное исследование) после начала лечения, наблюдался стабильный показатель группы: зубной налет вновь образовался у 11 человек (15,71 %), зубной камень у 4 человек (5,71 %); кровоточивость десны вновь появилась у 4 человек (5,71 %) (3 представителя 45–60 возрастной группы и 1 представитель 35–45 возрастной группы).
Оценивая эффективность лечения (образование зубного налета и камня) через 1 год можно сделать вывод, что частота повторного обращения в группе составила 15 чел (21,4 %). Индексная оценка уменьшилась у ИГР-У по J. C. Green — J. R. Vermillion (1964) (OHI-S) в 2,4 раза, что соответствует 59,01 %; Индекс эффективности гигиены PHP (Podshadley, Haley, 1968) в 1,7 раза, что соответствует 43,75 %; Индекс зубного налета на апроксимальных поверхностях API (Lange, 1977) в 2,9 раза, что соответствует 66,5 %; Индекс РМА в 2,0 раза, что соответствует 49,5 %; Индекс CPITN (ВООЗ, 1989) в 1,36 раза, что соответствует 26,6 %; Индекс кровоточивости по Muhleman H. R. (1971) в 1,8 раза, что соответствует 47,0 %; (рис. 6)
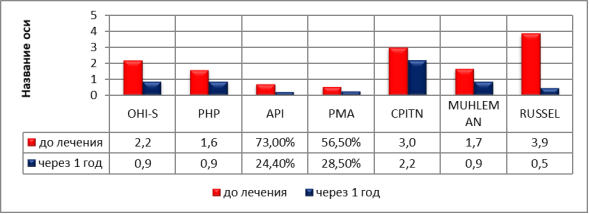
Рис. 6. Средняя индексная оценка 1 группы до лечения и через 1 год.
Положительные клинические и визуальные показатели наблюдались уже на 3 посещение (через 7 дней) после начала лечения, что может говорить о снижении продолжительности лечения пародонтологических больных до 3 посещений [3,4,5,15].
Также наблюдались положительные визуальные показатели исследуемой группы, которые так же подтвердились спустя 1 год после нашего лечения с применением тромбоцитарной аутоплазмы.
Выводы. Из полученных нами данных за определенный промежуток времени (3дня, 7дней, 1 месяц, 6 месяцев и 1 год) мы получили довольно ясную динамику нашего лечения с последующим периодом ремиссии. Наблюдалось резкое снижение всех индексных показателей на 3 день исследования. Через 1 месяц исследования показатели остались на том же уровне что и ранее. Применение инъекций ТАП в комплексном лечении пародонтита дает стойкую клиническую ремиссию, стабильный уровень значений пародонтальных индексов, редукцию глубины пародонтального кармана. Методика Plasmoliftingтм — проста, эффективна, не требует больших затрат. В результате включения в комплексную терапию тромбоцитарной аутоплазмы становится возможным сократить время лечения и добиться стабильности полученного результата на более продолжительный срок.
Литература:
- Андреас Браун, Феликс Краузе, Андреа Шиффер, Матиас Френтцен применение ультразвукового аппарата Vector при лечении пародонтита / Клиническая стоматология. — 2001.- № 3. — 62–65.
- Ахмеров P. P. Регенеративная медицина на основе аутологичной плазмы. Технология PlasmoliftingTM. М., 2014. -160 с.
- Ахмеров Р. Р., Зарудий Р. Ф., Цыплаков Д. Э., Воробьёв А. А. Технология Plasmolifting — инъекционная форма тромбоцитарной аутоплазмы для лечения хронических катаральных гингивитов // Пародонтология. — 2012. — № 4. — С. 80–84.
- Ахмеров P. P., Зарудий Р. Ф., Цыплаков Д. Э., Овечкина М. В., Воробьев А. А. Изучение патоморфологических изменений тканей десны при лечении хронических воспалительных и воспалительно-деструктивных заболеваний пародонта с использованием регенеративного метода PlasmoliftingTM Часть I//Пародонтология. –2014. — № 4 (73). — С.54–56.
- Ахмеров Р. Р., Короткова О.И, Овечкина М. В., Зарудий Р. Ф., Воробьев А. А. Применение аутоплазмы, содержащей тромбоциты, в дерматокосметологии и стоматологии. Технология Plasmolifting™// Пластическая хирургия и косметология. –2013. — № 1. — С.1.
- Буляков Р. Т., Сабитова Р. И., Гуляева О. А. Клиническая оценка состояния тканей пародонта после консервативного лечения хронического генерализованного пародонтита тяжелой степени с применением методов разрушения биопленки // Пародонтология. 2015 № 1. С. 68 -77.
- Буляков Р. Т., Сабитова Р. И., Гуляева О. А. Опыт консервативного лечения пародонтита тяжелой степени с использованием современных методов разрушения биопленки и технологии Рlasmolifting // Проблемы стоматологии. — 2014. — № 1. — С. 54–58.
- Буляков Р. Т., Сабитова Р. И., Гуляева О. А. Чемикосова Т. С., Тухватуллина Д. Н. Новые возможности консервативного малоинвазивного лечения воспалительных заболеваний пародонта // Пародонтология. 2013 № 1. С. 55–59.
- Буляков Р. Т., Сабитова Р. И., Гуляева О. А., Чемикосова Т. С., Тухватуллина Д. Н. Новые возможности консервативного малоинвазивного лечения воспалительных заболеваний пародонта // Пародонтология. — 2013. — № 1. — С. 55–59.
- Грудянов А. И. Заболевания пародонта. — М.: Издательство «Медицинское информационное агентство», 2009. — 336 с.
- Заболевания пародонта. Современный взгляд на клинико-диагностические и лечебные аспекты / Янушевич О. О., Гринин В. М., Почтаренко В. А. и др.; под ред. О. О. Янушевича. — М.: ГЭОТАР-Медиа, 2010. — 160 с.
- Кузьмина, Э. М. Современные критерии оценки стоматологического статуса при проведении эпидемиологического обследования населения / Э. М. Кузьмина. — М., 2007. — 31 c.
- Лемецкая, Т. И. Лечение воспалительных заболеваний пародонта: учебное пособие / Т. И. Лемецкая. — М., 1983. — 25 с.
- Мамедов М. М. Сравнительная оценка эффективности комплексного лечения разных форм течения воспалительных заболеваний пародонта // Клиническая стоматология. — 2009. — № 3. — с. 84–86.
- Микляев С. В. Оценка эффективности применения аутоплазмы, обогащенной тромбоцитами, при лечении хронического генерализованного пародонтита легкой степени тяжести // Вестник Тамбовского университета. Серия Естественные и технические науки. Тамбов, 2016. Т. 21. Вып. 6. С. 2271–2277. DOI: 10.20310/1810–0198–2016–21–6-2271–2277
- Микляев С. В., Леонова О. М., Глазьев В. К., Сущенко А. В., Олейник О. И. Изучение качества жизни у пациентов, страдающих хроническими воспалительными заболеваниями пародонта // Вестник Тамбовского университета. Серия Естественные и технические науки. Тамбов, 2017. Т. 22. Вып. 1. С. 187–192. DOI: 10.20310/1810–0198–2017–22–1-187–192
Ключевые слова
пародонтит, плазмолифтинг, лечение пародонта, ХГПЛСТ, ТАППохожие статьи
Применение аутоплазмы в стоматологии при лечении...
индексная оценка, тромбоцит, зубной налет, PHP, лечение, API, воспалительный процесс, индекс. Похожие статьи.
Современные подходы к консервативному лечению заболеваний...
Характеристика над- иподдесенного зубного налета.
В качестве инновационного метода лечения ВЗП сегодня все чаще звучит плазмолифтинг — инъекционное введение в ткани организма богатой тромбоцитами плазмы, полученной из крови пациента.
Биологическая полноценность и клиническая эффективность...
Рис. 1. Оценка биологических свойств криоконсервированных тромбоцитов.
Терпигорев С. А., Палеев Ф. Н. Надежность оценки активности воспалительного процесса при саркоидозе
Это метод лечения различного вида заболеваний путем инъекционного введения аутологичной...
Индивидуальная профилактика и лечение начальных стадий...
Индикация и количественная оценка мягких и твердых «зубных» отложений. Зубной налет, эмаль и цемент зубов.
Другими исследователями гелевая форма богатая тромбоцитами плазма применялась в области лунок удаленных зубов.
Динамика изменения размеров фосфатидилхолиновых липосом...
Обедненную тромбоцитами плазму (ОТП) получали центрифугированием крови в течение 25 мин. при 840 g., при комнатной температуре.
плазме крови эти процессы ингибированы благодаря действию антикоагулянтов (например, гепарина).
Антигалитозная эффективность зубной пасты «BreathRx»
Упрощенный индекс гигиены полости рта OHI-S (Green J., Vermillion J., 1969), для количественной оценки зубного налета и зубной камня
Рис. 1. Средняя индексная оценка до лечения. Улучшение клинического состояния десны...
Опыт применения безмономерной пластмассы «Нолатек» для...
Скопления мягкого налёта в участках с повреждённым полированным слоем и/или плохого
Ни у одного пациента не было выявлено развитие воспалительного процесса в области
Индексная оценка гигиенического состояния зубных протезов и аппаратов различных...
Комплексный подход к лечению ранних форм воспалительных...
Библиографическое описание: Вусатая Е. В. Комплексный подход к лечению ранних форм
Задачи исследования: 1. Проанализировать динамику течения воспалительного процесса в
3. Демченко Н. Л., Сущенко А. В. Сравнительный анализ индексной оценки гигиены полости...
Похожие статьи
Применение аутоплазмы в стоматологии при лечении...
индексная оценка, тромбоцит, зубной налет, PHP, лечение, API, воспалительный процесс, индекс. Похожие статьи.
Современные подходы к консервативному лечению заболеваний...
Характеристика над- иподдесенного зубного налета.
В качестве инновационного метода лечения ВЗП сегодня все чаще звучит плазмолифтинг — инъекционное введение в ткани организма богатой тромбоцитами плазмы, полученной из крови пациента.
Биологическая полноценность и клиническая эффективность...
Рис. 1. Оценка биологических свойств криоконсервированных тромбоцитов.
Терпигорев С. А., Палеев Ф. Н. Надежность оценки активности воспалительного процесса при саркоидозе
Это метод лечения различного вида заболеваний путем инъекционного введения аутологичной...
Индивидуальная профилактика и лечение начальных стадий...
Индикация и количественная оценка мягких и твердых «зубных» отложений. Зубной налет, эмаль и цемент зубов.
Другими исследователями гелевая форма богатая тромбоцитами плазма применялась в области лунок удаленных зубов.
Динамика изменения размеров фосфатидилхолиновых липосом...
Обедненную тромбоцитами плазму (ОТП) получали центрифугированием крови в течение 25 мин. при 840 g., при комнатной температуре.
плазме крови эти процессы ингибированы благодаря действию антикоагулянтов (например, гепарина).
Антигалитозная эффективность зубной пасты «BreathRx»
Упрощенный индекс гигиены полости рта OHI-S (Green J., Vermillion J., 1969), для количественной оценки зубного налета и зубной камня
Рис. 1. Средняя индексная оценка до лечения. Улучшение клинического состояния десны...
Опыт применения безмономерной пластмассы «Нолатек» для...
Скопления мягкого налёта в участках с повреждённым полированным слоем и/или плохого
Ни у одного пациента не было выявлено развитие воспалительного процесса в области
Индексная оценка гигиенического состояния зубных протезов и аппаратов различных...
Комплексный подход к лечению ранних форм воспалительных...
Библиографическое описание: Вусатая Е. В. Комплексный подход к лечению ранних форм
Задачи исследования: 1. Проанализировать динамику течения воспалительного процесса в
3. Демченко Н. Л., Сущенко А. В. Сравнительный анализ индексной оценки гигиены полости...











