Клеточная модель стенки кишечника человека с использованием генетически-кодируемых сенсоров для исследования патогенеза целиакии
Авторы: Русанов Александр Леонидович, Смирнова Анна Владимировна
Рубрика: 3. Медико-биологические дисциплины
Опубликовано в
Дата публикации: 26.11.2016
Статья просмотрена: 266 раз
Библиографическое описание:
Русанов, А. Л. Клеточная модель стенки кишечника человека с использованием генетически-кодируемых сенсоров для исследования патогенеза целиакии / А. Л. Русанов, А. В. Смирнова. — Текст : непосредственный // Новые задачи современной медицины : материалы IV Междунар. науч. конф. (г. Санкт-Петербург, декабрь 2016 г.). — Санкт-Петербург : Свое издательство, 2016. — С. 10-13. — URL: https://moluch.ru/conf/med/archive/239/11361/ (дата обращения: 25.04.2024).
Данная работа направлена на разработку клеточной модели целиакии, позволяющей in vitro исследовать основные звенья патогенеза заболевания, в частности, оценивать вклад в его развитие токсических веществ, а также разрабатывать и оценивать эффективность средств для лечения и профилактики обострений болезни.
Ключевые слова: целиакия, Сaco-2, генетически-кодируемые сенсоры, флуоресценция, NF-κB
Актуальность
Целиакия — хроническая генетически детерминированная аутоиммунная Т-клеточно-опосредованная энтеропатия, которая характеризуется стойкой непереносимостью специфических белков эндосперма зерна некоторых злаковых культур с развитием атрофии слизистой оболочки тонкой кишки и связанным с ней синдромом мальабсорбции. В основе патогенеза заболевания — дефект ферментативного гидролиза глютена в желудочно-кишечном тракте, приводящий к образованию ряда токсических пептидов. Представления об основных патогенетически значимых при целиакии токсических пептидах, перечень которых и степень повреждающего действия на энтероциты кишечника значительно варьируют по данным различных исследователей, противоречивы. В то же время, верные и точные представления о молекулярных механизмах развития заболевания — залог успешности разработки таргетных средств терапии (направленных на конкретную молекулярную мишень или звено патогенеза).
Моделирование патологического процесса (заболевания) — необходимый инструмент для изучения его патогенеза, разработки подходов фармакологической коррекции и предварительной оценки ее эффективности. Так как в основе патогенеза целиакии лежит наследственно обусловленный дефект ферментативного переваривания глютена в кишечнике, то есть процесс вариабельный у животных организмов различных видов, крайне важной является разработка видоспецифических моделей целиакии (человеческих), которые могут быть реализованы исключительно в виде клеточных моделей, пригодных для исследований in vitro.
В этой связи, для исследования механизма транспорта пептидов — продуктов неполного гидролиза глютена, их распределения внутри клетки и оценки их возможного токсического эффекта, используют модели целиакии in vitro на основе клеточных линий эпителия кишечника. Эти клеточные линии во многом воспроизводят морфологию и функциональные особенности энтероцитов кишечника человека [1]. Самыми популярными для таких исследований являются клеточные линии Caco-2 и IEC [2–4].
Существующие в настоящее время подходы к детекции повреждающего действия различных продуктов неполного гидролиза глютена на клеточных моделях целиакии in vitro основаны на исследовании изменения отдельных функциональных параметров клеток ряда клеточных культур, наиболее полно воспроизводящих функциональный статус энтероцитов человека (Сасо-2, IEC, T-84), а именно: проницаемость плотных контактов между клетками [5]; изменение продукции клетками провоспалительных цитокинов (например, TNF-a или IL15), выделяемых в среду [4].
Однако, по данным различных авторов, количественная оценка степени повреждающего действия отдельных пептидов при целиакии в подобных исследованиях значительно варьирует [3, 6, 7].
Зафиксировать эти изменения возможно при достаточно большой степени повреждения клеток в силу недостаточной чувствительности аналитических методик (ИФА, TEER). В связи с этим актуальной задачей является разработка клеточной модели целиакии, позволяющей in vitro детектировать раннее токсическое действие продуктов неполного гидролиза глютена на энтероциты человека и оценивать его количественно. Эту задачу предлагается решить в результате разработки нового подхода к детекции повреждающего действия продуктов неполного гидролиза глютена при моделировании целиакии in vitro с использованием генетически-кодируемых сенсоров на основе флуоресцирующих белков (ФБ).
Для визуализации уровня экспрессии целевого белка создают конструкции на основе гена ФБ под контролем того же промотора, что и в случае изучаемого объекта. Такие генетически-кодируемые сенсоры позволяют оценивать функциональный статус клеток, в том числе, на стадии ранних обратимых изменений, при этом обеспечивают возможность прижизненной визуализации изучаемых процессов (включая активацию важнейших сигнальных путей) в режиме реального времени [8].
Материалы и методы
В качестве целевого внутриклеточного белка, по изменению экспрессии которого предлагается оценивать степень токсического повреждения продуктов неполного гидролиза глютена на модельные клетки in vitro, был выбран белок NF-κB.
Выбор целевого белка обоснован следующими обстоятельствами. На различных клеточных моделях in vitro было показано, что воздействие продуктов неполного гидролиза глютена на клетки кишечника приводит к изменению их окислительного баланса: увеличивается содержание продуктов перекисного окисления липидов, отношение окисленного и восстановленного глютатиона (GSSG/GSH), уменьшается концентрация белковых сульфгидрильных групп [9], увеличивается продукция свободных радикалов (активных форм кислорода) [10]. Таким образом, окислительный стресс является одним из основных механизмов, реализуемых в процессе токсического действия продуктов неполного гидролиза глютена на эпителиоциты кишечника человека при целиакии. Транскрипционный фактор NF-κB вовлечён в разнообразные клеточные процессы, включая окислительный стресс, ранний воспалительный ответ и апоптоз [11]. Он может быть активирован в ответ на разнообразные стимулы, ассоциированные со стрессом для клетки, такие как воздействие эндотоксина, активных форм кислорода, тяжёлых металлов или цитокинов. При этом активация внутриклеточного сигнального пути, ассоциированного с NF-κB, служит ранним маркером неблагоприятного воздействия на клетку [8]. В ряде исследований продемонстрировано, что продукты неполного гидролиза глютена способны увеличивать экспрессию гена NF-κB в клеточных моделях целиакии [6, 12]. Кроме того, характерная для целиакии продукция провоспалительных цитокинов также регулируется NF-κB [12]. В свою очередь, уровень экспрессии NF-κB зависит также от величины внутриклеточного окислительно-восстановительного потенциала [11].
В качестве модельной выбрана клеточная линия Сасо-2, дифференцированные клетки которой в состоянии монослоя наиболее адекватно воспроизводят структурно-функциональные характеристики энтероцитов тонкого кишечника человека [1], в связи с чем наиболее часто используются для моделирования целиакии in vitro [2,3]. Клетки культивируются на проницаемых мембранных вставках типа transwell, что позволяет создать условия, при которых питание клеток осуществляется как с апикальной, так и с базолатеральной поверхности. В таких условиях дифференцировка клеток более эффективна [1]. По мере формирования монослоя клетки линии Сасо-2 начинают спонтанно дифференцироваться и в таком состоянии становятся структурно-функционально похожими на нормальные эпителиоциты кишечника человека.
Для решения поставленной в рамках проекта задачи будет проведена трансдукция клеточной линии Сасо-2 лентивирусной конструкцией, содержащей регуляторные элементы для транскрипционного фактора NF-κB и ген, кодирующий зеленый флуоресцентный белок (GFP, максимум возбуждения 505 нм, максимум эмиссии 515 нм) (Cignal Lenti NFκB Reporter (GFP), Qiagen). Возможность использования данного флуоресцентного белка определяется относительно низкой автофлуоресценцией эпителиоцитов кишечника человека и, в частности, клеток линии Сасо-2, в зелёной области спектра.
Гомогенная популяция трансдуцированных клеток получена в результате селекции на питательной среде, содержащей антибиотик пуромицин.
Результаты иобсуждение
Были получены клеточные линии Сасо-2, трансфецированные лентивирусной репортёрной конструкцией активации NF-κB слитой с белком GFP (Caco-2/NF-κB), а также позитивный (Caco-2/GFP+, для оценки эффективности трансдукции), и негативный (Caco-2/GFP-, для оценки специфичности усиления сигнала флуоресценции при воздействии токсичных веществ) контроли. Для получения стабильно трансфецированных линий была проведения селекция с использованием антибиотика пуромицина. Эффективность трансдукции была исследована методом флуоресцентной микроскопии. Клетки Сасо-2/GFP+ интенсивно флуоресцировали в зелёной области спектра, при этом уровень флуоресценции клеток варьировал, что, по-видимому, связано с различной эффективностью трансфекции. В клетках негативного контроля Сасо-2/GFP- уровень флуоресценции был сопоставим с автофлуоресценцией нетрансфецированных клеток Сасо-2. В популяции клеток Сасо-2, несущих репортёрную конструкцию активации NF-κB большая часть клеток не флуоресцировала, однако небольшая часть клеток (<10 %) демонстрировала наличие слабого флуоресцентного излучения, что свидетельствует о протекании процессов активации сигнального пути NF-κB в состоянии нормального функционирования (в отсутствии внешних воздействий) (рис. 1А).
Через 21 день культивирования полученных клеточных линий на проницаемых мембранных вставках типа transwell, c регулярной сменой питательной среды, формируется монослой дифференцированных клеток.
Далее было исследовано дозозависимое изменение интенсивности флуоресценции полученных трансдуцированных клеток при добавлении контрольного вещества — TNF-α, которое вызывает активацию сигнального пути NF-κB. Воздействие различных концентраций TNF-α на клетки Сасо-2/GFP- не приводило к появлению флуоресцентного сигнала, тогда как для клеток Caco-2/NF-κB наблюдается дозозависимое увеличение флуоресценции клеток (рис. 1).
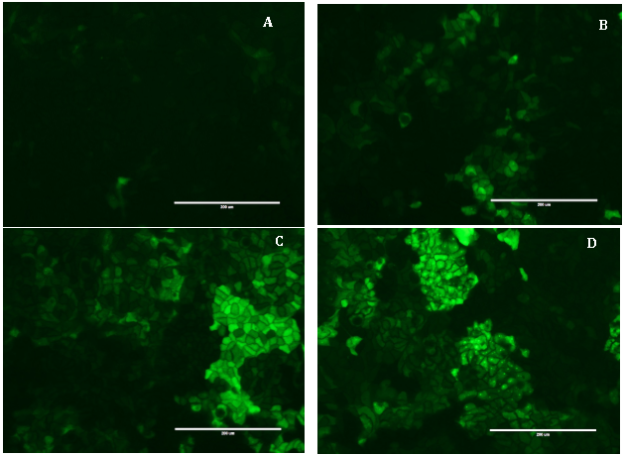
Рис. 1. Изменение интенсивности флуоресценции клеток линии Caco-2/NF-κB при воздействии TNF-α в течение 48 часов в концентрации 0 нг/мл (А, контроль), 5 нг/мл (B), 20 нг/мл (C) и 100 нг/мл (D). Увеличение 20х. Масштабный отрезок 200 мкм
Уже в концентрации 5 нг/мл TNF-α вызывает активацию пути NF-κB в клетках линии Caco-2/NF-κB, что сопровождается появлением клеток, флуоресцирующих в зелёной области спектра (рис. 1B). Дальнейшее увеличение концентрации TNF-α приводит как к увеличению интенсивности флуоресценции, так и количества флуоресцирующих клеток (рис. 1С, 1D). При этом максимальный уровень флуоресценции достигается при концентрации TNF-α равной 20 нг/мкл (рис. 1С) и практически не изменяется при дальнейшем увеличении концентрации (Рис. 1D). Полученные результаты свидетельствуют об активации сигнального пути NF-κB в клетках линии Caco-2/NF-κB под действием TNF-α.
Выводы
В рамках данной работы проведена эффективная трансдукция клеток линии Caco-2 лентивирусной конструкцией, содержащей регуляторные элементы для транскрипционного фактора NF-κB и ген, кодирующий GFP; оценена пороговая чувствительность разработанного сенсора в ответ на воздействие TNF-α.
Полученная клеточная линия позволяет детектировать активацию сигнального пути NF-κB путем визуализации с использованием флуоресцентной микроскопии.
Разработанная клеточная модель может быть использована при моделировании целиакии и позволяет детектировать раннее токсическое действие продуктов неполного гидролиза глютена на энтероциты человека in vitro.
Работа выполнена при поддержке гранта РФФИ № 16–34–01113.
Литература:
- Sambuy Y., De Angelis I., Ranaldi G., Scarino M. L., Stammati A., Zucco F. The Caco-2 cell line as a model of the intestinal barrier: influence of cell and culture-related factors on Caco-2 cell functional characteristics. // Cell Biology and Toxicology. — 2005. — № 21(1). — С. 1–26.
- Iacomino G, Fierro O, D'Auria S, Picariello G, Ferranti P, Liguori C, Addeo F, Mamone G. Structural analysis and Caco-2 cell permeability of the celiac-toxic A-gliadin peptide 31–55. // J Agric Food Chem. — 2013. — № 61(5). — С. 1088–96.
- Barone M. V., Zanzi D., Maglio M., Nanayakkara M., Santagata S., Lania G., Auricchio S. Gliadin-mediated proliferation and innate immune activation in celiac disease are due to alterations in vesicular trafficking. // PloS One. — 2011. — № 6(2). — C. e17039.
- Clemente M. G., De Virgiliis S., Kang J. S., Macatagney R., Musu M. P., Di Pierro M. R., Fasano A. Early effects of gliadin on enterocyte intracellular signalling involved in intestinal barrier function. // Gut. — 2003. — № 52(2). — С. 218–23.
- Fasano A. Zonulin and its regulation of intestinal barrier function: the biological door to inflammation, autoimmunity, and cancer. // Physiological Reviews. — 2011. — № 91(1). — С. 151–75.
- De Stefano D., Maiuri M. C., Iovine B., Ialenti A., Bevilacqua M. A., Carnuccio R. The role of NF-kappaB, IRF-1, and STAT-1alpha transcription factors in the iNOS gene induction by gliadin and IFN-gamma in RAW 264.7 macrophages. // Journal of Molecular Medicine. — 2006. — № 84(1). — C. 65–74.
- Flohé L., Brigelius-Flohé R., Saliou C., Traber M. G., Packer L. Redox regulation of NF-kappa B activation. // Free Radical Biology & Medicine. — 1997. — № 22(6). — С. 1115–26.
- Chen P., Migita S., Kanehira K., Sonezaki S., Taniguchi A. Development of sensor cells using NF-κB pathway activation for detection of nanoparticle-induced inflammation. // Sensors. — 2011. — № 11(7). — С. 7219–30.
- Luciani A., Villella V. R., Vasaturo A., Giardino I., Pettoello-Mantovani M., Guido S., Maiuri L. Lysosomal accumulation of gliadin p31–43 peptide induces oxidative stress and tissue transglutaminase-mediated PPAR gamma downregulation in intestinal epithelial cells and coeliac mucosa. // Gut. — 2010. — № 59(3). — С. 311–19.
- Zimmermann C., Rudloff S., Lochnit G., Arampatzi S., Maison W., Zimmer K. P. Epithelial transport of immunogenic and toxic gliadin peptides in vitro. // PLoS One. — 2014. –№ 9(11). — С. e113932.
- Simula M. P., Cannizzaro R., Canzonieri V., Pavan A., Maiero S., Toffoli G., De Re, V. PPAR signaling pathway and cancer-related proteins are involved in celiac disease-associated tissue damage. // Molecular Medicine. — 2009. — № 16(5–6). — С. 199–209.
- Maiuri L., Ciacci C., Ricciardelli I., Vacca L., Raia V., Auricchio S., Londei M. Association between innate response to gliadin and activation of pathogenic T cells in coeliac disease. // Lancet. — 2003. — № 362(9377). — С. 30–37.
Похожие статьи
Глютен и целиакия как факторы риска развития... | Молодой ученый
Они поражают сосуды мозга и вытесняют нормальные клетки [2, 6].
Таким образом, в основе хронического воспаления лежит оксидативный (окислительный) стресс (появление
Глютен — это современный яд для организма человека и его головного мозга.
Изучение цитотоксичности биологически активных соединений на...
Одной из таких моделей являются культуры клеток [2–7]. Культуры клеток человека и животных в качестве биологических тест-систем все чаще
Для ее определения используются тесты на клеточных линиях различных тканей органов (кровь, печень, почки и т. д.).
Роль механизмов свободнорадикального окисления в патогенезе...
Основной механизм развития окислительного стресса связан со свободнорадикальным
Это вещество оказывает ограниченное повреждающее действие, в частности, вызывает
Метаболиты кислорода участвуют в реакциях клеточного и гуморального иммунитета, а...
Нейротрофические эффекты лития, актуальные для снижения...
Разнообразие таргетных белков вовлекает GSK-3 во многие аспекты клеточного
Основное значение в повреждающем действии церебральной ишемии отводится увеличению
Подтверждено нейропротекторное действие аскорбата лития на модели глутаматной...
Гомоцистеин: влияние на биохимические процессы в организме...
Гомоцистеин повышает риск развития тромбозов, вызывает метилизацию ДНК и окислительный стресс, оказывает повреждающее действие на нервные клетки и митохондрии (Рис. 2). [10, 12, 14].
Использование способности железа вызывать угнетение...
2) на примере печени - единственного органа человека, обладающего способностью к регенерации (пролиферации клеток).
картина при отравлении железом: «железо оказывает прямое повреждающее действие на клеточные структуры, при местном воздействии на...
R/K – инверсия клеток или концепция неоднородности жизненной...
Регуляция клеточного цикла. Клеточная модель стенки кишечника человека с использованием... Для визуализации уровня экспрессии целевого белка создают конструкции на основе гена ФБ под.
Современные представления о механизме развития рассеянного...
Пути активации покоящихся потенциально аутореактивных Т-клеток на сегодняшний день так и не
Костимулирующие молекулы CD28 и СTLA-4 экспрессируются на клеточной поверхности и
Наряду с воспалительными компонентами Т-лимфоцитов повреждающее действие могут...
Похожие статьи
Глютен и целиакия как факторы риска развития... | Молодой ученый
Они поражают сосуды мозга и вытесняют нормальные клетки [2, 6].
Таким образом, в основе хронического воспаления лежит оксидативный (окислительный) стресс (появление
Глютен — это современный яд для организма человека и его головного мозга.
Изучение цитотоксичности биологически активных соединений на...
Одной из таких моделей являются культуры клеток [2–7]. Культуры клеток человека и животных в качестве биологических тест-систем все чаще
Для ее определения используются тесты на клеточных линиях различных тканей органов (кровь, печень, почки и т. д.).
Роль механизмов свободнорадикального окисления в патогенезе...
Основной механизм развития окислительного стресса связан со свободнорадикальным
Это вещество оказывает ограниченное повреждающее действие, в частности, вызывает
Метаболиты кислорода участвуют в реакциях клеточного и гуморального иммунитета, а...
Нейротрофические эффекты лития, актуальные для снижения...
Разнообразие таргетных белков вовлекает GSK-3 во многие аспекты клеточного
Основное значение в повреждающем действии церебральной ишемии отводится увеличению
Подтверждено нейропротекторное действие аскорбата лития на модели глутаматной...
Гомоцистеин: влияние на биохимические процессы в организме...
Гомоцистеин повышает риск развития тромбозов, вызывает метилизацию ДНК и окислительный стресс, оказывает повреждающее действие на нервные клетки и митохондрии (Рис. 2). [10, 12, 14].
Использование способности железа вызывать угнетение...
2) на примере печени - единственного органа человека, обладающего способностью к регенерации (пролиферации клеток).
картина при отравлении железом: «железо оказывает прямое повреждающее действие на клеточные структуры, при местном воздействии на...
R/K – инверсия клеток или концепция неоднородности жизненной...
Регуляция клеточного цикла. Клеточная модель стенки кишечника человека с использованием... Для визуализации уровня экспрессии целевого белка создают конструкции на основе гена ФБ под.
Современные представления о механизме развития рассеянного...
Пути активации покоящихся потенциально аутореактивных Т-клеток на сегодняшний день так и не
Костимулирующие молекулы CD28 и СTLA-4 экспрессируются на клеточной поверхности и
Наряду с воспалительными компонентами Т-лимфоцитов повреждающее действие могут...











