Ключевые слова: диангидро-D-маннит, диангидро-D-сорбит.
Keywords: dianhydro-D-mannitol, dianhydro-D-sorbitol.
Известно, что производные изосорбида и изоманнида могут придавать сладкий вкус, например, диметиловый эфир изосорбида используется как ингредиент в производстве жевательных резинок, твердых сладостей [1], дипропаноат изосорбида широко применяется при производстве хлебобулочных изделий [1]. Смешанные простые и сложные эфиры изогекситов (в особенности изосорбида) используются как усилители вкуса. В настоящее время изосорбид предлагают использовать, как составной компонент смеси, используемой для водно-основного пигмента чернил. Этот компонент имеет превосходную дисперсионную стабильность, которая необходима для полиграфической печати [1].
Все методы получения, приводящие к изогекситам, используют в качестве исходного материала соответствующий гекситол. Для получения изогекситов с количественным выходом, и с целью избежания побочных реакций, был разработан ряд методик. Скорость последовательности дегидротации в реакциях с использованием в качестве исходного соединения: 1,4-ангидропроизводные D-идитола, D-гулитола, D-глюцитола, и D-маннитола (из которых получаются 1,4:3,6-диангидро соединения изоидида ( 5 ) и изоманнида ( 4 )) зависит от расположения гидроксильной группы (при С-5 эндо как у D-маннитола и D-глюцитола, или экзо как у D-идитола и D-глюцитола).
Методом масс-спектрометрии были исследованы все три изогексита ( 3–5 ), особенно D-изоманнид и их О -дейтерированные изомеры, и 5-нитроизосорбид [1]. Катион изоманнида, образующийся в результате реакций дегидротации, был также обнаружен в масс-спектрах некоторых производных изоманнида [1]. Масс-спектрометрический анализ используется для определения изосорбида и его 5-нитропроизводного в моче и плазме крови человека.
1,4:3,6-диангидро-D-маннит (изоманнид) как первый представитель диангидрогекситов [1, 2] был описан Факоннером в 1884 ом году. Первое сообщение о синтезе кристаллического диангидро-D-сорбита ( 3 ) было сделано Харденом в 1940 году [3]. Затем хлынул поток экспериментальной работы, описанной в химической литературе в течение 1940-х и 1950-х годов, когда проводилось интенсивное исследование всех возможных изомеров 1,4:3,6-диангидрогекситов: 1,4:3,6-диангидро-D-сорбита ( 3), 1,4:3,6-диангидро-D-маннита ( 4 ) и 1,4:3,6-диангидро-D-идита ( 5 ). Были установлены структурные свойства этих соединений и выполнены синтезы многочисленных производных [3]. Позднее, интерес к этим соединениям снизился, однако увеличение числа статей в последующие годы показало, что значительное внимание снова направленно к этому особому классу соединений.
Затем следует период интенсивного исследования химических особенностей всех возможных изомеров 1,4:3,6-диангидрогекситов. Эти соединения представляют собой систему, образованную двумя жесткосконденсированными ангидроциклами, имеющими в положениях 1,4 и 3,6 общее ребро, и расположенные друг относительно друга под углом 110º. Характерной структурной особенностью этих соединений является наличие внутренней хиральной полости и двух гидроксильных групп, которые различаются между собой взаимной ориентацией.
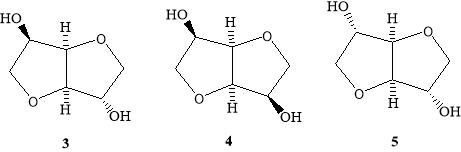
Наиболее широко используемые названия в этом классе соединений базируются на номенклатуре сахаров, которая отражает их свойства как полигидрированных спиртов. Нумерация кольцевой системы в этом случае сохраняется такая же, что и у родственного сахара.
Следует отметить, что у D-глюкозы ( 1 ) (как исходного материала, получаемого из крахмала) атомы углерода от 2 к 6 сохраняют свою нумерацию во время гидрогенизации в D-глюцитол (сорбитол, 2 ). Затем путем дегидротации соединения ( 2) получают 1,4:3,6-диангидро-D-глюцитол ( 3 ). Тривиальное название для соединения ( 2) — сорбитол. Соединение ( 3) обычно (хотя неправильно) называют 1,4:3,6- диангидросорбитол. Та же самая нумерация применяется и для других диастереомерных 1,4:3,6-диангидрогекситолов, получаемых из D-маннозы (D-маннитол) и из L-фруктозы (L-идитол); их названия 1,4:3,6-диангидро-D-маннитол ( 4 ) и 1,4:3,6-диангидро- L-идитол ( 5 ).
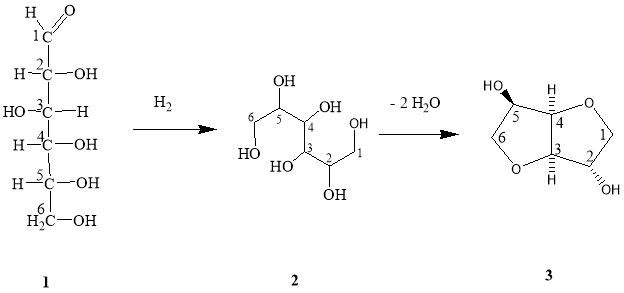
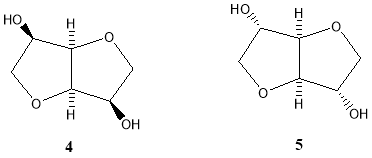
Кроме того, соединениям 3 , 4 , и 5 , обычно приписывают тривиальные названия: «изосорбид» ( 3 ), «изоманнид» ( 4 ), и «изоидид» ( 5 ), соответственно.
Диангидрогекситы как мостиковые системы
Так как 1,4:3,6-диангидрогекситы представляют собой бициклические системы, то для них возможно использование не только номенклатуры сахаров, но и систематической номенклатуры. Нумерация атомов отличается от той, которую используют в названиях, образованных от сахарных производных. Более того, стереохимия для каждого аномерного центра обозначена особо. Обсуждаемые соединения имеют остов 2,6-диоксабицикло [3.3.0]октана и включают гидроксильные группы в положениях С-4 и С-8, (формула 6) .
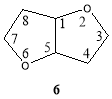
Согласно этой системе, диолы 3 , 4 , и 5 , соответственно называются (1R, 4R, 5R, 8S)-2,6-диоксабицикло [3.3.0]октан-4,8-диол ( 3 ), (1R, 4R, 5R, 8R)-2,6-диоксабицикло [3.3.0]октан-4,8-диол ( 4 ), (1R, 4R, 5R, 8S)-2,6-диоксабицикло [3.3.0]октан-4,8-диол ( 5 ).
Материалы и методы
Получение 1,4:3,6-диангидро- D -сорбита
Из числа известных изогекситов, изосорбид имеет наибольшее значение, так как его динитропроизводное нашло широкое фармацевтическое использование, а диметиловый эфир изосорбида обладает хорошими свойствами растворителя. Все методы получения, приводящие к изогекситам, используют в качестве исходного материала соответствующий гекситол. Так, например, D-глюцитол, D- галактитол, D-гулитол, D-маннитол D-талитол, D-аллитол, или D-идитол, или им свойственные энантиомеры используют для получения диангидрогекситов [1, 3].
Протонированию подвергается предпочтительно первичная гидроксильная группа. Первый этап дегидротации может также иметь место между 3- и 6- положениями. Затем следует второй этап отщепление воды как от 1,4-, так и от 3,6-, ангидро-D-глюцитола, который приводит к образованию D-изосорбида. Для получения изогекситов с количественным выходом, и с целью избежания побочных реакций, был разработан ряд методик (см. работы [1–5]). Скорость последовательности дегидротации в реакциях с использованием в качестве исходного соединения: 1,4-ангидропроизводные D-идитола, D-гулитола, D-глюцитола, и D-маннитола (из которых получаются 1,4:3,6-диангидро соединения изоидида ( 5 ) и изоманнида ( 4 )) зависит от расположения гидроксильной группы (при С-5 эндо как у D-маннитола и D-глюцитола, или экзо как у D-идитола и D-глюцитола). Таким образом, образование 1,4:3,6-диангидрогекситолов, полученных из 1,4-ангидропроизводных D-идитола и D-гулитола происходит примерно в 40 раз быстрее, чем из D-глюцитола и D-маннитола [1]. Более детальное рассмотрение стереохимического пути реакции дегидротации представлено в работе [1].
Результаты и обсуждение
Тозилированные производные 1,4:3,6-диангидро- D -сорбита
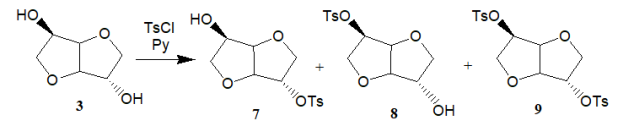
Сравнительная реакционная способность гидроксильных групп у производных углеводов обсуждалась в обзоре [1]. Среди изогекситов, изосорбид ( 3 ) имеет две гидроксильные группы с различной направленностью, то есть ОН-2 группа занимает экзо- , а ОН-5 группа — эндо- положения относительно бициклической кольцевой системы. Множество попыток было сделано, чтобы контролировать региоселективность реакций с участием этих групп. В изосорбиде ( 3 ) внутримолекулярная связь между эндо-гидроксильной группой при С-5 и атомом кислорода, находящимся внутри кольца между С-1 и С-4 была подтверждена методами спектроскопии. Водородная связь увеличивает нуклеофильные свойства и также реакционную способность ОН-5 группы по отношению к экзо-гидроксильной группы при С-2. В работе [6] было показано, что взаимодействие 1,4:3,6-диангидро-D-сорбита ( 3 ) с эквимолекулярным количеством тозилхлорида в пиридине дает смесь следующих продуктов: 2,5-дитозилпроизводное — 17 % ( 9 ), 2-моно — 12 % ( 7 ) и 5-моно — 45 % ( 8 ).
Также необходимо упомянуть работы авторов 5–8, где проводили аналогичную реакцию 1,4:3,6- диангидро-D-сорбита ( 3 ) с эквимолекулярным количеством п -фенилазобензоил хлоридом в пиридине, что привело к смеси продуктов содержащей: 2,5- дипроизводное — 9 %, 2- моно — 12 %, 5- моно — 36 %.
Выводы (Заключение)
Таким образом, производные диангидрогекситов нашли широкое применение в медицине и фармакологии. Так, большое количество публикаций [1] посвящено различным аспектам лекарственных препаратов на основе динитроизосорбида и 5-мононитроизосорбида, обладающих высокой кардио-сосудистой активностью. В последние десятилетия предприняты попытки их химической модификации, с целью изменения полярности и липофильности, путем введения дополнительных заместителей в 5-мононитроизосорбид, которые изменяли бы биологическую активность и позволяли получать вещества с более широким спектром действия. Из моно- и динитроизогексидов, при замещении гидроксо- или нитрогруппы на пуриновые основания были получены новые потенциальные кардиостимулирующие вещества [1]. Одно соединение в этой серии прошло клинические испытания и известно под названием (INN) как лекарственный препарат «Теопранитол». «Сорнидипин» (INN) одно из производных другой серии лекарственных веществ, которое также прошло клинические исследования [1]. Кроме упомянутых выше областей медицины производные изогексидов используются также при лечении ангины, и для других воспалительных процессов.
Литература:
- Stoss P., Hemmer R. /1,4:3,6-Dianhydrohexitols// Adv. Carbohydr. Chem. Biochem. 1991. V. 49. P. 93–173.
- Fauconnier A. /Reduction de la mannite par l’acide formique// Bull. Soc. Chim. Fr. 1884. N 41. P. 119–125.
- Hockett R. C., Fletcher H. G., Sheffield E. L., Groepp R. M. /Hexitol anhydrides. The structure of isosorbide// J. Am. Chem. Soc. 1946. V. 68. N 6. P. 927–930: Muller and Hoffman, German Patent 488,602 (1927); U. S. Patent 1,757,468 (1930).
- Chem. Abstr. 78, (1973) 43,942.: Dvonch W., Alburn H. E. (American Home Products Corp.), DE 2,221,080. 1971.
- Buck K. W., Foster A. B., Perry A. R., Webber J. M. /Influence of intramolecular hydrogen bonding on the rates of esterification of some derivatives of 5-hydroxy-1,3-dioxan of 1,4:3,6-dianhydro-D-glucitol// J. Chem. Soc. 1963. N 8. P. 4171–4176.
- Lemieux R. U., McInnes A. G. /The preferential tosylation of the endo-5-hydroxyl group of 1,4:3,6-dianhydro-D-glucitol// Can. J. Chem. 1960. V. 38. N 1. P. 136–140.
- Г. И. Курочкина, Г. С. Браташ, Н. О. Соболева, Л. К. Васянина, М. К. Грачев, Э. Е. Нифантьев /Направленное тозилирование 1,4:3,6-диангидро-D-маннита и — D-сорбита// Журнал общей химии, 2004, том 74, выпуск 10, с. 1739–1742
- Г. С. Браташ, А. В. Миронычева, Г. И. Курочкина, Л. К. Васянина, М. К. Грачев, Э. Е. Нифантьев /Синтез и физико-химическое исследование тозилированных производных 1,4:3,6-диангидро-D-маннита и — D-сорбита// Научные труды МПГУ серия: естественные науки (сборник статей), 2004, с.171–178
- Paolucci C., Mazzini C., Fava A. /Dihydro- and tetrahydrofuran building blocks from 1,4:3,6-dianhydrohexitols// J. Org. Chem. 1995. V. 60. N. 1. P. 169–175.
- Tamion R., Marsais F., Ribereau P., Queguiner G., Abenhaim D., Loupy A., Munnier L. /Synthesis of new chiral auxiliaries derived from isosorbide// Tetrahedron: Asymmetry 1993. V. 4. N. 8. P. 1879–1890.

