Ключевые слова: нейрогенез, глимфатическая система мозга, белок Тау, астроциты.
Ранее было доказано, что нервные клетки имеют только внутреннее восстановление, но на сегодняшний день учёные выявили, что нервные клетки имеют и внешнее и внутреннее восстановление за счет клеток Ниши . То есть в некоторых частях головного мозга имеются стволовые клетки называемые Ниши, они расположены в субвентикулярной зоне переднего мозга, боковых желудочках, субгранулярной зоне зубчатой извилины в гиппокампе и вокруг основания третьего желудочка (танициты). А маркером этих клеток является белок нистин.
Именно клетки Ниши способствуют регенерации и выработке новых клеток. Даже вследствие ишемического некроза, омертвленные части головного мозга могут восстанавливаться. Но это происходит очень медленно. Клетки нервной ткани могут расти за месяц на 1 мм. Во время исследований посчитано, что у здорового человека без генетических и неврологических патологий образуется до 700 новых нейронов. Из-за медленного роста нейронов, опухоли из нервной ткани тоже развивается очень медленно. И часто это не опухоли нейрона, а в основном опухоли нейроглии.
Самая активная регенерация нейронов наблюдалась в обонятельной луковице и гиппокампе (который отвечает за память, навигацию и эмоциональную обработку). Исследование Стэндфордского университета 2015 года выявило связь между периодическим голоданием и нейрогенезом, было доказано, что уменьшение калорий влияет на синаптическую пластичность, стимулирует рост нейронов, снижает дегенеративные заболевания. Это связано с тем, что увеличение липидных метаболитов в крови и в головном мозге провоцирует патологии нервной системы и эти факторы тесно связаны с факторами гликирования крови и инсулин резистентностью. Установлено, что у людей с ожирением отмечается высокая концентрация инсулина в крови и более низкий уровень инсулина в спинномозговой жидкости [16]. Максимальная экспрессия рецепторов инсулина в мозге обнаружена в обонятельных луковицах, коре головного мозга, гипоталамусе, гиппокампе, миндалине и мозжечке [15]. Из-за возрастных особенностей, у человека наблюдается накопление липидных метаболитов вокруг нейронов и внутри головного мозга. Это в свою очередь приводит к дегенеративным заболеваниям таким как, болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, болезни мотонейронов у лиц выше 50 лет.
Было доказано, что систематическое соблюдение интервального голодания (без приема воды) в течение 16 часов в день или 24 часов в неделю помогает нейронам и в целом ЦНС избавиться от метаболитов, а также обеспечивает быструю регенерацию, улучшает транспортную функцию между нейронами [4].
Результат исследований у обезьян с разными стратегиями питания: обе достаточно старые обезьяны по меркам этой породы, но при этом фото слева (Canto 25) рацион был с ограничением калорий, предлагалась растительная еда с большим количеством клетчатки и отсутствием животного жира, а второе фото справа c (Owen 26) питание было высококалорийным с высоким содержанием животного жира. Наглядно видно, что у Owen 26 процесс старения выражен более ярко по сравнению с Canto 25.

Рис. 1. Обезьяны с разными стратегиями питания
Еще одним важным фактором для быстрого нейрогенеза и профилактики дегенеративных патологий является транспорт Белка Тау. Черепно-мозговая травма становится все более актуальной проблемой среди спортсменов и широкой общественности. Трудности с началом и поддержанием сна являются одними из наиболее часто встречающихся симптомов после травмы, а недосыпание связано с повышенным накоплением бета-амилоида (Aβ) и фосфорилированного Белка тау в интерстициальном пространстве.
Недавние исследования глимфатической системы — механизма метаболического очищения, подобного лимфатическому, в центральной нервной системе (ЦНС), который основан на спинномозговой жидкости (ликвор), интерстициальной жидкости (ИЖС) и астроцитарных процессах, показывают, что во время сна клиренс усиливается. Эта система отчасти повреждается из-за перераспределения каналов аквапорина-4 в сторону от концевых ножек астроцитов, что приводит к снижению возможности удаления отходов. Долгосрочные последствия хронической дисфункции этой системы в контексте повторяющихся травм головного мозга и бессонницы не установлены, но потенциально они являются одним из звеньев в объяснительной цепи, связывающей повторяющиеся ЧМТ с последующей нейродегенерацией.
Текущие исследования показали отложение б-тау в периваскулярных пространствах и вдоль интерстициальных путей при хронических травматических энцефалопатиях (ХТЭ), которые связаны с лимфатическим оттоком. Это основные каналы, по которым выводятся метаболические отходы [5]. В этом обзоре рассматриваются возможные связи между повреждением глимфатического функционирования, и физиологическими изменениями, обнаруженными при ХТЭ, и предлагается модель, объясняющая опосредующую роль нарушения сна в увеличении риска развития патологий, связанных с ХТЭ, и последующих клинических симптомов после повторяющихся травм головного мозга.
Нейродегенеративные заболевания, например, Альцгеймер сопровождается дисфункцией аксонального транспорта. Белок Тау стабилизирует постоянный транспорт аксонов. Дефектный Тау-белок ингибирует антероградный, быстрый аксональный транспорт. К ярким дефектам нарушения белка Тау можно привести заболевание хроническо- травматической энцефалопатии (чаще встречается у боксеров, спортсменов из-за частых механических сотрясений. Наблюдается ретроградная амнезия, иногда заторможенность. Кроме того, в нескольких исследованиях сравнивались патологии при ХТЭ с патологиями при других нейродегенеративных расстройствах или у лиц контрольной группы, соответствующих возрасту. Следовательно, сохраняются разногласия по поводу нейропатологических аспектов, которые делают ХТЭ уникальной. Кроме того, широко распространено мнение, что ХТЭ является следствием многократных ударов по голове, но имеющиеся данные свидетельствуют о том, что однократная черепно-мозговая травма средней или тяжелой степени тяжести также может вызвать прогрессирующие нейропатологические изменения [14].
Для нейрогенеза после ишемического инсульта, после сотрясения головного мозга и для нормального функционирования головного мозга в целом, имеют огромное значение астроциты. Астроциты более устойчивые к гипоксическому повреждению клетки вследствие того, что в астроцитах доминирует синтез аденозинтрифосфата (АТФ) путем гликолиза, а нейроны функционируют в основном за счет окислительного фосфорилирования в митохондриях, будучи одновременно зависимыми от поступления в них лактата из астроцитов [1].
Уникальность астроцитов заключается в том, чтоонирегулируют концентрацию К+,перерабатывают глюкозу для нейронов , является донорами для пораженных нервных клеток жертвуя собой,дозированнокормят нейроны питательными веществами и лактатами, очищают нейроны выпуская механизм Аквапорина 4.
Были проведены эксперименты, когда дефектный нейрон культивировали со здоровыми астроцитами и нейроны выздоравливали. И наоборот, когда пораженные астроциты культивировали со здоровыми нейрономи, нейроны заболевали.
Нейроны могут высвобождать поврежденные митохондрии и передавать их астроцитам для утилизации и вторичной переработки. Эта способность к обмену митохондриями может представлять собой потенциальный способ передачи сигналов от клетки к клетке в центральной нервной системе. По результатам лабораторных исследований выявлено, что астроциты мышей также могут высвобождать функциональные митохондрии, которые проникают в нейроны. Высвобождение астроцитами внеклеточных митохондриальных частиц было опосредовано кальций-зависимым механизмом, включающим передачу сигналов CD38 и циклической АДФ-рибозы. Временная очаговая ишемия головного мозга у мышей вызывала проникновение астроцитарных митохондрий в соседние нейроны, и это проникновение усиливало сигналы выживания клеток. Подавление передачи сигналов CD38 короткой интерферирующей РНК снижало перенос митохондрий во внеклеточное пространство и ухудшало неврологические исходы. Эти данные свидетельствуют о новом митохондриальном механизме нейроглиальных перекрестных помех, которые могут способствовать эндогенной нейропротекции и нейроновосстановлению после инсульта [13].
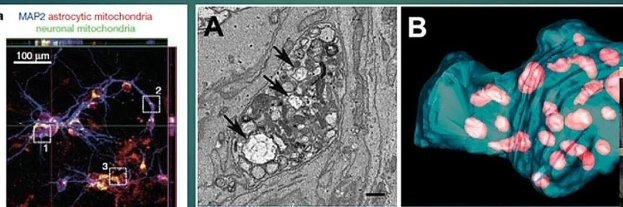
Рис. 2. Обмен митохондрий между нейронами и астроцитами
Одна из разновидностей функции очистки астроцитов является глимфатическая система — это функциональный путь выведения отходов центральной нервной системы позвоночных [5]. Эта система работает только во время сна, потому что его функция безусловно связана с концентрацией гормона мелатонина. В ночное время суток после образования в под паутинном пространстве церебральной жидкости наш мозг напитывается ею как губка. Объем нейронов сжимается до 40 %, а пространство между ними соответственно расширяется и в результате из паутинного пространства цереброспинальная жидкость по около сосудистому пространству проникает во внутрь мозга. Именно в это время астроциты открывают Аквапорин 4 типа (трансмембранный белок водопроводящий клеточных стенок, который регулирует транспорт воды между кровеносными сосудами головного мозга). Эта жидкость затекает через астроцит во внутренне вещество мозга под давлением и собирает все ненужные утилиты и обратно через эти каналы астроцит собирается в около сосудистое пространство, но уже в вену (как механизм фонтана). Оттуда эта утилитная жидкость выходит двумя путями: через венозный синус сорбируется в венозную кровь, или в лимфатические сосуды, которые присутствуют в паутинной оболочке. [10, 11].
Сон регулирует иммунный ответ [3], нарушение сна приводит к воспалительному ответу, повышению проницаемости ГЭБ и усугублению глимфатической дисфункции [8, 9].
Взаимосвязь между качеством сна, иммунной системой и нейродегенеративными заболеваниями сложна, и разобраться в ней непросто. Эти взаимодействия часто носят двунаправленный характер, поскольку сон характеризуется как ранний симптом и потенциальный фактор, способствующий развитию и прогрессированию расстройств настроения и когнитивных функций [8].
Также существует взаимосвязь между заболеваниями пародонта и болезнью Альцгеймера (БА), обусловленная потерей зубов и улучшением памяти после стоматологического вмешательства. Это связывает микробный вклад местных патогенов пародонта полости рта с проявлением хронических заболеваний, таких как БА. Здесь использовали инфекцию Porphyromonas gingivalis, чтобы проиллюстрировать ее влияние на психическое здоровье. Инфекция P. gingivalis, в своей первичной субдесневой нише, может вызывать полимикробный синергизм и дисбактериоз. Дисбактериоз — это состояние, при котором отдельные комменсалы обитают в полости рта, объединяясь вокруг доминирующего ключевого патогена, такого как P. gingivalis, для повышения вирулентности. Начальный процесс заключается в том, что P. gingivalis нарушает опосредованные нейтрофилами врожденные иммунные реакции в здоровых деснах, а затем подавляет дифференцировку и развитие адаптивных иммунных клеток, что приводит к вторжению и последующему образованию новых дисбиотических бактериальных сообществ. Иммунные реакции влияют на организм хозяина в целом и функционально через изменение рациона питания, вызванное потерей зубов. Исследования, проведенные на животных, инфицированных P. gingivalis перорально, подтверждают, что эта бактерия может проникать в отдаленные органы (головной мозг) и способствовать периферическому и внутримозговому воспалению, а также нарушать целостность сосудов и микрососудов. В другом исследовании инфекция P. gingivalis вызывала нарушения режима сна, изменяя активность молекулярных часов глиальных клеток в светлое и темное время суток, а это, в свою очередь, может влиять на выведение связанных с опасностью молекулярных паттернов, таких как β-амилоид, через глимфатическую систему. Поскольку P. gingivalis может проникать в мозг и модулировать органоспецифические воспалительные врожденные и адаптивные иммунные реакции, в данной статье исследуется, может ли более эффективное лечение местных бактерий пародонта задержать/ предотвратить возникновение и/или прогрессирование деменции [12].
У людей, МРТ исследование с использованием введенного интратекально контрастного вещества показывает, что ЦСЖ протекает по путям, которые очень похожи с ГС грызунов. Кроме того, позитронно-эмиссионная томография показала, что утилиты накапливаются в здоровом мозге уже после одной ночи лишения сна[6].Это позволило предположить, что человеческий глимфатический путь также будет активным во время сна. Другие исследования показали, что количество маркеров белка Тау в ликворе снижается у лиц с болезнью Альцгеймера по сравнению со здоровыми контрольными группами [2,7]. Кроме того, ПЭТ-исследования показали, что Aβ накапливается в здоровом мозге после одной ночи недосыпания, что позволяет предположить, что глимфатический путь человека также может быть активен в основном во время сна. Наблюдаемое снижение клиренса ликвора было связано с увеличением концентрации Aβ в сером веществе головного мозга человека, что согласуется с результатами, полученными на мышах, показывающими, что снижение глимфатической функции приводит к накоплению Aβ. Измененная экспрессия AQP4 также обнаруживается в тканях головного мозга пациентов с болезнью Альцгеймера или гидроцефалией с нормальным давлением; глимфатические МРТ-снимки пациентов с гидроцефалией с нормальным давлением показывают снижение поступления и выведения маркеров из ликвора. Глимфатическая система участвует не только в выведении метаболитов, но и в распределении глюкозы в мозге, липидов, аминокислот, различных факторов роста и нейромодуляторов. [6]
Вывод: Нервные клетки активно могут делиться и восстанавливаться при этом имеет значение стимуляция нейрогенеза и полноценный правильный режим сна для самоочистки глимфатической системы мозга. Систематическое интервальное голодание (с исключением воды) запускает процесс аутофагии и помогает сохранять и восстанавливать нервные клетки.
Литература:
- Bambrick L., Kristian T., Fiskum G. Astrocyte mitochondrial mechanisms of ischemic brain injury and neuroprotection // Neurochemical Res. 2004. V. 29. № 3.Р. 601–608.
- Breymann CS. Die lymphatischen Abflusswege von Gehirn und Hypophyse im Mausmodell Inaugural (Dissertation zur Erlangung des Doktorgrades fur Zahnheilkunde der Medizinischen FakultКt der Georg-August-Universitat zu Gottingen); 2016.
- He J, Hsuchou H, He Y, Kastin AJ, Wang Y, Pan W. Sleep restriction impairs blood-brain barrier function. Journal of Neuroscience. 2014;34(44):14697- 14706.
- Fontana L., Partridge L., Longo V. D. Dietary restriction, growth factors and aging: from yeast to humans //Science (New York, NY). — 2010. — Т. 328. — №. 5976. — С. 321.
- Rasmussen M. K., Mestre H., Nedergaard M. The glymphatic pathway in neurological disorders //The Lancet Neurology. — 2018. — Т. 17. — №. 11. — С. 1016–1024.
- Ramanan V. K. et al. GWAS of longitudinal amyloid accumulation on 18F-florbetapir PET in Alzheimer’s disease implicates microglial activation gene IL1RAP //Brain. — 2015. — Т. 138. — №. 10. — С. 3076–3088.
- Aguirre C. C. Sleep deprivation: a mind-body approach //Current opinion in pulmonary medicine. — 2016. — Т. 22. — №. 6. — С. 583–588.
- Pelluru D. et al. Optogenetic stimulation of astrocytes in the posterior hypothalamus increases sleep at night in C57 BL/6J mice //European Journal of Neuroscience. — 2016. — Т. 43. — №. 10. — С. 1298–1306.
- Xie L. et al. Sleep drives metabolite clearance from the adult brain //science. — 2013. — Т. 342. — №. 6156. — С. 373–377.
- Lee H. et al. The effect of body posture on brain glymphatic transport //Journal of Neuroscience. — 2015. — Т. 35. — №. 31. — С. 11034–11044.
- Harding A. et al. Can better management of periodontal disease delay the onset and progression of Alzheimer’s disease? //Journal of Alzheimer's Disease. — 2017. — Т. 58. — №. 2. — С. 337–348.
- Hayakawa K. et al. Transfer of mitochondria from astrocytes to neurons after stroke //Nature. — 2016. — Т. 535. — №. 7613. — С. 551–555.
- Smith D. H. et al. Chronic traumatic encephalopathy—confusion and controversies //Nature Reviews Neurology. — 2019. — Т. 15. — №. 3. — С. 179–183.
- Kahn C. R., Suzuki R. Insulin action in the brain and the pathogenesis of Alzheimers disease // Diabetes, insulin and Alzheimer`s disease / Ed.S. Craft. Hardcover: Springer, 2010, XIV, 218 p
- Kern W., Benedict C., Schultes B. et al. Low cerebrospinal fluid insulin levels in obese humans // Diabetologia. 2006.V. 49, № 11. P. 2790–2792.

