Бутадиен -1,3 впервые был получен из этилового спирта с одновременной каталитической дегиратацией и дегидрированием, c участием серной кислоты, в 30-ые годы прошлого века русским ученым С. В. Лебедовым, по следующей реакции:
2C2H5OH
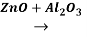
Из бутадиена-1,3, полученного по данному способу, был впервые синтезирован искусственный каучук и налажено его производство [1].
В 60 годах прошлого века этот способ заменен на более прогрессивный способ получения бутадиена-1,3 из бутаново-бутиленовой фракции природного газа, каталитическим дегидрированием:
CH3‒CH2‒CH2‒CH3
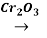
CH3‒CH2‒CH=CH2
В данное время известны десятки различных способов получения бутадиена-1,3. Более выгодным, из разработанных способов является способ использование бутадиена-1,3, который образуется из циклогексана, при каталитическом крекинге нефти.
Возможность получения бутадиена-1,3 из продукта пиролиза приводится в работе [2].
Из перечисленных выше способов ни один не является выгодным для Туркменистана. В качестве исходного вещества для получения бутадиена-1,3 у нас имеется природный газ, состоящий из 92–96 % метана.
Поэтому нами была сделана попытка получения бутадиена-1,3 из природного газа. Разработанный способ состоит из трех стадией, которые протекают в специально созданных условиях, последние две стадии которых протекают с участием катализаторов.
Первая стадия — крекинг метана, который протекает при высокий температуре:
2CH4
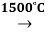
Данная стадия протекает в электродуговом реакторе вытеснения с теплообменником. Образованный при этом ацетилен, подвергается быстрому охлаждению для предупреждения его разложения (рис. 1).
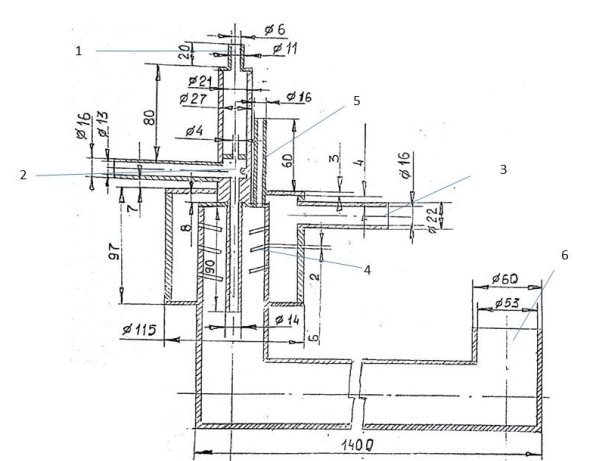
Рис. 1. Схема реактора крекинга метана
1 — входная труба метана; 2 — электрическая дуга; 3 — труба, в которую попадает вода; 4 — водяная разбрызгиватель; 5 — труба, через которую выделяется охлажденная газовая смесь; 6 — водопроводная труба
Наличие ацетилена доказали образованием осадка ацетиленида меди (I) красного цвета.
HC≡CH+2 [Cu(NH 3 ) 2 ]Cl → Cu‒C≡C‒Cu↓+ 2NH 4 Cl + 2NH 3 .
В электродуговом реакторе с температурой 2000‒3000 °С и при напряжении постоянного тока между электродами 1000 В происходит нагрев метана до 1600 °С, в результате получается ацетилен: Расход электроэнергии доходит до 13000 кВт·ч на 1 т ацетилена. Выход ацетилена — 50 % [3].
Вторая стадия — димеризация ацетилена. Она протекает с участием катализаторов, при температуре 5˚C. В результате реакции образуется смесь винилацетилена и дивинилацетилена:
2HC≡CH
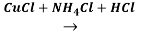
3HC≡CH
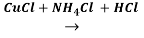
Данная стадия протекает в реакторе смещения, в котором газовая смесь пропускается через смеси растворов катализаторов [1]. Непрореагировавшие водород и метан не вступают в данную реакцию
Присутствие винилацетилена доказали образованием осадка винилацетиленида меди (I) красного цвета.
CH2=CH‒C≡CH+ [Cu(NH 3 ) 2 ]Cl → H 2 C=CH‒C≡CCu↓ + NH 4 Cl + NH 3 .
Присутствие дивинилацетилена в жидкой смеси доказали образованием осадка дивинилацетиленида меди (I) красного цвета.
CH 2 =CH‒CH=CH‒C≡CH + [Cu(NH 3 ) 2 ]Cl → CH 2 =CH‒CH=CH‒C≡C Cu↓ + +NH 4 Cl + NH 3 .
Третья стадия — гидрирование винилацетилена и дивинилацетилена
Смесь продуктов реакции разделяется на отдельные составляющие, в виду отличия их агрегатного состоянии, переводом винилацетилена в жидкое состояние. При температуре 25˚C винилацетилен подвергается гидрированию с получением бутадиена-1,3.
CH2=CH‒C≡CH + H2
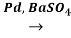
CH2=CH‒CH=CH‒C≡CH+4H2
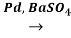
Осаждение винилацетилена из продуктов реакции производили реакцией раствор хлорида меди (I) в аммиаке, с образованием осадка винилацетиленида меди (I) красного цвета. Оставшиеся бутадиена-1,3, следующей реакцией:
3CH 2 =CH‒CH=CH 2 +4KMnO 4 +8H 2 O→
→3CH 2 (OH)‒CH(OH)‒CH(OH)‒CH 2 (OH)+4MnO 2 +4KOH.
В результате обесцвечивается раствор перманганата калия.
Как видно из изложенного, процесс синтеза бутадиена-1,3 является многостадийным. Хотя для осуществления каждой из них требуется отдельный реактор, и соответственно, много материальных расходов, рентабельность производства является высокой. Приводим оптимальную технологическую схему (рис. 2).
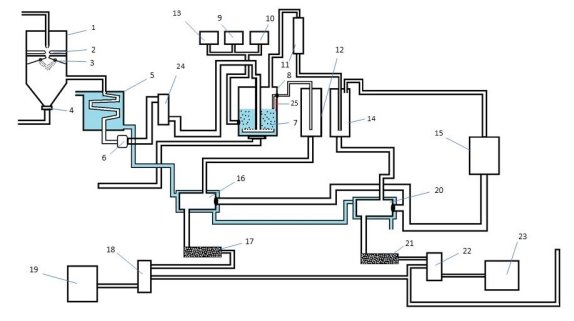
Рис.2. Оптимальная технологическая схема производства
1 — устройство электрического крекинга; 2 — электрическая дуга; 3 — водяная разбрызгиватель; 4 — клапан; 5 — охладитель; 6 — фильтр; 7 — раствор катализаторов; 8 — димеризационная колонна; 9 — раствор хлорида меди (1); 10 — раствор хлорида аммония; 11 — холодильник; 12 — колонна для хранения дивинилацетилена; 13 — раствор соляной кислоты; 14 — колонна для хранения винилацетилена; 15 — колонна для хранения метана и водорода; 16 — колонна газового смесителя; 17 — колонна для гидрирование; 18 — разделительная колонна; 19 — колонна для хранения гексана; 20 — колонна газового смесителя; 21 — колонна для гидрирование; 22 — разделительная колонна; 23 — колонна для хранения бутадиен-1,3; 24 — холодильник; 25 — Датчик
Для производства 1 т ацетилена из метана затрачивается 13 МВт·ч электрической энергии [3]. Рекомендуем использовать смеси метана и водорода, которая остается в позиции 15 (рис. 2) в виде отходов, для производства электрической энергии. Вычисленное количество энергии составляет 23,9 МВт·ч, и соответственно, рекомендуемая технология является экономически выгодной.
Литература:
- Реутов А.О, Курц Л.А, Бутин П. К. Органическая химия, в 4-x частях, часть Москва, БИНОМ. Лаборатория знаний, 2010.
- Егорова П. А. Производство бутадиена-1,3 из С-4 фракции пиролиза. Материалы опубликованные в интернете 2019 г.
- Работы фирмы Huls (ФРГ). https://helpiks.org/5–45572.html

