Начало исследований изополисоединений (ИПС) и гетерополисоединений (ГПС) было положено Я. Берцелиусом, когда он впервые описал желтый осадок, полученный при добавлении молибдата аммония к ортофосфорной кислоте. В конце XIX века (1893 г.) появилась координационная теория Вернера, которая послужила основой для создания теории о строении ГПС. В результате первых исследований в этой области было выявлено, что оксометаллатная сфера построена из искаженных металл — кислородных октаэдров МО 6 , которые образуют координационную сферу вокруг атома-комплексообразователя. По типу искажений октаэдры МО 6 близки к октаэдрам, образующим трехмерный каркас оксидов металлов. Это обусловливает аналогию в свойствах оксидов и анионов ИПС и ГПС [1]. На протяжении многих лет гетерополисоединения являются предметом научного интереса многих исследователей в области координационной химии, физики, биохимии. ГПС — это один из необычных и интересных в теоретическом отношении класс координационных соединений, которые относятся к полилигандным соединениям. В качестве лигандов ГПС выступают полимерные частицы оксосоединений вольфрама, молибдена, ванадия и ниобия; в качестве центральных атомов — около 50 элементов периодической системы Д. И. Менделеева, в том числе металлы и неметаллы. В современном мире, химия полиоксиметаллатов выступает как перспективное направление, и служит строительными блоками для создания наноразмерных полимерных структур, ГПС обладают определенными параметрами и уникальной структурой и свойствами. ГПС состоят из аниона и противокатиона. Существуют несколько десятков типов структур. Основные это структуры Кеггина, Перлоффа (рис.1) и Андерсона. В настоящее время ГПС находят применение в аналитической химии, биохимии, гомогенном и гетерогенном катализе.
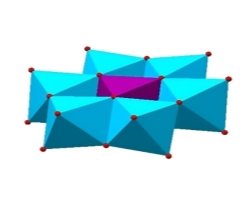
Рис. 1. Структура типа Перлоффа
Авторы статьи синтезировали гексамолибденониккелат аммония шестого ряда, со структурой типа Перлоффа. Получение данного кристалла обычно вызывает затруднения. Поэтому методика синтеза была модифицирована. Так белый порошок четырёх водного парамолибдата аммония [(NH 4 ) 6 Mo 7 O 24 ·4H 2 O] растворяли в кипяченной дистиллированной воде и нагревали раствор до 80°C до полного растворения при постоянном и очень интенсивном перемешивании. Полученный раствор подкисляли концентрированной азотной кислотой, до значения pH=3. Далее в горячей воде был растворён нитрат никеля(II) и добавлен к раствору парамолибдата аммония. Полученная смесь ярко- зеленого цвета несколько минут нагревалась на электроплите, а затем по каплям прибавляли 2–3 мл 3 % пероксид водорода. Данный раствор ставили на водяную баню и выпаривали около трех часов, до сокращения объема примерно в три раза.
Через несколько дней успешно проведенного синтеза был получен кристалл салатового цвета. На рис. 2 изображена микрофотография кристалла (NH 4 ) 4 [NiMo 6 O 18 (OH) 6 ] ·5H 2 О.
![Микрофотография (NH4)4 [NiMo6O18(OH)6] ·5H2О](https://articles-static-cdn.moluch.org/articles/j/110969/images/110969.002.jpg)
Рис. 2. Микрофотография (NH 4 ) 4 [NiMo 6 O 18 (OH) 6 ] ·5H 2 О
Изучение морфологии поверхности полученных соединений методом сканирующей (растровой) электронной микроскопии, а также их рентгеноспектральный микроанализ проводили при помощи аналитического комплекса сканирующего электронного микроскопа VEGA III LMU (TESCAN, Чехия), оснащенным системой микроанализа INCA Energy (Oxford, Англия). Авторами впервые получены изображения при разных коэффициентах увеличения (рис. 3, 4).
![Электронное изображение кристаллов (NH4)4 [NiMo6O18(OH)6] ·5H2О (при увеличении х273)](https://articles-static-cdn.moluch.org/articles/j/110969/images/110969.003.png)
Рис. 3. Электронное изображение кристаллов (NH 4 ) 4 [NiMo 6 O 18 (OH) 6 ] ·5H 2 О (при увеличении х273)
Внешний вид кристаллов (NH 4 ) 4 [NiMo 6 O 18 (OH) 6 ]·7H 2 О, полученный с помощью электронного микроскопа, позволяет оценить однородность и чистоту образца. А также, учитывая ранее полученные данные рентгено-фазовогоанализа, позволяет отнести данные кристаллы к моноклинной сингонии (рис.4).
![Электронное изображение кристаллов (NH4)4 [NiMo6O18(OH)6] ·5H2О при увеличении kх8,3](https://articles-static-cdn.moluch.org/articles/j/110969/images/110969.004.png)
Рис. 4. Электронное изображение кристаллов (NH 4 ) 4 [NiMo 6 O 18 (OH) 6 ] ·5H 2 О при увеличении kх8,3
Рентгеноспектральный микроанализ был сделан в разных областях поверхности порошка. Результаты элементного анализа (табл. 1) в достаточной мере коррелируются с теоретическими данными, а также данными полученные при помощи масс-спектрометрического анализа.
Таблица 1
|
Элемент |
Ni |
Mo |
O |
N |
|
Вычислено % (NH 4 ) 4 [NiMo 6 O 18 (OH) 6 ]·5H 2 О |
5,08 % |
49,86 % |
40,21 % |
4,85 % |
|
Найдено % (NH 4 ) 4 [NiMo 6 O 18 (OH) 6 ]·5H 2 О |
4,52 % |
49,28 % |
41,93 |
4,27 % |
Исходя из полученных экспериментальных данных можно сделать вывод о возможности исследования гексамолибденометаллатов аммония методом рентгеноспектрального микроанализа. Поэтому следующим этапом работы авторов будет синтез новых гетерополиструктур.
Литература:
- Поп М. С. Гетерополи- и изополиоксометаллаты. Новосибирск: Наука, Сибирское отделение. 1990. 232 с.

