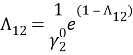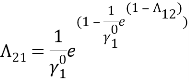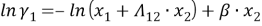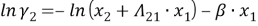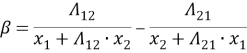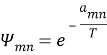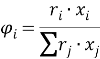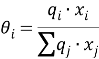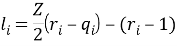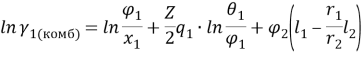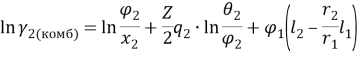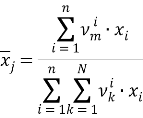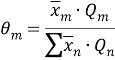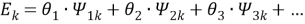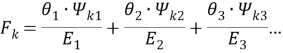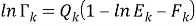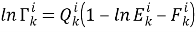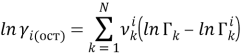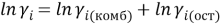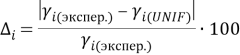В данной работе описываются способы определения коэффициентов активности изотермической системы пентан — ацетон с помощью полуэмпирического метода расчёта и теоретической модели UNIFAC, а также их сравнение с эмпирическими моделями.
Ключевые слова: коэффициент активности, UNIFAC, полуэмпирическая модель, бинарная система.
Полуэмпирическая модель Вильсона
Наибольшее распространение получила модель «локальных составов» (или «локальных концентраций»). Первое уравнение, основанное на этой модели, было выведено в 1964 г. Вильсоном. Модель «локальных составов» основана на том, что в результате межмолекулярных взаимодействий в смеси возникают локальные микросоставы, неэквивалентные макросоставу раствора по приготовлению. Различие локальных и средних концентраций компонентов связано с разностью энергий взаимодействия одноименных и разноименных пар молекул.
По данным статьи [1, с. 3] из графика зависимости коэффициентов активности компонентов системы пентан (1) — ацетон (2) и ln γ1/γ2 от состава системы экстраполяцией кривой lnγ 1 =f(x 1 ) находят при х 1 =0 lnγ 0 1 = 1,7572 и γ 0 1 = 5,796, а экстраполяцией зависимости lnγ 2 =f(x 2 ) при х 1 =1 определяют lnγ 0 2 = 1,9257 и γ 0 2 = 6,86.
Т. к. система с положительным отклонением от закона Рауля, то по номограмме (рисунок 1) ориентировочные значения приведенных параметров уравнения Вильсона: Λ 12 = 0,38 и Λ 21 = 0,3.
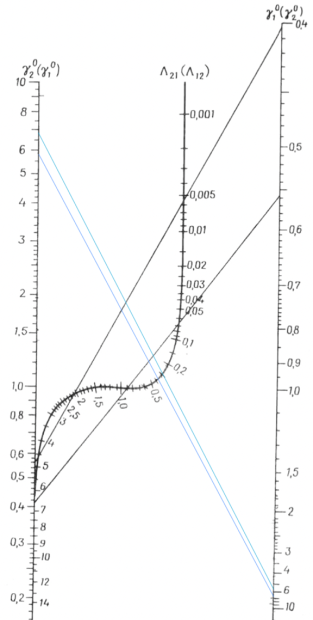
Рис. 1. Номограмма для определения приведенных параметров уравнения Вильсона
Далее рассчитывают уточненные значения приведенных параметров по уравнениям:
|
|
(1) | |
|
|
(2) |
Отсюда получим, что Λ 12 = 0,379 и Λ 21 = 0,314
|
|
(3) | |
|
|
(4) | |
|
|
(5) |
Далее находят значения β и lnγi по уравнениям:
Таблица 1
Коэффициенты активности компонентов, рассчитанные по методу Вильсона
|
x1, мол. д. |
β |
lnγ1 |
lnγ2 |
|
0,0094 |
0,669 |
1,618 |
0,0002 |
|
0,054 |
0,593 |
1,446 |
0,006 |
|
0,0887 |
0,539 |
1,326 |
0,015 |
|
0,16 |
0,440 |
1,107 |
0,046 |
|
0,3741 |
0,198 |
0,616 |
0,223 |
|
0,388 |
0,183 |
0,590 |
0,238 |
|
0,4721 |
0,099 |
0,450 |
0,344 |
|
0,5689 |
0,003 |
0,313 |
0,493 |
|
0,6548 |
-0,088 |
0,211 |
0,654 |
|
0,7192 |
-0,161 |
0,147 |
0,796 |
|
0,7787 |
-0,235 |
0,096 |
0,947 |
|
0,9223 |
-0,457 |
0,014 |
1,423 |
Сравнение эмпирических и полуэмпирических методов
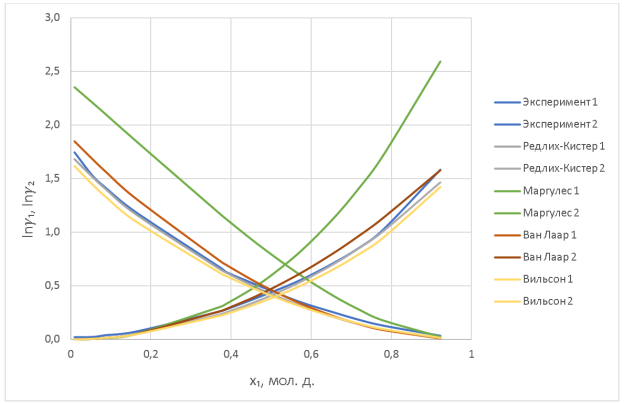
Рис. 2. Зависимость 𝛄 i компонента системы пентан — ацетон от состава при 25 о С
Было произведено сравнение эмпирических методов, описанных в статье [1] и полуэмпирического метода. Для математического описания зависимости коэффициентов активности компонентов системы пентан — ацетон лучше всего использовать уравнение Редлиха-Кистера.
Теоретические модель. Метод UNIFAC ( UNIquac Functional — group Activity Coefficients )
Расчет коэффициентов активности компонентов системы пентан (1) — ацетон (2) при х 1 = 0.16 и температуре 25°С (298.15 К) методом UNIFAC.
Молекула пентана представляется в виде 3 групп СН 2 и 2 групп СН 3 , а молекула ацетона — как 1 группа CH 3 CO и 1 группа СН 3 . Параметры объема R k и поверхности групп Q k приведены в таблице 2.
Параметры взаимодействия групп: а 12 = 0, а 13 = 476,4, а 21 = 0, а 23 = 476,4, а 31 = 26,76; а 32 = 26,76. Приведенные параметры группового взаимодействия, рассчитанные по уравнению:
|
|
(6) |
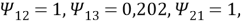
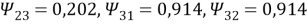
Таблица 2
Параметры объема и поверхности групп СН 2 , CH 3 и CH 3 CO
|
N группы |
Группа |
R k |
Q k |
Количество групп в молекуле | |
|
Пентан |
Ацетон | ||||
|
1 |
СН 2 |
0,6744 |
0,540 |
3 |
0 |
|
2 |
СН 3 |
0,9011 |
0,848 |
2 |
1 |
|
3 |
CH 3 CO |
1,6724 |
1,488 |
0 |
1 |
Ван-дер-ваальсовы радиусы молекул компонентов:
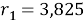
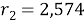
Ван-дер-ваальсовы поверхности молекул компонентов:
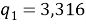
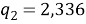
Объемная доля компонентов в растворе, рассчитанная по уравнению:
|
|
(7) |
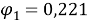
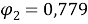
Доля площади поверхности молекул компонентов в растворе, рассчитанная по уравнению:
|
|
(8) |
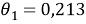
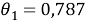
Факторы объемности молекул компонентов, рассчитанные по уравнению:
|
|
(9) |
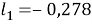
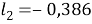
Далее используют уравнения:
|
|
(10) | |
|
|
(11) |
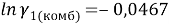
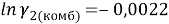
Групповые доли групп в растворе при х 1 =0,16, рассчитанные по уравнению:
|
|
(12) |
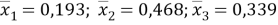
Доля площади поверхности групп в растворе рассчитывается по уравнению:
|
|
(13) |
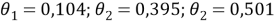
Молекула пентана на 0,6 состоит из группы СН 2 и на 0,4 из группы СН 3 , а молекула ацетона на 0,5 состоит из группы СН 3 и на 0,5 из группы СН 3 CO, поэтому расчет был произведен и для раствора, и для чистых компонентов, результаты представлены в таблице 3.
Таблица 3
Доля площади поверхности групп в растворе и в чистых компонентах
|
Параметр |
Раствор |
Пентан |
Ацетон |
|
θ 1 |
0,104 |
0,489 |
- |
|
θ 2 |
0,395 |
0,511 |
0,363 |
|
θ 3 |
0,501 |
- |
0,637 |
Средневзвешенные параметры взаимодействия групп рассчитывают по уравнению:
|
|
(14) |
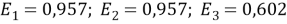
Таблица 4
Средневзвешенные параметры взаимодействия групп в растворе и для чистых компонентов
|
Параметр |
Раствор |
Пентан |
Ацетон |
|
E 1 |
0,957 |
1 |
- |
|
E 2 |
0,957 |
1 |
0,945 |
|
E 3 |
0,602 |
- |
0,710 |
Значения дополнительной функции F i рассчитывают по уравнению (15) и приводят для раствора и чистых компонентов в табл. 5:
|
|
(15) |
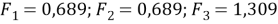
Таблица 5
Дополнительные функции групп в растворе и для чистых компонентов
|
Параметр |
Раствор |
Пентан |
Ацетон |
|
F 1 |
0,689 |
1 |
- |
|
F 2 |
0,689 |
1 |
0,565 |
|
F 3 |
1,309 |
- |
1,248 |
Коэффициенты активности групп в растворе рассчитываются по уравнению (16) и в чистых компонентах — по уравнению (17):
|
|
(16) |
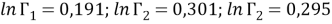
|
|
(17) |
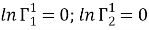
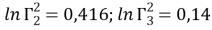
Далее рассчитывают коэффициенты активности компонентов с учетом остаточной и комбинаторной составляющих по уравнениям (18) и (19):
|
|
(18) |
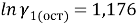
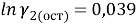
|
|
(19) |
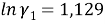
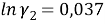
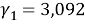
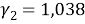
Погрешность расчета γ 1 и γ 2 методом UNIFAC составляет при х 1 = 0,16:
|
|
(20) |
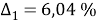
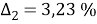
Литература:
- Цымлякова, Ю. Д. Проверка адекватности эмпирических и полуэмпирических моделей при изучении фазового равновесия в бинорной системе «углеводород — апротонный растворитель» / Ю. Д. Цымлякова. — Текст: непосредственный // Молодой ученый. — 2022. — № 26 (421). — С. 1–7. — URL: https://moluch.ru/archive/421/93746/ (дата обращения: 08.07.2022).
- Гайле, А. А. Процессы разделения и очистки продуктов переработки нефти и газа / А. А. Гайле, В. Е. Сомов, А. В. Камешков. — 2. — 2018: Химиздат, 2018. — 432 с.
- Уэйлес, С. Фазовые равновесия в химической технологии. Ч. 1, 2. — М.: Мир, 1989. — 664 с.