В статье были выделены основные аспекты пресноводных и слабосоленых озерных нитрофицирующих бактерий в Курганской области.
Ключевые слова: нитрифицирующие бактерии, пресноводные озера, соленые озера, грамположительные, грамотрицательные.
Актуальность : нитрифицирующие микроорганизмы, обитающие в водоемах, осуществляют часть замкнутого цикла основного биогенного элемента — азота, который задействован в потоке энергии в водной среде.
Водные экосистемы являются динамичным подразделениям, поэтому и озера участвуют в динамичных биосферных процессах (сукцессионных, флуктуациях, межсезонных) [1, с.7].
Изучение роли нитрифицирующих микроорганизмов и самого азотного обмена здесь — это важный показатель, влияющий на развитие планктона, как кормовой базы для целевых гидробионтов: рыбы, ракообразные и т. п.
Так как в Курганской области насчитывается более трех тысяч озер, следовательно, изучение роли нитрифицирующих бактерий, в том или ином водоеме, представляет собой важный момент гидробиологических исследований.
Объектом для исследования послужили сборы воды на территории Курганской области со следующих озер: Половинное, Становое, Беломойное, Снегирево, Голубые озера, Соленое, Елошное и Суерское.
Озера замкнутого типа – это озера, где глинисто-заиленое дно преобладает над песчаным. К пресноводным относятся озера от 0,01 % минерализации до 0,3 %. К слабосоленым относятся водоемы от 0,3 % до 1 % минерализации [3, с. 7]. Уровень солености определяли TDS-метром. Характеристика водоемов представлена в таблице 1.
Таблица1
|
Название водоема |
Дата взятия проб |
Зарастание |
Грунт водоема |
Прозрачность (см) |
Температура воды (С°) |
|
Половинное |
12.08.2021 |
Наводное- Phragmites australis . Подводное-– Ceratophyllum demersum . |
Глинисто-заиленый |
50 |
19,6 |
|
Становое |
12.08.2021 |
Подводное-)- Phragmites australis, рогоз Typha Latifolia . Зарастание подводное– Lamna minor, Lamna trisulca, телорез+ водокрас. |
Илиситое |
40 |
19,2 |
|
Соленое |
12.08. 2021 |
Подводное- Myriophyllum spicatum . |
Глинисто-заиленый |
10 |
18,3 |
|
Беломойное |
12.08. 2021 |
Надводное- Phragmites australis . |
Глинисто-заиленый |
20 |
18,1 |
|
Суерское |
24.02.2022 |
Надводное-рогоз |
Илистое |
20 |
3,2 |
|
Елошное |
24.02.2022 |
Подводное придонное — Myriophyllum spicatum . |
Илистое |
40 |
2,8 |
|
Снегирево |
24.02.2022 |
Подводное- Myriophyllum spicatum . |
Глинисто-заиленый |
30 |
3,1 |
|
Голубые озера |
24.02.2022 |
Подводное- Potamogeton pectinatus,Myriophyllum spicatum . |
Песчаное |
50 |
3,6 |
Материалы и методы
На базе лаборатории КГУ мы выделяли микроорганизмы из стоячих водоемов стационарным методом их культивирования (посев). С помощью электронного одноканального дозатора были взяты пробы воды поверхностного слоя, каждая в объеме 1мл.
С использованием элективных твердых питательных сред нитрифицирующие бактерии количественно учитывали на ГПС и питательном агаре с добавлением сульфат аммония. В качестве индикаторов использовались лакмусовые бумажки, так как их почернение указывает на процесс выделения аммиака. На появившиеся через 5–10 дней колонии наносят по капле реактива Грисса, с покраснением среды регистрировали образование нитритов из аммония [5, с. 7].
Проводился непосредственный подсчет колоний на выделенном участке в 1см 2 . Микроскопировали с помощью микроскопа ЛОМО МИКМЕД-6, фото с помощью камеры MC-10(USB-3.0). К морфологическим признакам относили: форму бактерий, размеры колоний, окраску по Грамму. После окрашивания грамположительные бактерии проявляются в фиолетовом или синем цвете, а грамотрицательные — в красном [5, с. 7].
Результаты и их обсуждение
Визуально колонии проб микрофлоры озер Половинное, Становое, Беломойное и Соленое, между собой были сходны во всех чашках Петри, размер округлых колоний варьировался от 3 до 8 мм. После подсчета колоний выяснили следующее: пробы, находившиеся при комнатной температуре, имели большее количество колоний, но меньших в размере. При микроскопировании были отмечены бактерии различной морфологии: палочковидные, шарообразные и др [2, с. 7]. Окрашивание по Грамму на глюкозо-пептонной среде выявило преобладание грамположительных диплококков, с вкраплениями грамположительных палочек. Количество колоний выросших на ГПС, представлено на рисунке 1.
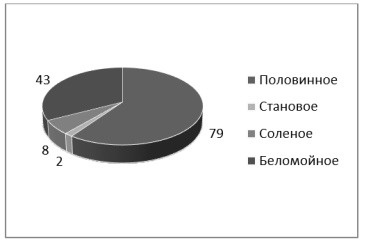
Рис. 1
В повторном посеве микрофлоры на питательном агаре, с добавлением сульфат редуцирующёего агента, культивировались мелко-зернистые колонии до 1мм. Они находились в тесном контакте друг с другом. Наблюдали общее преобладание грамположительных кокков, которые были размещены скоплениями разного размера и количества. Индикатор Грисса в микрофлоре воды озер Соленое и Беломойное, прореагировал красным окрашиванием, что связано с присутствием образовавшихся нитритов из аммония. Количество колоний, выросших на питательном агаре с добавлением сульфат аммония, на рисунке 2.
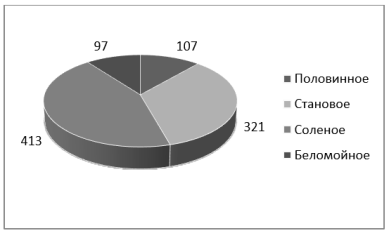
Рис. 2
Микрофлора водоемов Суерское, Снегирево, Елошное и Голубых озер была высеяна на питательный агар с добавлением сульфата аммония. При микроскопировании было замечено преобладание грамположительных сферических прокариотов, с вкраплениями грамотрицательных бактерий и присутствием спор высших грибов. Отмечали отсутствие палочковидных форм. Индикатор Грисса прореагировал в каждом посеве с микрофлорой воды, что указывало на наличие нитритов и интересующих нас бактерий, как представлено в таблице 2.
Таблица 2
|
Название бассейна |
Степень минерализации % |
Количество колоний |
Реакция на индикатор Гриса | |
|
Питательный агар + сульфат аммония (на 1см 2 ) |
Глюкозо-пептонная среда | |||
|
Половинное |
0,11 |
107 |
79 |
- |
|
Становое |
0,23 |
321 |
2 |
- |
|
Соленое |
0,61 |
413 |
8 |
+ |
|
Беломойное |
0,1 |
97 |
43 |
+ |
|
Суерское |
0,97 |
509 |
- |
+ |
|
Елошное |
0,33 |
711 |
- |
+ |
|
Снегирево |
0,27 |
23 |
- |
+ |
|
Голубые озера |
0,01 |
88 |
- |
+ |
Данные по выросшим прокариотам сведены в таблице 3.
Таблица 3
|
Название водоема |
Морфология микроорганизмов |
t инкуб |
Размер колоний (мм) |
Результат окраски по Грамму |
|
Половинное |
Единичные палочковидные |
22\35 |
3 |
Грамотрицательные с примесью грамположительных |
|
Становое |
Овальные диплококки |
35 |
8 |
Грамположительные |
|
Соленое |
Диплококки, вытянуты и закруглены |
22 |
4 |
Преобладание грамположительных |
|
Беломойное |
Палочковидные, кокки |
35 |
4 |
Грамположительные |
|
Суерское |
Мелкие скопления кокков, вытянутые прокариоты |
25 |
0–1 |
Грамположительные, окрасились стенки гифов грибов. |
|
Елошное |
Скопления в линии диплококков |
18 |
0–1 |
Грамположительные |
|
Снегирево |
диплококки |
18 |
0–1 |
Грамотрицательные преобладают |
|
Голубые озера |
Редкие кокки |
18 |
0–1 |
Грамположительные |
Количество колоний, выросших на питательном агаре с сульфат аммония, показаны на рисунке 3.
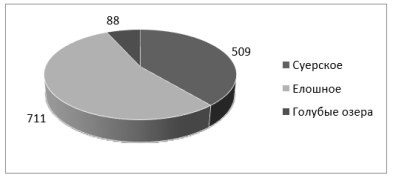
Рис. 3
Количество колоний на 1см 2 , сведения со всех проб микрофлоры воды отображены на рисунке 4.
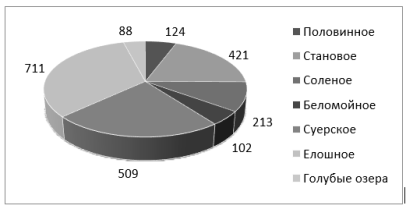
Рис. 4
Средний размер колоний во всех пробах микрофлоры на рисунке 5.
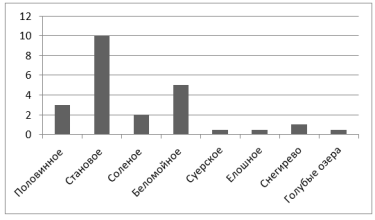
Рис. 5.
Выводы
В посевах на ГПС и питательном агаре, с добавлением в качестве питательных веществ сульфата аммония, были выявлены грамположительные и грамотрицательные бактерии с разной морфологией. Возможно, выделенные бактерии принадлежат к семейству Pseudomonadaceae , так как представители этого семейства неприхотливы в средах и окисляют азот [4, с.7].
В посевах микрофлоры поверхностных вод озер Курганской области преобладали грамположительные бактерии, следующей морфологии: сферические формы, диплококки ( Azotobacter ). Некоторое количество грамотрицательных палочковидных форм .
При прорабатывании методов получения нитрифицирующих микроорганизмов в пробах исследуемой воды были отличия в количестве и размерах колоний, которые проявлялись достаточно ярко.
Литература:
- Аникеев В. В., Лукомская К. А.. Руководство к практическим занятиям по микробиологии. М.: Просвещение, 1983 С. — 127.
- Кузнецов С. И., Дубинина Г. А. Методы изучения водных микроорганизмов /М.: Наука 1989.-288с.
- Методы микроэкологического исследования наземных, водных и воздушных экосистем: Учебное пособие для студентов высших учебных заведений, обучающихся по направлению «Биология» / С. В. Прудникова [и др.]. — Красноярск: СФУ, 2007–152 с.
- Микробиология и вирусология: учебно-методическое пособие / сост. Н. В. Шеховцова; Яросл. гос. ун-т им. П. Г. Демидова. — Ярославль: ЯрГУ, 2017–64 с.
- Приготовление питательных сред и культивирование микроорганизмов: Методическое пособие/ сост. А. П. Асташкина; Томск. гос. ун-т. — Томск: ТПУ, 2015.-19с.

