Приведены результаты сравнительного морфологического исследования влияния фотодинамических препаратов различного происхождения для безопасного и эффективного использования при флюоресцентной навигации и фотодинамической терапии опухолей сердца. В результате исследования выявлены как положительные, так и отрицательные аспекты применения препаратов, описаны механизмы действия, необходимые условия для достижения максимальной эффективности препаратов, приведены примеры побочных действий (при их наличии) и порядок реабилитации пациентов.
Ключевые слова: флюорохромы, фотодинамическая терапия (ФДТ), опухоли сердца, фотосенсибилизаторы.
В течение последних лет заболеваемость онкологией возросла в мире на 33 % [1]. Лидирующими онкологическими заболеваниями остаются рак легких (2,09 млн случаев), рак молочной железы (2,09 млн случаев), рак тонкой и толстой кишки (1,8 млн случаев), а также рак кожи (1,04 млн случаев) [2].
Саркомой сердца называется онкологическое образование, состоящее из соединительных тканей. Злокачественный характер диагностируется в четверти случаев, однако большая часть опухолей сердца является доброкачественной. Коварство данного заболевания заключается в сложности диагностики злокачественной опухоли на ранней стадии ее развития.
Одним из современных способов своевременного выявления и изучения злокачественных новообразований является метод фотодинамической терапии (ФДТ), основанный на способности препаратов-фотосенсибилизаторов под действием света с определенной длиной волны избирательно накапливаться в опухолевых клетках и генерировать синглентный кислород (два метастабильных состояния молекулярного кислорода с более высокой энергией, чем при основном, триплетном, состоянии), который способен разрушать злокачественную опухоль.
Из исследований последних 20 лет указанный метод зарекомендовал себя как крайне эффективный. В настоящее время активно используются уже созданные и применяемые в медицинской практике фотосенсибилизаторы, а также ведутся поиски новых препаратов для использования в фотодинамической терапии.
Целью данного исследования является сравнение различных фотосенсибилизаторов по нескольким критериям и выбор наиболее подходящего для безопасного и эффективного использования при флюоресцентной навигации и фотодинамической терапии опухолей сердца.
Нами было выделено шесть групп препаратов-фотосенсибилизаторов, представленных на рис.1., на основе их структуры, первая из которых — группа производных хлорина е6 .
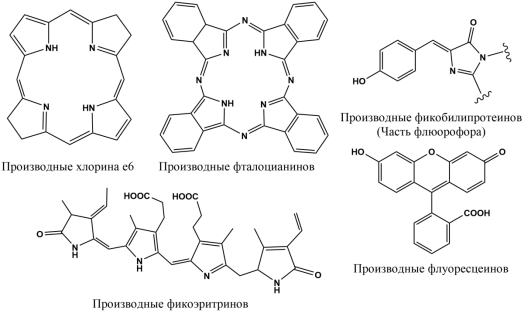
Рис. 1. Структуры препаратов
Первым представителем данной группы является мезо-тетра [1-(4'-бромбутил)-3-пиридил]бактериохлорин тетрабромид (3-RuBC) - относительно новый фотосенсибилизатор, первое упоминание о котором приходится на 2012 год. К преимуществам препарата относится ярко выраженная флуоресцентная контрастность в опухолях различного гистогенеза, а также практически полное отсутствие повреждения близлежащих тканей. Однако, несмотря на относительную безопасность, в некоторых случаях применения препарата наблюдалась местная реакция кожи и отечность. 3-RuBC обладает свойством фото выцветания в бесклеточной среде в связи с чем могут возникнуть сложности с его хранением [3,4]. Особенностью препарата является наличие в алкильной цепи терминального атома брома; при дополнительном введении препарата увеличивается количество молекул, которые способны перейти в возбужденное состояние, тем самым увеличивая выход синглетного кислорода. Это позволяет увеличить эффективность препарата и объясняет механизм его действия.
Следующим представителем класса производных хлорина е6 является мезо-тетра(3-пиридил)бактериохлорин , отличающийся высокой эффективностью терапии за счет более глубокого проникновения излучения в ткань. Препарат быстро выводится из организма, эффективно подавляет рост опухолевых клеток и обладает относительно низкой токсичностью. Однако препарат недостаточно устойчив и при длительном хранении постепенно происходит разрушение коллоидных наночастиц и образование осадка, что делает его непригодным для последующего использования [5,6]. Механизм действия основан на взаимодействии наночастиц с мембраной и органеллами клеток, которое происходит за счет поверхностных молекул, способных удерживаться на поверхности или отрываться от наночастицы, оставляя отдельные молекулы в виде данного фотосенсибилизатора в контакте с клеточными структурами. В зависимости от того, какое именно положение приняли поверхностные молекулы при контакте с клетками под влиянием лазера, отдельные молекулы данного препарата приобретают способность к флуоресценции [7].
Радахлорин — препарат, разработанный в 2005 году, однако выпуск состоялся лишь в 2007 году. Благодаря наличию гидрофобных компонентов в строении, фотосенсибилизатор отличается хорошим накоплением в опухолях и воспалительных очагах. По сравнению с другими, радахлорин имеет более глубокую и эффективную проницаемость в очаг поражения (на 3–4 мм) под действием лазерного облучения, что вызывает деструкцию опухоли. Из явных недостатков можно выделить то, что при его производстве вероятно появление в смеси иных компонентов, что может привести к повышению фототоксичности и изменению цитотоксичности. Таким образом, требуется внимательное отношение к контролю качества и применения высокочувствительных методов [8–10]. Фотосенсибилизирующее действие радахлорина проявляется при возбуждении светом с длиной волны 661–662 нм и заключается в эффективной генерации в опухолевой ткани цитотоксичных частиц, таких как синглетный кислород [11].
Фотолон — относительно новое средство в фотодинамической терапии. Препарат имеет хорошее накопление в опухолях, воспалительных очагах, благодаря амфифильному характеру комплекса фотосенсибилизатора с поливинилпирролидоном, способно смешиваться как с водой, так и с липидами. Также препарат обладает достаточно глубоким проникновением в ткань, что говорит о его высокой эффективности [12]. Фотолон обладает достаточно большим спектром побочных действий: повышение температуры тела и боли в зоне облучения (купируются анальгезирующими лекарственными средствами), повышение артериального давления у больных с сопутствующими заболеваниями сердечно-сосудистой системы. При введении в терапевтических дозах обладает слабовыраженной системной фототоксичностью. В первую неделю после введения препарата при нарушении светового режима у больных может развиваться гиперемия и отек открытых поверхностей тела (без пигментации) [13]. Механизм действия ФДТ с препаратом фотолон включает целый комплекс прямых и непрямых реакций взаимодействия различных компонентов, в конечном итоге приводящих к цитотоксическим эффектам [14].
Следующая рассмотренная группа препаратов — производные фталоцианинов .
Первый представитель — фталоцианин цинка . Впервые препарат появился в 2006 году [15]. Фотосенсибилизатор отличается мгновенным накоплением в опухолях различного генеза, длинноволновым максимумом поглощения (примерно 680 нм), что позволяет достичь глубоких некрозов (до 1 см). Препарат также имеет выраженное прямое противомикробное действие, поэтому он может использоваться также при интраоперационной ФДТ, в том числе у онкологических больных для профилактики послеоперационных осложнений [11]. Недостатками фталоцианина цинка являются некоторые значительные побочные эффекты, например, долгий процесс выведения из организма (даже через 72 ч уровень в коже составляет почти 20 % от максимального значения), в зоне облучения до 10 суток может сохраняться отек, а также у пациента наблюдается повышенная чувствительность кожи к дневному свету на протяжении 1 года. Препарат может вызывать значительную цитотоксичность и системные воспалительные реакции [16, 17]. При облучении лазерным излучением фотосенсибилизатора происходит переход нетоксичного триплетного кислорода в синглетный кислород, обладающий выраженным цитотоксичным действием, что приводит к разрушению клеточных мембран опухолевых клеток. Кроме того, все фталоцианины, в том числе фталоцианин цинка, приводят к повреждению лизосом, результатом чего становится утечка гидролитических элементов и, как следствие, разрушение опухоли [18].
Вторым представителем данной группы препаратов является фотосенсибилизатор фотосенс . Препарат был разработан и успешно прошел клинические исследования в 1994 году [19]. Фотосенс обладает интенсивным максимумом поглощения и хорошим квантовым выходом генерации синглетного кислорода, в 2–3 раза превосходящий максимум производных хлоринового ряда и более, чем в 30 раз — максимум самой длинноволновой полосы фотосенсибилизаторов порфиринового ряда, что позволяет достигнуть максимально полных некрозов (т. е. обладает свойством высокой цитофототоксичности). К тому же, благодаря длительному сохранению в опухоли, препарат позволяет проводить повторные сеансы облучения светом [11, 20]. К недостаткам фотосенсибилизатора относятся невысокая избирательность накопления в опухолях, способность накапливаться и надолго задерживаться в паренхиме органов и коже, что обусловливает повышенную чувствительность кожи к дневному свету — вплоть до 6 месяцев, а также обладает значительной цитотоксичностью [21, 22]. Последовательность действия препарата условно подразделяется на 3 фазы: в первую отражается характерная реакция организма на световое воздействие при ФДТ (отёк, гиперемия); во вторую фазу (2–7 день после сеанса) происходит некроз опухоли, в заключительной фазе происходит отторжение некротических масс и эпителизация дефекта рапы в течение 2–4 недель [22].
Следующая рассмотренная группа — производные фикобилинпротеинов — красный, желтый и зелёный флуоресцентные белки. В живой природе фикобилинпротеины в основном используются в качестве вспомогательных светоулавливающих пигментов.
GFP (green fluorescent protein ) — зелёный флуоресцентный белок, впервые был получен клонированием в 1992 году в лаборатории В. Варда [23]. Из главных преимуществ препарата можно выделить следующие: интенсивность и очень высокая яркость свечения, длительная фотостабильность при нормальных условиях, достаточно быстрая созреваемость (приготовление к применению) препарата, способность формировать флуорофорную группу автокаталитически (без привлечения внешних кофакторов и ферментов), практически полное отсутствие общей токсичности, а также способность легкого проникновения в клетки при условии совместного использования с мономером. Препарат имеет большое количество положительных аспектов, однако не лишен и недостатков, в ряд которых входят немного повышенная чувствительность к pH среды по сравнению с другими фотосенсибилизаторами, зависимость от молекулярного кислорода при созревании хромофора и относительно высокую стоимость по сравнению с другими флюорохромами; также максимум возбуждения флуоресцентного белка лежит близко к максимуму возбуждения ультрафиолета, что создаёт некоторые трудности при его применении [24, 25]. Механизм действия белка основан на том, что молекула GFP укладывается в напоминающую бочку структуру, образованную 11 β-слоями, внутри которых располагается α-спираль с хромофором. Хромофор формируется самой же полипептидной цепью в ходе автокаталитических реакций дегидрогенизации и окисления молекулярным кислородом остатка тирозина, окисленный остаток которого реагирует с другой аминокислотой в той же цепи — глицином. В результате возникает система так называемых сопряженных связей, способная к флуоресценции. Она поглощает «ультрафиолетовые» или «синие» фотоны и испускает в ответ фотоны с меньшей энергией, соответствующие сине-зеленому свету [23, 26].
RFP (red fluorescent protein) — красный флуоресцентный белок, впервые синтезированный в 2002 году [28]. Препарат отличается яркойфлуоресценцией, что делает данный белок наиболее распространённым для применения среди всех флуоресцентных белков в медицинской оптической визуализации, также обладает потенциальной совместимостью с существующими конфокальными и широкопольными микроскопами, а также высокой эффективностью [24–27]. К недостаткам относятся низкая фотостабильность, длительное проявление флуоресценции (через 24 часа после синтеза), неполное и медленное образование хромофора с примесью его зеленой флуоресцентной формы, что обуславливает нестойкий механизм действия (как следствие практически не используется во флуоресцентной онкологии), а также зависимость препарата от молекулярного кислорода при созревании их хромофора. Механизм действия препарата обусловлен следующим строением вещества: в центре красного флуоресцентного кольца было идентифицировано несколько фрагментов флуорофора p-HOBDI, который ответственен за значительное красное смещение и повышенную интенсивность флуоресценции. В результате также возникает система сопряженных связей, способная к флуоресценции и испускающая фотоны, соответствующие красно-оранжевому свету [28].
YFP (yellow fluorescent protein) — желтый флуоресцентный белок, полученный как производное GFR [29]. Данный вид белка имеет высокую фотостабильность, яркую флуоресценцию и стабилизацию момента возбуждённого состояния хромофора. Недостатками препарата являются большая чувствительность к кислым средам и потеря приблизительно половины своего свечения при pH < 6,5, также высокая чувствительность к ионам хлорида, быстрое фотообесцвечивание и зависимость от молекулярного кислорода при созревании их хромофора [24–27]. Так как желтые флуоресцентные белки получают непосредственно из GFP, они сохраняют их первоначальные свойства и вступают во флуоресценцию, имея схожий механизм действия [29].
Характерной особенностью производных флуоресцеина (FITC — fluoresceinisothiocyanate) является то, что препараты имеют очень яркую флуоресценцию, относительную доступность (сравнительно легкое получение в условиях лаборатории) и высокую точность диагностики поражённых участков [30]. Из недостатков данной группы можно отметить относительно низкую фотостабильность по сравнению с другими фотосенсибилизаторами, разрежающее место действия, что создаёт некоторые трудности в применении, а также возможность проявления побочных эффектов в виде аллергических реакций [31]. Механизм действия препаратов основан на образовании прочной связи с α-аминогруппами аминокислот в составе белков и пептидов. Благодаря этой способности, наиболее ярко FITC окрашивает ядрышки, так как именно здесь наиболее высокая концентрация белка. Значительные количества белка выявляются также в ядре и цитоплазме, где белок располагается неравномерно [31, 32].
Следующая рассмотренная группа — фикоэритрины . В настоящее время используются два представителя данной группы R-PE и B-PE. R-PE (R-фикоэритрин) является более доступным, так как может быть выделен из красных водорослей [33], также легко образует достаточно прочные связи с антителами в организме. Фотосенсибилизатор является одним из самых ярких флуоресцентных красителей, когда-либо идентифицированных [34]. Недостатком препарата является то, что R-фикоэритрин достаточно быстро обесцвечивается, образуя при этом фоновые помехи из-за чего могут возникнуть ложно-негативные результаты [35]. B-PE (B-фикоэритрин) также является одним из самых ярких флуоресцентов, однако в отличие от R-PE имеет меньший спектр поглощения — 545 нм вместо 565 нм — что делает его более устойчивым, благодаря чему практически не образуются фоновые помехи (шумы), а также препарат абсолютно нетоксичен [34]. Недостатками фотосенсибилизатора является меньшая прочность связи с антителами по сравнению с R-PE и меньшая доступность. Также испускаемый флуоресцентом свет находится в спектре 570 нм, что не сильно отличается от FITC (флуоресцеинов) и, соответственно, не позволяет полностью развести флуоресценцию, что может влиять на результаты, уменьшая их точность [34, 35].
Механизм действия препаратов достаточно схож и основывается на совместном использовании с различными красителями, например FITC (флуоресцеинами). На антитела ковалентно «пришивается» сразу два красителя, в данном случае это фикоэритрин и FITC. Фикоэритрин возбуждается аргоновым лазером и испускает кванты света в более высоковолновом диапазоне, это, в свою очередь, вызывает возбуждение молекулы FITC. Таким образом, если имеются антитела, меченые этими флуорохромами, то есть возможность количественно охарактеризовать содержание лимфоцитов: Т-клеток и Т-хелперов [36].
Заключительная группа получила название «другие», так как каждое рассмотренное в ней вещество является единственным представителем производных своей группы. В группу вошли следующие фотосенсибилизаторы: вертепорфирин (визудин), аласенс, метиловый эфир О-пропилоксим-N-пропоксибактериопурпуринимида, родамин 6G, этиопурпурин олова.
Вертепорфирин является производным бензопорфирина. Препарат отличается значительно хорошим накоплением в большинстве злокачественных опухолей, с локализацией в раковых клетках, имеет более глубокое проникновение в ткань, что делает данный фотосенсибилизатор крайне эффективным [37]. Из недостатков можно выделить следующие позиции.Во-первых, нерастворимость препарата в воде, что создаёт неудобства для получения готовых лекарственных форм. Во-вторых, данный фотосенсибилизатор имеет свойство накопления в подкожной жировой клетчатке и при внутривенном введении вертепорфирин на некоторое время вызывает повышенную чувствительность кожи к дневному свету. В-третьих, процесс производства этого вещества довольно сложен, что отражается на его конечной стоимости [38]. Механизм действия препарата основан на локализованном воздействии света, избирательности, быстром поглощении и накоплении фотосенсибилизатора быстро пролиферирующими клетками [39].
Фотосенсибилизатор Аласенс является производным α-аминолевулиновой кислоты. Он обладает хорошим накоплением в опухолях и очагах акне, а также хорошим проникновением лекарственной субстанции в кожу и ее смешиваемость с кремами на масляной основе [40]. Однако, данный фотосенсибилизатор отличается малым проникновением некогерентного излучения с длиной волны 630 нм в ткань (1–1,5 мм); во время его применения при процедуре ФДТ возникает достаточно сильная боль, связанная с локализацией препарата в зоне нервных окончаний, что является побочным эффектом данного препарата [40, 41]. Механизм действия основан на способности опухолевых клеток к повышенному накоплению в присутствии экзогенной 5-аминолевулиновой кислоты фотоактивного протопорфирина IX, наличие которого можно определить по специфической флюоресценции, вызываемой специальными источниками излучения [41, 42].
Метиловый эфир О-пропилоксим-N-пропоксибактериопурпуринимида является производным бактериопурпуринимида. Препарат имеет следующие преимущества: пигмент химически и фотостабилен во времени, он быстро выводится из организма, в частности из кожи (практически полностью в течение 24 часов), также обладает высокой фотоиндуцированной активностью по отношению к опухолевым клеткам человека различного генеза, при его использовании наблюдается почти 100 % торможение роста опухоли, имеет низкий уровень токсичности за счёт структурной близости к эндогенным порфиринам [43]. Несмотря на это, после использования препарата наблюдается интенсивный отек в зоне воздействия, который сохраняется до 4–5 суток, фотосенсибилизатор имеет также ограниченный интервал времени между его введением и достижением максимума накопления в опухолевых тканях, что усложняет процедуру ФДТ при его применении [43]. Механизм действия в данном случае состоит из системного введения наноструктурированной водной дисперсии (включающей фотосенсибилизатор) и воздействия на патологический участок оптическим излучением; при этом происходит увеличение углеродной цепи периферических заместителей (пропокси-заместители) в макроциклическом кольце, что повышает гидрофобность молекулы данного фотосенсибилизатора, необходимую для реализации эффективного трансмембранного переноса в опухолевых клетках, и в конечном итоге приводит к высокой фотоиндуцированной противоопухолевой активности [44].
Родамин 6G представляет собой производное линии родамина. Вещество отличается чрезвычайно высокой фотостабильностью по сравнению с другими фотосенсибилизаторами, имеет высокий квантовый выход флуоресценции и относительно низкую стоимость по сравнению с другими флюорохромами, диапазон генерации красителя находится в непосредственной близости от максимума его поглощения (примерно 530 нм) [47]. Недостатки препарата заключаются в коротком сроке его действия, низкой эффективности при лечении сарком, а также в некоторой токсичности, проявляющейся в опухании места действия и повышения чувствительности кожи к свету [45, 46]. Механизм действия Родамина 6G основан на свойствах этильной группы, которая при этом радикально изменяет структуру красителя и его физико-химические свойства, в том числе, флюоресценцию, поглощение, спонтанное свечение; действие проявляется в усилении подавления метаболизма и разрастания клеток меланомы, карциномы и других видов раковых опухолей [46, 47].
Заключительный препарат — этиопурпурин олова — является производным ряда пурпуринов. Препарат представляет собой чистое вещество и имеет пик поглощения при 660 нм; фотосенсибилизатор обладает хорошим накоплением в большинстве злокачественных опухолей и в очагах воспаления, а также имеет относительно глубокое проникновение в злокачественную ткань, что дает возможность добраться до глубокозалегающих опухолей [48]. Недостатки этиопурпурина олова следующие: фотодинамическая активность этого препарата не очень высокая по сравнению с другими фотосенсибилизаторами; вещество гидрофобно (не растворимо в воде), из-за чего возникают трудности при приготовлении лекарственных форм; фотосенсибилизатор также имеет достаточно сложный процесс производства [49]. Для активации действия фотосенсибилизатора вследствие его гидрофобности необходимы липопротеины высокой плотности для транспорта к злокачественному образованию. Механизм действия отличается восстановленной экзоциклической двойной связью, что снижает симметрию сопряженного макроцикла. Это приводит к увеличению поглощения в длинноволновой части видимой области электромагнитного спектра (650–680 нм) [50, 51].
На основании приведённого анализа препаратов был выделен наиболее оптимальный фотосенсибилизатор для безопасного и эффективного использования при флюоресцентной навигации и фотодинамической терапии опухолей сердца. Отбор производился по следующим критериям. Во-первых, препарат должен быстро выводиться из организма пациентов. Во-вторых, не иметь фототоксичности в терапевтических дозах. В-третьих, иметь высокое поглощение в инфракрасном диапазоне спектра (700–900 нм ±50нм) и высокую селективность накопления в опухолевых тканях, а также обладать однородным химическим составом. Исходя из данных критериев, наиболее подходящим фотосенсибилизатором является препарат «Фотосенс». Вещество по составу является трисульфофталоцианином гидроксиалюминия, обладает интенсивным максимум поглощения света (в 2–3 раза превосходящий максимум производных хлоринового ряда и более, чем в 30 раз — максимум самой длинноволновой полосы фотосенсибилизаторов порфиринового ряда), что обуславливает свойство цитотоксичности препарата. Более того, благодаря длительному сохранению в опухоли, препарат позволяет проводить повторные сеансы облучения светом.
Литература:
- Christina Fitzmaurice, et al. Global, Regional, and National Cancer Incidence, Mortality, Years of Life Lost, Years Lived With Disability, and Disability-Adjusted Life-Years for 29 Cancer Groups, 1990 to 2017 A Systematic Analysis for the Global Burden of Disease Study / Fitzmaurice Christina, Degu Abate et al. // JAMA Oncology. — 2019. — № 5(12). — P. 1749–1768.
- Ferlay J, Ervik M, Lam F, Colombet M, Mery L, Pineros M, et al. Estimating the global cancer incidence and mortality in 2020: GLOBOCAN sources and methods / Ferlay J, Colombet M, Soerjomataram I, Mathers C, Parkin DM, Piñeros M, Znaor A, Bray F// International Journal of Cancer. — 2020. — № 144(8). — P. 1941–1953.
- Тиганова И. Г., Макарова Е. А. и др. Фотодинамическая инактивация патогенных бактерий в биопленках с использованием новых синтетических производных бактериохлорина // BiomedicalPhotonics. — 2017. — Т. 6, № 4. — С. 27–36.
- Дудкин С. В. Синтез и некоторые свойства гидрированных производных тетраазапорфина и мезо-тетра(3-пиридил)порфина: специальность 02.00.03 «Органическая химия»: диссертация на соискание ученой степени кандидата химических наук / Дудкин Семён Валентинович; Российский химико-технологический университет имени Д. И. Менделеева. — Москва, 2012. — 160 c.
- Морозова Н. Б., Плотникова Е. А., Плютинская А. Д. и др. Доклиническое изучение препарата «Бактериосенс», предназначенного дляфотодинамической терапии злокачественных новообразований, в том числе рака предстательной железы // Российский биотерапевтический журнал.— 2018. — № 17(3). — C. 55–64.
- Морозова Н. Б., Панкратов А. А., Плотникова Е. А. и др. Изучение общетоксических свойств препарата «Бактериосенс», предназначенного для фотодинамической терапии злокачественных новообразований на грызунах и крупных животных // Research'n Practical Medicine Journal.— 2019. — № 6(4). — С. 67–83
- Маклыгина Ю. С., Бородкин А. В., Рябова А. В. и др. Исследование внутриклеточного распределения кристаллических наночастиц мезо-тетра(3-пиридил)бактериохлорина // BiomedicalPhotonics — 2016. — Т. 5, № 4. — С. 25–34.
- Решетников А. В. и др. Фотосенсибилизатор и способ его получения // Патент РФ № 2183956. Положительное решение от 21 декабря 2001 г. по заявке № 2001108397 от 30 марта 2001 г. SouthAfricanpatent 2003/8407 of 24 February 2005. United Kingdom patent GB2389531 of 13 March 2005. United States Patent US 6,969,765 of Nov.29, 2005. Chinese Patent No. 258833 of Apr.12, 2006. South Korean Patent No.10–0628548 of Sep.19 2006.
- PrivalovV.A., Lappa A. V., Seliverstov O. V. et.al. Clinical Trials of a New Chlorin Photosensitizer for Photodynamic Therapy of Malignant Tumors // In Optical Methods for Tumor Treatment and Detection: Mechanisms and Techniques in Photodynamic Therapy XI, SPIE Proceedings. — 2002. — № 1. —С.178–190.
- Privalov V. A., Lappa A. V., E. V. Kochneva. Five Years' Experience of Photodynamic Therapy with New Chlorin Photosensitizer // Proceedings of SPIE, ”Therapeutic Laser Applications and Laser-Tissue Interactions”. — 2005. — № 2. — P.186–198.
- Лукьянец Е. А. Поиск новых фотосенсибилизаторов для фотодинамической терапии// Фотодинамическая терапия и фотодиагностика. 2013. — № 2(3). — С. 3–16.
- Kostenich G. A., Zhuravkin I. N., Zhavrid E. A., Experimental Grounds for Using Chlorin E(6) in the Photodynamic Therapy of Malignant Tumors. // J. Photochem. Photobiol. — 1994. — № 3. — С. 211–217.
- Капинус В. Н., Каплан М. А., Спиченкова И. С., Шубина А. М., Ярославцева-Исаева Е. В. Фотодинамическая терапия эпителиальных злокачественных новообразований кожи. // Фотодинамическая терапия и фотодиагностика. — 2014. — № 3(3). — С. 9–14.
- Трухачева Т. В., Шляхтин С. В., Исаков Г. А., Истомин Ю. П.«Фотолон — новое средство для фотодинамической терапии» // Минск, РУП«Белмедпрепараты». — 2009. — № 29. — С. 64.
- Андрианов Д. С. Дибензодипиррометены: свойства и применение в синтезе тетрабензодиазапорфиринов: специальность 02.00.03 «Органическая химия»: диссертация на соискание ученой степени кандидата химических наук / Андрианов Дмитрий Сергеевич; Московский государственный университет имени М. В. Ломоносова. — Москва, 2016. — 149 c.
- Морозова Н. Б., Якубовская Р. И., Чиссов В. И. и др. Фотоиндуцированная активность invivо положительно заряженного фталоцианина цинка, предназначенного дляфотодинамической терапии злокачественных опухолей // Российский онкологический журнал. — 2012. — № 1. — С.23–28.
- Lukyanets E. A. Phthalocyanines as Photosensitizers in the Photodynamic Therapy of Cancer // Journal of Porphyrins and Phthalocyanines. — 1999.— № 3(6/7). —P. 424–432.
- Степанян А. А., Бернашевский Н. В., КулыгинаЗ.П., Исак А. Д. Фталоцианиновые пигменты // Вісник Східноукраїнського національногоуніверситету імені Володимира Даля. — 2014. — № 9. — С.39–49.
- Рыбкин, А. Ю. Фотофизические и фотодинамические свойства водорастворимых гибридных структур фуллерен-краситель: специальность 03.01.02 «Биофизика»: диссертация на соискание ученой степени кандидата биолологических наук / Рыбкин Александр Юрьевич; Московский государственный университет имени М. В. Ломоносова. — Москва, 2016. — 167 c.
- Stranadko E. F. et.al. Photodynamic therapy ofcancer: five year clinical experience // SPIEConference Proceedings. — 1997. — № 3.— С. 253–262.
- Лукьянец Е. А. Новые фотосенсибилизаторы для фотодинамической терапии // Российский химический журнал. — 1998. — T.XLII, № 5. — С. 9–16.
- Lukyanets E. A. // J. Porphyrins and Phthalocyanines. — 1999. — №.3(6/7). — С. 424–432.
- Филоненко Е. В., Серова Л. Г., Урлова А. Н. Фотодинамическая терапия больных с внутрикожными метастазами меланомы// Фотодинамическая терапия и фотодиагностика. — 2015. — № 4(2). — С. 22–25.
- González-González IM, Jaskolski F, Goldberg Y etal. Measuring membrane protein dynamics in neurons using fluorescence recovery after photobleach. //Methods Enzymol. — 2012. — № 504. — С.127–46.
- Степаненко О. В., Верхуша В. В., Кузнецова И. М., Туроверов К. К. Флуоресцентные белки: физико-химические свойства и использование в клеточной биологии // Цитология. — 2007. — Т. 49, № 5. — С. 395–420.
- Кудряшова, Н. С. Флуоресценция белка может быть эффективным индикатором химической и радиационной токсичности / Н. С. Кудряшова.// «Коммерсантъ Наука». — 2017. — № 6. — С. 29.
- Злобовская, О. Флуоресцентные белки: разнообразнее, чем вы думали! / О. Злобовская.// Биомолекула: [сайт]. — URL: (дата обращения: 16.05.2021).
- В. С. Олеся. «Флуоресцентные белки: физико-химические свойства и использование в клеточной биологии» / В. С. Олеся, В. В. Верхуша, И. М. Кузнецова, К. К. Туроверов. // Институт цитологии РАН. — 2007. — № 5. — С. 395–420.
- Н.В Плетнёва. Пространственная структура желтого флуоресцентного белка zYFP538 при разрешении 1.8А / Н. В. Плетнева, С. В. Плетнев, Д. М. Чудаков [и др.].//. — 2007. — № 4. — С. 421–430.
- Jie, Wang Mesoporous silica nanoparticles combined with MoS2 and FITC for fluorescence imaging and photothermal therapy of cancer cells / Wang Jie. // Journal of Materials Science. — 2020. — № 55. — С. 15263–15274.
- Глушко, В. Н. Исследования по получению флуоресцеин-5-изотиоцианата-флуоресцентного наномаркера для создания биосенсоров / В. Н. Глушко, Л. И. Блохина, Н. Ю. Садовская. // Российский химический журнал. — 2014. — № 58. — С. 40–45.
- В. Б. Мальханов, Г. Х. Гайнутдинова, Г. Г. Хафизов. Препарат для диагностики заболеваний и травм роговой оболочки глаза // Патент номер RU 2098089 C1. Номер заявки 9511004/1
- ЛосьС. И. Биохимические основы получения фикоэритрина из морских водорослей // Альгология. — 2008. — Т. 18, № 4. — С. 375–385.
- Ira, A,Levine,and,Joël Microalgae in Health and Disease Prevention / A,Levine,and,Joël Ira. — Université de Nantes:, 2018. — 339 c.
- Хайдуков, С. В. «Проточная цитометрия как современный метод анализа в биологии и медицине» / С. В. Хайдуков, А. В. Зурочка.// Медицинская Иммунология. — 2007. — № 4–5. — С. 373–378.
- Гудвилович И. Н., БоровковА. Б. Продукционные характеристики Porphyridium purpureum (Bory) Ross в условиях накопительной и квазинепрерывной культуры// Альгология. — 2014. — Т. 24,№ 1. С. 34–46.
- Pat. 5,028,621 (07/1991) USA / Dougherty T. J., Potter W. R., Weishaupt K. R. Drugs comprising porphyrins. // {as a continuation of Pat. 4,866,168 of 09/1989 and Pat. 4,649,151 of 05/1984}// C.A. — 1984. — V.101. — N14. — 116725y
- Robert, K. D. Reactions of protoporphyrin with tetracyanoethylene / K. D. Robert, Dolphin David. // The Journal of Organic Chemistry. — 1980. — № 45(25). — С. 5196–5204.
- БудзинскаяМ.В., ГуроваИ.В., ЩёголеваИ.В. и др.Комбинированная терапия экссудативной формы возрастной макулярной дегенерации сетчатки// Фотодинамическая терапия и фотодиагностика. — 2013. — № 1. — С. 20–24
- 5-Aminolevulinicacid-basedphotodynamictherapy: clinicalresearchandfuturechallenges / Q. Peng, T. Warloe, K. Berg, J. Moan.// Cancer. — 1997. — № 79. — С. 2282–2308.
- Филоненко, Е. В. Возможности флюоресцентной диагностики с препаратом Аласенс в колопроктологии / Е. В. Филоненко. // Cyberleninka: [сайт]. — URL: (дата обращения: 16.05.2021).
- Каримова, Л. Н. Флюоресцентная диагностика и фотодинамическая терапия acne vulgaris с применением Аласенса / Л. Н. Каримова. — Текст: электронный // Cyberleninka: [сайт]. — URL: (дата обращения: 16.05.2021).
- ПлотниковаЕ.А., СтрамоваВ.О., МорозоваН.Б. и др.Солюбилизация гидрофобного фотосенсибилизатора бактериохлоринового ряда в мицеллах поверхностно-активных веществ. // Biomedical Photonics. — 2019. — № 1. — С. 18–23.
- ПантюшенкоИ.В., ГринМ.А., Якубовская Р. И.и др.Новый высокоэффективный ИК-фотосенсибилизатор для фотодинамической терапии рака // Тонкие химические технологии. — 2014. — № 3. — С. 3–10.
- Pourtabrizi, M. Effect of microemulsion structure on fluorescence and nonlinear optical properties of rhodamine 6G / M. Pourtabrizi, N. Shahtahmassebi. // Journal of Fluorescence. — 2018. — № 28. — С. 323–336.
- Кутушов М. В., Германов Е. П. Применение родамин 6G в качестве лекарственного средства для лечения злокачественных новообразований и амилоидозов// Патент номер RU 2354369 C2. Номер заявки 2007109496/15.
- Серова В. Н. Флуоресценция родамина 6G в сополиметакрилатной матрице, модифицированной добавками дифенилтиомочевины / В. Н. Серова, Н. А. Жукова, В. В. Семашко. // Вестник Казанского технологического университета. — 2010. — № 10. — С. 195–198
- Morgan, A. R. An alternative to DHE / A. R. Morgan. // Proc. Soc. Photo-Opt. Instrum. Eng. (SPIE). — 1987. — № 847. — С. 172–179.
- Morgan, A. R. New photosensitizers for photodynamic therapy: a study of combined effects of metallopurpurine derivatives and light on transplantable bladder tumours / A. R. Morgan. // Cancer. — 1988. — № 48. — С. 194–198.
- Morgan, A. R. Metallopurpurins and light: effect on transplantable rat bladder tumours and murine skin. / A. R. Morgan. // Photochem. Photobiol. — 1990. — № 51. — С. 589–592.
- Razum, N. SnEt2: clinical update / N. Razum. // Proc. SPIE. — 1996. — № 2675. — С. 43–46.

