Композиционные материалы системы Cu-Al находят широкое применение в технике благодаря высоким тепло- и электропроводностью его компонентов. Он применяется при создании теплообменников и электротехнического оборудования, при этом в процессе эксплуатации подвергается ряду факторов — механических нагрузок, высоких температур и коррозионных сред. При этом вопросы коррозионной стойкости СКМ Cu-Al, полученного сваркой взрывом с последующим диффузионным отжигом, практически не изучен. В связи с этим, целью настоящей работы было изучение коррозионной стойкости слоистого КМ Cu-Al, полученного с помощью технологии, включающей в себя сварку взрывом и диффузионный отжиг, проведенный как в твердой фазе, так и с реализацией контактного плавления на границе слоев.
Образцы слоистого КМ были получены методом сварки взрывом. Сварку взрывом пакетов осуществляли при скоростях детонации заряда взрывчатого вещества и соударения плакирующей пластины с плакируемой, обеспечивающих качественное бездефектное соединение. Термическая обработка сваренных заготовок проводилась для получения между слоями из алюминиевого сплава и меди высокотвердой интерметаллидной диффузионной прослойки.
Образцы трех типов:
1 тип — исходный композит, полученный методом сварки взрывом без последующей дополнительной термической обработки.
2 тип — полученный сваркой взрывом и подвергнутый диффузионному отжигу при температуре 530 °C в течении 30 часов.
3 тип — получен сваркой взрывом и обработан при температуре выше температуры контактного плавления — 580 °C с выдержкой 1час.
Коррозионные исследования проводились по ГОСТ 9.913–90 при переменном погружении в электролит, имитирующем воздействие влажной приморской атмосферы в течении 60 дней.

Рис. 1. Макроструктуры образцов до испытаний на коррозию: а — 1-й тип; б — 2-й тип; в — 3-й тип.
Воздействие коррозионной среды, имитирующей морскую воду, на биметалл алюминий-медь вызывает явление контактной коррозии, имеющей электрохимическую природу. При помещении в электролит пары Cu-Al запускается анодный процесс, при котором разрушается алюминий, обладающий большей электроотрицательностью (-1,7В), чем медь (+0,339 В).
При взаимодействии композита системы медь-алюминий с агрессивной средой, имитирующей как морскую воду можно выделить следующие реагенты:
- Соль (NaCl)
- Вода (H 2 O)
- Алюминий (Al)
- Медь
Рассмотрим этапы прохождения химических реакций при взаимодействии композита с агрессивной средой.
При взаимодействии поваренной соли (NaCl) с водой происходит реакция диссоциации (распада на ионы) молекулы соли:
NaCl+H2O=H2O+Na+Cl,
Таким образом получаем среду, имитирующую морскую воду, являющуюся сильным электролитом.
Между хлором и алюминием, медью и хлором, также протекает следующие реакции:
2Al+3Cl=2AlCl 3 ,
Медь взаимодействует с галогенами. При этом образуются галогениды меди (II)
Cu+Cl 2 =CuCl 2
Любые границы раздела фаз энергетически неоднородны. В соответствии со статистикой Больцмана, на поверхности имеются активные (энергия больше средней) и пассивные участки (энергия меньше средней). Медь — химически малоактивный металл. При нагревании медь может реагировать с некоторыми неметаллами: кислородом, серой, галогенами. Естественно, что химическое взаимодействие начинается на активных участках.
На активных участках происходит окисление алюминия:
Al o → Al 3 + 3e,
КатионыAl 3+ переходят в раствор, электроны — на пассивные участки, где они ассимилируются полярными молекулами воды с восстановлением ионов водорода:
2e + 2H
2
O →H
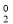
Окислительный и восстановительный процессы пространственно разделены, но совершаются одновременно.
Медь взаимодействует с кислородом с образованием оксида:
2Cu + O 2 → 2CuO
При взаимодействии с водным раствором поверхность алюминия покрывается гидрооксидной пленкой Al(OH) 3 в результате следующей реакции:
AlCl 3 + 3NaOH → Al(OH) 3 ↓ + 3NaCl
Выделяющийся газообразный водород разрывает гидроксидную плёнку, отслаивает её от алюминия, образуя участи коррозии. Это обеспечивает непрерывность процесса коррозии. Отслоившиеся чешуйки продуктов оседают на дне емкости.
При взаимодействии меди с водным раствором поверхность меди покрывается гидроксидом меди, получается следующая реакция:
Cu+NaOH=Cu(OH) 2 ↓
При длительном стоянии на воздухе, обогащённом кислородом, гидроксид меди(II) вступает в обратимую реакцию с кислородом, образуя грязно-красную смесь оксидов Cu(I) и Cu(II):
4Cu(OH) 2 +O 2 =2Cu 2 O 3 ↓+2H 2 O
Cu+HCl+O 2 =CuCl 2 +H 2 O
CuCl 2 +H 2 O= [Cu(NH 3 ) 4 ]Cl 2 +H 2 O
При электрохимической коррозии биметалла алюминий-медь за счет анодного процесса происходит разрушение алюминия, что должно вызывать потерю массы.
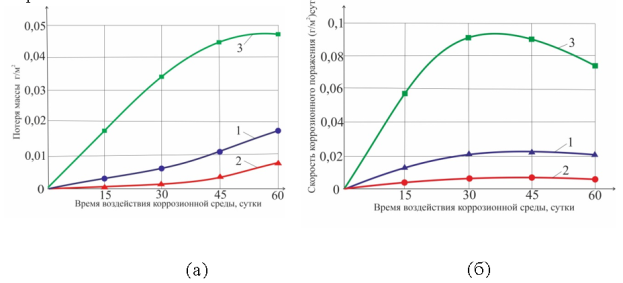
Как видно (рис. 3, а), потеря массы зависит от времени воздействия коррозионной среды и условий термической обработки. Максимума она достигает на 60 день эксперимента, что связано с тем, что на алюминии оседает все больше продуктов коррозии при катодном процессе.
Скорость коррозии (рис. 3, б) достигает максимума на 45-й день эксперимента и может составлять до 0,1 (г/м 2 )*сут при термической обработке 580 °С при выдержке 1 час. К 60-му дню эксперимента скорость коррозии падает не зависимо от условий термообработки.

Рис. 4. Микроструктура СКМ Cu-Al 60-й день эксперимента, х100: а — 1-й тип; б — 2-й тип; в — 3-й тип
Выводы:
Металлографическое исследование установило, что в зоне соединения двух металлов при воздействии коррозионной среды происходит выкрашивание частиц твердой интерметаллидной прослойки. Образцы третьего типа, полученные сваркой взрывом и обработанные при температуре выше температуры контактного плавления (580 °С с выдержкой 1 час) имеют наибольшую скорость коррозионного повреждения в присутствии жидкой фазы, что подтверждается данным о потери массы и скорости коррозионного повреждения. При этом слой меди практически не поврежден воздействием среды, благодаря протеканию катодного процесса в электролите.
Литература:
- Конструкционные материалы: Справочник / Б. Н. Арзамасов, В. А. Брострем, Н. А. Буше и др., под общ. ред. Б. Н. Арзамасова. — М.: Машиностроение, 1990. — 668 с.
- Семенова И. В., Флорианович Г. М., Хорошилов А. В. «Коррозия и защита от коррозии», 2002–336с.
- ГОСТ 9.908–85. Металлы и сплавы. Методы определения показателей коррозии и коррозионной стойкости.
- Слоистые композиты на основе алюминия и его сплавов. — М.: Металлургиздат, 2004. — 230с

