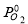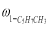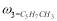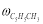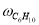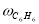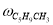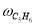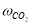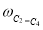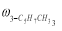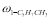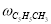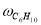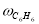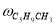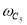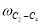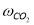Разработана кинетическая модель реакции окислительного дегидрирования изомеров метилциклопентена на HNa-мордените, модифицированным оксидами железа и неодима. На основании экспериментальных данных выбран механизм реакции. Определены ключевые вещества Рассчитаны константы скорости отдельных стадии. Найдены значения энергии активации и предэкспоненциальных множителей. Показано, что предложенная модель адекватно описывает экспериментальные данные.
Ключевые слова: окислительное дегидрирование, метилциклопентен, кинетическая модель, зерно катализатора.
Циклические С 5 -С 12 диеновые углеводороды являются важными продуктами и полупродуктами нефтехимического и органического синтеза. Получаемые на их основе мостиковые углеводороды применяются в качестве высокоплотных топливных компонентов, синтетические каучуки -полипентенамеры и полиоктенамеры в производстве шин, а кислородсодержащие производные используются для приготовления лакокрасочных и полиграфических материалов, пластификаторов, душистых веществ, фармакологических, бактерицидных препаратов, пестицидов и т. д. [1–3].
Целью кинетического исследования реакции окислительного дегидрирования изомеров метилциклопентана является установление наиболее вероятного механизма ее протекания и построение на этой основе адекватный кинетической модели. Последнее является необходимым условием для моделирования, оптимизации и масштабирования химического процесса, позволяющего в кратчайший срок переходить от изучения в лабораторных условиях к его промышленному внедрению [4].
Экспериментальная часть
Исходные изомеры метилциклопентена (МЦПЕ) получены дегидратацией циклогексанола при 220–250
0
С и изомеризацией циклогексена при 300–320
0
С в проточной двухсекционной однореакторной системе над
Активность синтезированных образцов испытывали в проточном интегральном реакторе с варьированием различных параметров реакции. Специальными опытами на бинарных смесях было изучено влияние продуктов на скорость основных реакций процесса и установлено практическое отсутствие тормозящего действия изомерами МЦПЕ и метилциклопентадиена (МЦПД), бензолом и диоксидом углерода.
Опыты по изучению кинетических закономерностей реакции проводились в лабораторной установке с безградиентным реактором при температуре 623–723К, объемных скоростях подачи МЦПЕ 62,9–426.2 час -1 , начальных парциальных давлениях углеводорода 12,7–15,5 кПа и кислорода 1,5–4,7кПа.
Контроль за ходом реакции осуществлялся методом ГЖХ, с использованием калибровочных кривых по изменению концентрации 1- и 3-МЦПЕ. Анализ проводился на хроматографе «Хром 3» с пламенно-ионизационным детектором.
Эффективное разделение продуктов превращения МЦПЕ достигнуто на фазе тио-
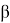
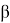
Предварительными опытами при вышеуказанных условиях установлено, что варьирование размера зерен катализатора от 0.5–1.0 до 4.5мм и частоты пульсации поршня в реакторе (25и 50Гц) не влияет на значения скоростей реакции, что указывает на отсутствие внутри- и внешне диффузионного торможения.
Обсуждение результатов
Результаты проведенных исследований (табл. 1 и 2) показывают, что качественный состав катализатов, полученных превращением индивидуальных изомеров МЦПЕ, аналогичен, однако скорости накопления отдельных компонентов различаются.
Так, 1-МЦПЕ (табл.1) превращается преимущественно в направлении парциального и деструктивного окисления с накоплением в контактном газе изомеров МЦПД, С
2
-С
5
углеводородов и СО
2
. При идентичных условиях 3-МЦПЕ, наряду с вышеуказанными направлениями, подвергается также окислительному дегидродеметилированию в циклопентадиен. Дегидродеметилирование 1-МЦПЕ наблюдается лишь при условиях, способствующих повышению скорости миграции кратной связи из
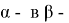
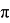
На основании экспериментального материала была выбрана совокупность независимых параллельно-последовательных маршрутов, описываемых следующими уравнениями:
-
С
5
Н
7
СН
3
+0.5 О
2
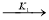

-
С
5
Н
7
СН
3
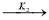
-
С
6
Н
10
+О
2
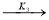
-
2С
5
Н
7
СН
3
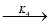
-
С
5
Н
7
СН
3
+2О
2
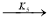
-
С
5
Н
5
СН
3
+2.5 О
2
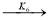
-
С
5
Н
5
СН
3
+3.5 О
2
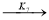
-
С
5
Н
5
СН
3
+5 О
2
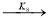
где С 5 Н 7 СН 3 və С 5 Н 5 СН 3 — сумма изомеров МЦПЕ и МЦПД, соответственно, С 6 Н 10 -циклогексен, С 6 Н 6- бензол, С 5 Н 6 -циклопентадиен.
Определение кинетических констант осуществлялось минимизицаей суммы квадратов отклонений между расчетными и экспериментальными значениями скоростей методом случайного поиска [5]. Учитывая данные хроматографического анализа состава контактного газа, скорости деструктивного окисления МПЦП по маршрутам VI-VIII-r 6 , r 7 и r 8 были приняты практически равными r 6
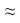
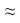
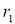
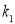
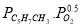

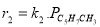

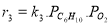
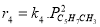
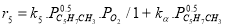
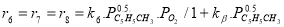
В качестве медленной стадии выбран маршрут взаимодействия МЦПЕ и МЦПД с кислородом поверхности катализатора. Остальные стадии принимаются быстрыми или равновесными. По правилу Хориути, число стехиометрических маршрутов, отвечающих стадийной схеме P=S-J=8, где S — число стадий, J-число промежуточных веществ на поверхности. Поскольку P=rank(A), то в стадийной схеме пустые маршруты отсутствуют.
Скорость по маршрутам I-VIII (r i ) связана с наблюдаемыми значениями скоростей накопления отдельных стадий [6]:
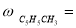
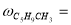
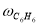
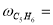
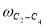
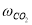
По результатам экспериментальных данных (табл.1 и 2), были рассчитаны значения констант скоростей превращения индивидуальных мономеров МЦПЕ для каждой температуры.
Таблица 1
Скорости накопления ключевых вешеств реакции окислительного дегидрирования 1-метилциклопентена.
|
Pi 0 , k П a |
ω i , l/l кат .час |
|||||||||||||||||||||||
|
P 0 -C 5 H 7 CH 3 |
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
T=623K |
||||||||||||||||||||||||
|
12,7 |
4,7 |
3,94 |
0,56 |
1,49 |
0,064 |
0,15 |
0,12 |
0,72 |
0,98 |
1,09 |
||||||||||||||
|
13,8 |
3,4 |
5,11 |
0,81 |
1,92 |
0,128 |
0,11 |
0,16 |
0,68 |
0,94 |
1,10 |
||||||||||||||
|
14,4 |
2,7 |
5,85 |
0,84 |
2,28 |
0,192 |
0,04 |
0,17 |
0,65 |
0,87 |
1,40 |
||||||||||||||
|
15,5 |
1,5 |
6,47 |
0,88 |
2,39 |
0,255 |
0,02 |
0,23 |
0,64 |
0,80 |
1,70 |
||||||||||||||
|
T=653K |
||||||||||||||||||||||||
|
12,7 |
4,7 |
5,28 |
1,63 |
1,65 |
0,052 |
0,23 |
0,14 |
0,64 |
1,03 |
1,15 |
||||||||||||||
|
13,8 |
3,4 |
6,45 |
2,20 |
2,12 |
0,096 |
0,21 |
0,19 |
0,64 |
0,99 |
1,44 |
||||||||||||||
|
14,4 |
2,7 |
6,53 |
2,49 |
2,47 |
0,213 |
0,13 |
0,21 |
0,47 |
0,89 |
1,49 |
||||||||||||||
|
15,5 |
1,5 |
8,43 |
3,45 |
2,57 |
0,340 |
0,09 |
0,26 |
0,43 |
0,85 |
1,87 |
||||||||||||||
|
T=673K |
||||||||||||||||||||||||
|
12,7 |
4,7 |
6,56 |
2,35 |
1,97 |
0,096 |
0,29 |
0,15 |
0,72 |
1,29 |
1,24 |
||||||||||||||
|
13,8 |
3,4 |
7,76 |
3,10 |
2,16 |
0,192 |
0,26 |
0,24 |
0,63 |
1,25 |
1,50 |
||||||||||||||
|
14,4 |
2,7 |
8,00 |
4,04 |
2,34 |
0,426 |
0,17 |
0,30 |
0,49 |
1,15 |
1,51 |
||||||||||||||
|
15,5 |
1,5 |
10,26 |
6,13 |
2,60 |
0,596 |
0,09 |
0,34 |
0,47 |
1,15 |
1,92 |
||||||||||||||
|
T=703K |
||||||||||||||||||||||||
|
12,7 |
4,7 |
6,72 |
2,61 |
2,18 |
0,085 |
0,30 |
0,15 |
0,73 |
1,37 |
1,36 |
||||||||||||||
|
13,8 |
3,4 |
9,01 |
3,37 |
2,62 |
0,176 |
0,29 |
0,24 |
0,72 |
1,34 |
1,62 |
||||||||||||||
|
14,4 |
2,7 |
0,74 |
4,47 |
2,77 |
0,400 |
0,23 |
0,32 |
0,64 |
1,32 |
1,64 |
||||||||||||||
|
15,5 |
1,5 |
14,81 |
7,53 |
4,17 |
0,596 |
0,21 |
0,47 |
0,64 |
1,15 |
2,13 |
||||||||||||||
|
T=723K |
||||||||||||||||||||||||
|
12,7 |
4,7 |
6,92 |
2,73 |
2,45 |
0,075 |
0,34 |
0,17 |
0,85 |
1,40 |
1,38 |
||||||||||||||
|
13,8 |
3,4 |
9,79 |
3,93 |
3,55 |
0,160 |
0,32 |
0,24 |
0,80 |
1,34 |
1,72 |
||||||||||||||
|
14,4 |
2,7 |
10,60 |
4,49 |
3,75 |
0,360 |
0,30 |
0,30 |
0,66 |
1,33 |
1,68 |
||||||||||||||
|
15,5 |
1,5 |
18,98 |
8,90 |
6,34 |
0,550 |
0,26 |
0,47 |
0,65 |
1,19 |
2,34 |
||||||||||||||
Таблица 2
Скорости накопления ключевых веществ реакции окислительного дегидрирования 3-метилциклопентена.
|
Pi 0 , k П a |
ω i , l / l кат .час |
|||||||||||||
|
P 0 -C 5 H 7 CH 3 |
P 0 О 2 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
T=623K |
||||||||||||||
|
11,01 |
6,97 |
3,23 |
1,86 |
0,600 |
0,0038 |
0,067 |
0,145 |
0,158 |
0,42 |
1,49 |
||||
|
12,70 |
4,73 |
5,69 |
3,66 |
0,854 |
0,0074 |
0,100 |
0,227 |
0,270 |
0,68 |
0,75 |
||||
|
13,80 |
3,45 |
8,69 |
6,32 |
0,901 |
0,0117 |
0,093 |
0,340 |
0,305 |
0,92 |
0,96 |
||||
|
14,54 |
2,78 |
11,90 |
9,93 |
0,653 |
0,0162 |
0,082 |
0,392 |
0,326 |
1,14 |
0,88 |
||||
|
T=653K |
||||||||||||||
|
11,01 |
6,97 |
3,34 |
1,79 |
0,695 |
0,0070 |
0,089 |
0,158 |
0,158 |
0,51 |
0,55 |
||||
|
12,70 |
4,73 |
5,90 |
3,52 |
1,095 |
0,0147 |
0,116 |
0,263 |
0,253 |
0,74 |
0,78 |
||||
|
13,80 |
3,45 |
9,04 |
6,21 |
1,201 |
0,0474 |
0,117 |
0,395 |
0,332 |
0,98 |
1,03 |
||||
|
14,54 |
2,78 |
12,34 |
8,97 |
1,200 |
0,0990 |
0,099 |
0,400 |
0,421 |
1,20 |
1,10 |
||||
|
T=673K |
||||||||||||||
|
11,01 |
6,97 |
3,60 |
1,68 |
0,840 |
0,0076 |
0,114 |
0,209 |
0,177 |
0,62 |
0,68 |
||||
|
12,70 |
4,73 |
6,25 |
3,45 |
1,327 |
0,0147 |
0,158 |
0,347 |
0,284 |
0,84 |
0,88 |
||||
|
13,80 |
3,45 |
9,48 |
5,99 |
1,691 |
0,0711 |
0,158 |
0,443 |
0,395 |
1,07 |
1,15 |
||||
|
14,54 |
2,78 |
12,97 |
8,93 |
1,663 |
0,1642 |
0,131 |
0,506 |
0,526 |
1,20 |
1,18 |
||||
|
T=703K |
||||||||||||||
|
11,01 |
6,97 |
3,93 |
1,62 |
0,941 |
0,0152 |
0,126 |
0234 |
0,202 |
0,80 |
0,97 |
||||
|
12,70 |
4,73 |
6,88 |
3,39 |
1,663 |
0,0432 |
0,190 |
0,390 |
0,347 |
1,00 |
1,11 |
||||
|
13,80 |
3,45 |
10,38 |
5,89 |
2,276 |
0,1059 |
0,188 |
0,522 |
0,443 |
1,30 |
1,36 |
||||
|
14,54 |
2,78 |
13,75 |
8,59 |
2,211 |
0,2127 |
0,164 |
0,632 |
0,548 |
1,56 |
1,60 |
||||
|
T=723K |
||||||||||||||
|
11,01 |
6,97 |
4,25 |
1,54 |
1,074 |
0,0152 |
0,145 |
0,246 |
0,221 |
0,87 |
1,35 |
||||
|
12,70 |
4,73 |
7,16 |
3,24 |
1,864 |
0,0432 |
0,232 |
0,442 |
0,400 |
1,15 |
1,32 |
||||
|
13,80 |
3,45 |
10,94 |
5,91 |
2,686 |
0,1296 |
0,237 |
0,621 |
0,490 |
1,44 |
1,45 |
||||
|
14,54 |
2,78 |
14,21 |
8,32 |
2,758 |
0,2464 |
0,232 |
0,695 |
0,596 |
1,75 |
1,60 |
||||
Представив зависимость константы скорости реакции от температуры в виде уравнения Аррениуса.
k i =k oi ·exp(-E/RT),
где k i -константа скорости (л·час -1 ·л
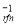
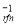
Таблица 3
Кинетические параметры реакции
|
Константа скорости,к i ,
л·час
-1
л
|
Температура, K |
Энергия активации, Е i кдж. моль 1 |
Предэкспоненциальный множитель,
k
oi
л.час
-1
·л
|
||||
|
623 |
653 |
673 |
703 |
723 |
|||
|
для 1- метилциклопентена |
|||||||
|
К 1 |
0,0427 |
0,081 |
0,1234 |
0,219 |
0,2979 |
72896,1 |
5,61.10 4 |
|
К 2 |
0,0069 |
0,01344 |
0,02005 |
0,0351 |
0,0498 |
73471,6 |
1,034.10 4 |
|
К 3 |
0,3607 |
0,624 |
0,875 |
1,403 |
1,88 |
61722,7 |
5,51.10 4 |
|
К 4 |
0,118 |
0,15 |
0,174 |
0,214 |
0,243 |
26765,1 |
0,021.10 2 |
|
К 5 |
0,744 |
0,976 |
1,155 |
1,46 |
1,69 |
30668,1 |
0,28.10 3 |
|
К 6 =к 7 =к 8 |
0,000173 |
0,000499 |
0,000958 |
0,002378 |
0,00418 |
119027,2 |
1,72.10 6 |
|
для 3-метилциклопентена |
|||||||
|
К 1 |
0,0304 |
0,0497 |
0,0673 |
0,103 |
0,133 |
55211,5 |
1,32.10 3 |
|
К 2 |
0,00215 |
0,0045 |
0,0071 |
0,0134 |
0,0201 |
83254,7 |
2,11.10 4 |
|
К 3 |
0,637 |
0,91 |
1,13 |
1,535 |
1,855 |
39977,5 |
1,45.10 3 |
|
К 4 |
0,00195 |
0,0027 |
0,0033 |
0,00445 |
0,0053 |
37598,2 |
0,028.10 2 |
|
К 5 |
0,0103 |
0,0149 |
0,019 |
0,026 |
0,032 |
42257,3 |
0,364.10 2 |
|
К 6 =к 7 =к 8 |
0,004 |
0,0095 |
0,0162 |
0,034 |
0,0537 |
96714,1 |
5,36.10 5 |
Кинетическая модель, составленная на основе принятого механизма при найденных значениях констант скорости, хорошо описывает процесс.
Адекватность модели проверяли на ПК путем минимизации суммы квадратов разности экспериментальных и расчетных величин [7].
Результаты расчета на ПК показали хорошую сходимость экспериментальных и расчетнчых данных. Росхаждения по исходному и конечному продуктам не превышали 5–7 %. Это дает основание говорить что разработанная кинетическая модель реакции окислительного дегидрирования изомеров метилциклопентена адекватно описывает экспериментальные данные и ее можно использовать при моделировании и оптимизации адиабатического реактора.
Выводы
Осуществлена реакция окислительного дегидрирования изомеров метилциклопентена.
Разработана кинетическая модель реакции окислительного дегидрирования изомеров метилциклопентена. Определены порядки, энергии активации и константы скоростей отдельных стадий.
Литература:
- Пальчиков В. А. Морфолины, синтез и биологическая активность. Ж Ор Х..2013., т.49, вып.6, с.807–831.
- Алимарданов Х. М. Ионно-радикальное превращение пяти-и шести членных алициклических углеводородов на цеолитных катализаторах. Процессы нефтехимии и нефтепереработки, 2007, № 1, с.6–32
- Алимарданов Х. М., Сулейманова Э. Т. Химия природных и синтетических душистых веществ. Баку-Элм, 2018, 520с.
- Слинько М. Г. Основы и принципы математического моделирования каталитических процессов. Новосибирск: ИК СО РАН, 2004.
- Абилов А. Г., Велиева Ф. М, Алиев Ф. Т. Пакет прикладных программ. Оценка кинетических параметров многомаршрутных стационарных каталитических реакции. ГОСФАП СССР, 1987 Рег.№ 50880300906
- Психа, Борис Львович. Кинетическое моделирование процессов цепного окисления углеводородов в жидкой фазе. Автореферат докторский диссертации. 2006.
- Кетков Ю.Л, Кетков А. Ю, Шульц М. М. Матлаб 6-программирование численных методов. Санкт-Петербург, 2004. 662 с.