Рассматривается способ совершенствования процесса термического крекинга 1,2-дихлорэтана для получения винилхлорида с использованием инициатора для повышения качества винилхлорида.
Ключевые слова: винилхлорид, 1,2-дихлорэтан, крекинг, инициатор.
Винилхлорид является одним из наиболее распространенных продуктов хлорорганического синтеза. До 98 % всего выпускаемого хлористого винила направляется на получение поливинилхлорида, широко используемого для производства труб для газо- и водопроводов, кабельного пластика, герметизирующих пленок, упаковочных материалов и др. Также процесс получения винилхлорида характеризуется высоким хлоропотреблением, то есть решается проблема утилизации хлора, как побочного продукта при получении каустической соды [1, с. 6–7].
Основным промышленным способом получения винилхлорида является термический крекинг 1,2-дихлорэтана. Данный процесс протекает непрерывно в трубчатых печах змеевикового типа при высоких температурах (350–520 ![]() С) и давлении
С) и давлении ![]() 1 МПа. Конверсия 1,2-дихлорэтана за один проход составляет 50–55 % [2, c. 2801].
1 МПа. Конверсия 1,2-дихлорэтана за один проход составляет 50–55 % [2, c. 2801].
Основная химическая реакция:
Сl−СН2−СН2−Сl СН2=СН−Сl + НСl, ΔH = 73 кДж/моль
Высокая температура процесса, превышающая 500 ![]() С является основным недостатком термического крекинга, так как она способствует ускорению побочных реакций с образованием большого числа побочных продуктов.
С является основным недостатком термического крекинга, так как она способствует ускорению побочных реакций с образованием большого числа побочных продуктов.
Например, возможен процесс дальнейшей деструкции уже образовавшегося винилхлорида с образованием ацетилена [1, c. 478–479]:
СН2=СН−Сl НС≡СН + HCl
Образующийся ацетилен легко вступает в дальнейшие превращения, образуя ряд побочных продуктов — винилацетилен, бензол, хлоропрен:
2 НС≡СН НС≡С−СН=СН2
3 НС≡СН С6Н6
НС≡СН + СН2=СН−Сl СН2=СН−СCl=СН2
При взаимодействии винилхлорида и этилена, образуется 1,3-бутадиен:
СН2=СН2 + СН2=СН−Сl СН2=СН−СН=СН2 + HCl
В винилхлориде крайне нежелательно присутствие таких примесей как ацетилен, винилацетилен, 1,3-бутадиен, хлоропрен, винилиденхлорид, этилхлорид, поскольку они являются сильнейшими ингибиторами полимеризации, а также загрязняют целевой продукт.
Таким образом, селективность процесса пиролиза дихлорэтана зависит в первую очередь от температуры.
На сегодняшний день имеется достаточно много разработок по снижению температуры пиролиза при сохранении высокой скорости процесса, а, следовательно, и конверсии 1,2-ДХЭ. Можно выделить три основных направления интенсификации: применение инициирующих добавок, каталитических систем и физическое инициирование процесса.
Основной и наиболее перспективный путь развития — применение инициаторов — веществ, способных возбуждать радикально-цепной механизм дегидрохлорирования, что позволяет снизить температуру крекинга за счет уменьшения времени реакции и уменьшить образование побочных продуктов. В качестве инициирующих добавок можно использовать: хлор, тетрахлорид углерода, хлористый водород, кислород и др.
На основании патентного анализа было предложено применение хлористого водорода в концентрации 500 ppm в качестве инициатора крекинга 1,2-дихлорэтана [3].
Выбор данного соединения в качестве инициатора обусловлен следующими факторами: хлористый водород является легкодоступным веществом; в результате гомолитического расщепления хлористого водорода образуются радикалы хлора, являющиеся наиболее предпочтительными инициаторами в данном процессе; хлористый водород хорошо растворим в дихлорэтане (около 15000 ppm масс.); для инициирования процесса нужны небольшие концентрации (50–1000 ppm масс).
Предложено растворять инициатор в 1,2-дихлорэтане на стадии подготовки сырья в инжекционном смесителе в сочетании с винтовой вставкой для увеличения поверхности контакта и более равномерного распределения газа в объеме жидкости.
Конструкция смесителя представлена на рис. 1.
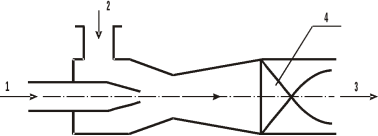
Рис. 1. Инжекционный смеситель с винтовой вставкой [4, с. 141]: 1, 2 — входы компонентов; 3 — выход смеси; 4 — винтовая вставка
Нами проведено экспериментальное изучение крекинга 1,2-ДХЭ в присутствии инициатора — хлористого водорода и показана возможность снижения температуры крекинга на выходе из печи, а также в ходе расчета материального баланса установлено, что происходит сокращение выхода побочных продуктов при увеличении конверсии и селективности.
В таблице 1 приведено сравнение существующего и предлагаемого способов.
Таблица 1
Сравнение параметров способа промышленного аналога ипредлагаемого способа получения целевого продукта
|
Параметр процесса |
Способ производства аналога |
Предлагаемый способ |
|
Температура на выходе из реактора, °С |
505–520 |
480–485 |
|
Давление, МПа |
0,8–1 |
0,8–1 |
|
Наличие инициатора |
- |
Хлористый водород |
|
Фазовое состояние системы |
Газ |
Газ |
|
Конверсия, % |
55 |
66 |
|
Селективность, % |
98 |
99,95 |
|
Количество побочных продуктов, % масс. Хлорметил 1,3-бутадиен Этилхлорид 1,1,2-трихлорэтан 1,1,2,2-тетрахлорэтан Хлоропрен |
0,01 0,0073 0,026 0,046 0,0067 0,03 |
0,0009 0,0002 0,0003 0,012 0,0003 0,02 |
Литература:
- Флид, М. Р. Винилхлорид: химия и технология / М. Р. Флид, Ю. А. Трегер. — Москва: Калвис, 2008. — 584 с. — Текст: непосредственный.
- Schirmeister R. Influence of EDC Cracking Severity on the Marginal Costs of Vinyl Chloride Production / R. Schirmeister, J. Kahsnitz, M. Trager. — Текст: непосредственный // Industrial & Engineering Chemistry Research. — 2009. — № 6. — P. 2801–2809.
- Пат. 2256642 РФ, МПК C 07 C 17/25; C 07 C 21/06. Способ получения винилхлорида / О. Н. Митрофанова, А. В. Селезнев, Р. Г. Мубараков. — Заявл. 10.12.2003; опубл. 10.07.2005.
- Гельперин Н. И. Основные процессы и аппараты химической технологии / Н. И. Гальперин. — Москва: Химия, 1981. — 812 с. — Текст: непосредственный.

