В статье исследуются ММВ в нефтехимических системах, в том числе в процессах аминовой очистки технологических, попутных и природных газов от кислых примесей, в первую очередь от сероводорода. Изучен механизм взаимодействия аминов с сероводородом, механизм образования молекулярных и ионных комплексов, выявлена природа межмолекулярного взаимодействия, исследовано влияние среды на путь протекания реакции, а также установлена взаимосвязь ″структура — свойство″ между аминами и их способностью поглощать сероводород.
Ключевые слова: амины, структура молекулярных комплексов, IPCM, кислотно-основное взаимодействие, сероводород, молекулярный комплекс, RHF.
Кислотно-основное взаимодействие алканоламинов с сероводородом и диоксидом углерода широко используется в промышленности в процессах очистка технологических, попутных и природных газов [1]. В последние годы появились публикации, в которых приводятся сведения о связывании сероводорода в дизельных топливах и бензинах за счет образования комплексов с аминами. Важную роль играют подобные реакции в процессах метаболизма и жизнедеятельности некоторых бактерий [2]. Экспериментальные исследования, в которых используется сероводород, достаточно сложны, ‒ особенно при необходимости фиксации промежуточных лабильных состояний, комплексов с водородной связью, ионных комплексов и др.
С другой стороны, в связи с возможностью доэкспериментального анализа химических превращений на уровне элементарных стадий квантовохимическими расчетами [2–3] последние приобретают все большее значение. Необходимо отметить, что такие подходы стали возможны в связи с повышением достоверности расчетных методов, наличия пакетов программ и компьютеров, обеспечивающих возможность расчета полимолекулярных систем. В результате формируются новые представления, уточняются механизмы, термодинамические и кинетические параметры, влияние среды на комплексообразование, вскрываются особенности связи структуры реагентов с активностью, что предопределяет возможность совершенствования технологических процессов извлечения сероводорода и диоксида углерода.
В работе суммированы опубликованные данные о результатах квантовохимических расчетов взаимодействия наиболее широко используемых в промышленности аминах с сероводородом и диоксидом углерода.
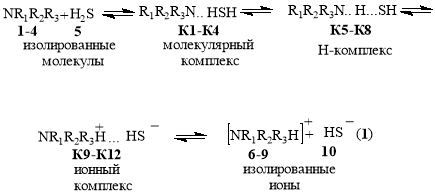
В основе кислотно-основного взаимодействия алканоламинов NR1R2R3 (1–4) с сероводородом (5) лежит реакция передачи протона [1–2]:
NR1R2R3 +H2S ↔ [NR1R2R3]+ +HS⁻
1–4 5 6–9 10
изолированные изолированные
молекулы ионы
|
R1 = R2 = Н,R3 = С2H4ОН |
(МЭА) |
|
R1 = H, R2 = R3 = С2H4ОН |
(ДЭА) |
|
R1 = CH3, R2 = R3 = С2H4ОН |
(МДЭА) |
|
R1 = R2 = R3 = С2H4ОН |
(ТЭА) |
Реакция протекает через образование промежуточных комплексов (молекулярных К1-К4, водородных К5-К8, ионных К9-К12)иприводит к изолированным ионам 6–10:
|
1, |
К1, |
К5, |
К9, |
6 |
R1 = R2 = Н,R3 = С2H4ОН |
(МЭА) |
|
2, |
К2, |
К6, |
К10, |
7 |
R1 = H, R2 = R3 = С2H4ОН |
(ДЭА) |
|
3, |
К3, |
К7, |
К11, |
8 |
R1 = CH3, R2 = R3 = С2H4ОН |
(МДЭА) |
|
4, |
К4, |
К8, |
К12, |
9 |
R1 = R2 = R3 = С2H4ОН |
(ТЭА) |
В газовой фазе комплексы К5-К8 не образуются; реакция 1 останавливается на этапе формирования комплексов К1-K4 [4] (табл. 1).
Некоторые параметры молекулярных комплексов К1-K4 представлены в таблице 1.
Таблица 1
Значения рассчитанной энергии межмолекулярных взаимодействий (Евз, кДж/моль) вкомплексах К1-К4 иэкспериментальных величин констант скорости взаимодействия молекул 1–4 смолекулой 5 (k, л/(моль·с)) изначений теплоты реакции (Δp, кДж/моль)
|
№ |
Метод Амин |
Расчет, Евз |
Эксперимент | ||||
|
RHF/ 3–21G |
RHF/6–31G(d,p) |
В3LYP/6–31G(d,p) |
MP2/6–31G(d,p) |
k |
Δp | ||
|
1 |
NH2С2H4ОН (1) |
-29,3 |
-14,7 |
-26,0 |
-23,0 |
275 |
-51,2 |
|
2 |
NH(С2H4ОН)2 (2) |
-28,1 |
-14,1 |
-27,8 |
-25,1 |
92 |
-39,0 |
|
3 |
N(СH3)(С2H4ОН)2 (3) |
-25,7 |
-9,6 |
-30,9 |
-27,8 |
26 |
-35,6 |
|
4 |
N(С2H4ОН)3 (4) |
-21,1 |
-4,6 |
-34,2 |
-31,5 |
5,6 |
-31,6 |
Сравнение значений энергии межмолекулярных взаимодействий в комплексах К1-К4 показывает, что расчетные данные довольно значительно отличаются от экспериментальных Δp что, по-видимому, обуславливается определением величин k и Δp для условий жидкой фазы [7,8]. Таким образом, возникает необходимость учета влияния растворителя.
В присутствии растворителя, молекул воды, взаимодействие алканоламинов 1–4 с сероводородом происходит как реакция между комплексами. По аналогии с уравнением 1 это взаимодействие можно описать следующим образом:
R1R2R3N∙(H2O)n+H2S∙(H2O)m![]() R1R2R3N∙(H2O)n∙∙∙ H2S∙(H2O)m
R1R2R3N∙(H2O)n∙∙∙ H2S∙(H2O)m![]() (R1R2R3N∙∙∙ H2S)∙ (H2O)n+m
(R1R2R3N∙∙∙ H2S)∙ (H2O)n+m ![]()
K 11–14 K 15 K 16–19 K 20–23
(R1R2R3N∙∙∙H∙∙∙SH)∙(H2O)n+m![]() (R1R2R3NH⁺∙∙∙SH⁻)∙(H2O)n+m
(R1R2R3NH⁺∙∙∙SH⁻)∙(H2O)n+m![]() (R1R2R3NH⁺)∙(H2O)x+(SH⁻)∙(H2O)y
(R1R2R3NH⁺)∙(H2O)x+(SH⁻)∙(H2O)y
K 24–27 K 28–30 K 31–33 K 34
Построенная поверхность потенциальной энергии взаимодействий в системе «амин— Н2S— H2O» [4] показывает, что Н-комплексы (К24-К27) представляют собой переходное состояние, между молекулярными (К20-К23), и ионными (К28-К30) состояниями (рис. 1) [5–6]. Геометрические характеристики комплексов, в частности, расстояние между атомами азота и водорода, (молекулярные r (N…H) = 1,85 ÷ 2,45 Å, Н-комплексы r (N…H) = 1,30 ÷ 1,50 Å, ионные r (N…H) = 1,05 ÷ 1,10 Å), позволяют считать, что переходное состояние (Н-комплексы) по характеристикам значительно отличается, как от молекулярных, так ионных комплексов.
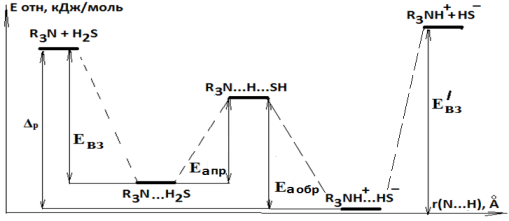
Рис.1. Поверхность потенциальной энергии взаимодействия алканоламинов 1–4 с Н2S в водной фазе (IPCM) (сольватация не указана)
Переход от молекулярных комплексов К20-К23 к ионным К28-К30 является элементарной стадией (уравнение 2). На этой стадии энергию активации перехода от молекулярных к ионным комплексам можно считать энергией абсорбции, а энергию активации перехода от ионных комплексов к молекулярным — десорбции. Судя по полученным данным абсорбция Eапр составляет 17,5 ÷ 19,9 кДж/моль, а высота барьера десорбции Eаобр ― 16,3 ÷ 17,0 кДж/моль. Таким образом, можно считать, что в водном растворе комплексы К20-К23 и К28-К30 будут присутствовать в сравнимых концентрациях и переход между ними осуществляется сравнительно легко [9–10].
Алканоламины 1- 4 по увеличению значения Eaпр располагаются в ряд:
1 < 2 < 3 ≈ 4,
что в целом соответствует снижению констант скоростей абсорбции k:
1 > 2 > 3 > 4.
При реализации технологической схемы (рис. 2) в абсорбере происходит взаимодействие предварительно сформированных комплексов алканоламинов (К11-К14) и сероводорода (К15) с водой.
Адсорбция Десорбция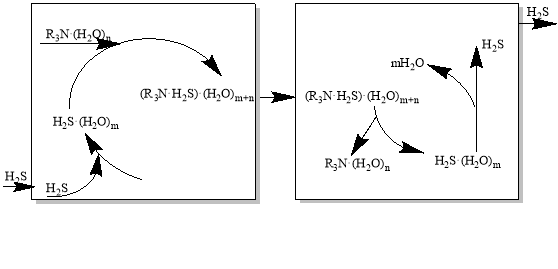
Рис.2. Взаимодействие комплексов алканоламинов (К11-К14) и сероводорода (К15) с водой
Соотношение между Еапр и Eаобр будет определять сдвиг равновесия между молекулярными К16-К19 и ионными комплексами К28-К30. Интересно отметить, что этот показатель антибатен количеству аминых групп в молекуле растворителя:
МЭА: ДЭА: МДЭА: ТЭА ↔ -0,5: -2,0: -3,3: -3,5.
Десорбция — вторая стадия процесса (рис. 2), может быть энергетически оценена по разности между энергиями ионных и молекулярных комплексов растворителей и сероводорода, что вычисляется как сумма Евз с разностью энергий ионных К28-К30 имолекулярных комплексов К11-К14:
МЭА: ДЭА: МДЭА: ТЭА ↔ 13,0: 15,4: 17,2: 16,5.
В ряду от МЭА к ТЭА снижается рассчитанное значение Δpр, что соответствует данным эксперимента. Однако значения Δpр занижены по абсолютной величине в 3,3–4,5 раза (табл. 2). Можно предположить, что это связано с более сложным составом комплекса, в частности с образованием комплекса, включающего большее количество молекул воды.
Таблица 2
Рассчитанные энергетические параметры взаимодействия аминов cH2S вводной фазе, (Eвз, Eвз', Eапр, Eаобр, Δpр, кДж/моль) иэкспериментальные величины константы скорости взаимодействия NR3 сH2S (k, л/моль·с), итеплоты реакции (ΔpЭ, кДж/моль)
|
№ |
Амин |
IPCM, MP2/6–31G(d,p) |
Эксперимент | |||||
|
Eвз |
Eвз' |
Eапр |
Eаобр |
Δpр |
k |
ΔpЭ | ||
|
1 |
МЭА |
-12,5 |
-12,0 |
17,5 |
17,0 |
-12,0 |
275 |
-51,2 |
|
2 |
ДЭА |
-13,4 |
-11,4 |
18,3 |
16,3 |
-11,4 |
92 |
-39,0 |
|
3 |
МДЭА |
-13,9 |
-10,6 |
19,6 |
16,3 |
-10,6 |
26 |
-35,6 |
|
4 |
ТЭА |
-13,0 |
-9,5 |
19,9 |
16,4 |
-9,5 |
5,6 |
-31,6 |
Таким образом, с использованием IPCM подхода моделирование взаимодействий, лежащих в основе процесса поглощения сероводорода алканоламинами показано, для системы «алканоламин — сероводород — вода» возможность осуществления молекулярного и ионного механизмов взаимодействия с вероятностью их совместной реализации.
Судя по полученным данным, ДЭА, который обладает достаточно высокой способностью к образованию комплекса и легко регенерируется, может представлять наибольший интерес с позиции выбора реагента для извлечения сероводорода. Действительно, ДЭА широко используется в промышленности. МЭА как реагент, характеризуется высокой поглотительной способностью, однако, для его регенерации требуются более высокие затраты энергии. Для абсорбции сероводорода в промышленности достаточно широко используется МДЭА, что связано с меньшей коррозионной активностью этого реагента по сравнению с другими алканоламинами. С другой стороны, имеются разработки по использованию МЭА и ДЭА в виде содержащих ингибитор коррозии растворов повышенной концентрации (4–5 н). В связи с этим интерес к МЭА и ДЭА, как к более эффективным поглотителям, остается достаточно высоким.
Литература:
- Аджиев А. Ю., Пуртов П. А. — Краснодар: ЭДВИ, 2014. — 508 с.
- Токарь М. С., Артемьева Е. Л., Просочкина Т. Р., Кантор Е. А. Исследование структурных и энергетических характеристик молекулярного комплекса NH3·H2S. / Токарь М. С., // Башкирский химический журнал. — 2003. — т. 10. — № 1. — с. 81–82.
- Токарь М. С., Просочкина Т. Р., Кантор Е. А., Мингажева Г. В. Исследование зависимости основных параметров молекулярных комплексов типа аммиак-сероводород от природы заместителя. // Башкирский химический журнал. — 2004. — т. 11. — № 1. — с. 71–72.
- Токарь М. С., Просочкина Т. Р., Кантор Е. А., Мингажева Г. В. Изучение взаимодействия некоторых аминов с H2S методами квантовой химии. // Башкирский химический журнал. — 2005. — т. 12. — № 1. — с. 78–79.
- Токарь М. С., Ласточкин В. В., Просочкина Т. Р., Кантор Е. А. Геометрические и энергетические параметры молекулярного комплекса НОСН2NH2H2S. // Материалы IV Всероссийской научной Internet-конференции «Компьютерное и математическое моделирование в естественных и технических науках». Издательство «Тамбовского государственного университета им. Г. Р. Державина». — Тамбов. — апрель-май 2002г. — с.52.
- Токарь М. С. Геометрические и энергетические параметры молекулярного комплекса НОСН2NH2H2S. / Токарь М. С., Ласточкин В. В., Просочкина Т. Р., Кантор Е. А. // Материалы IV Всероссийской научной Internet-конференции «Компьютерное и математическое моделирование в естественных и технических науках». Издательство «Тамбовского государственного университета им. Г. Р. Державина». — Тамбов. — апрель-май 2002г. — с.52.
- Кичатов К. Г., Шестакова Р. Г., Просочкина Т. Р., Кантор Е. А. Оценка адекватности квантово-химических методов расчета азотсодержащих гетероциклических соединений данным РСА.//Башкирский химический журнал.2010.Т.17 № 1.С.23–27.
- Просочкина Т.Р, Кантор Е. А. Квантово-химические расчеты молекул (пакет программ “Hyperchem”) Уфимский государственный университет. Уфа,2003. 100с.
- Токарь М. С. Геометрические и энергетические параметры молекулярного комплекса H2S∙NH(С2Н5ОН)2. / Токарь М. С., Просочкина Т. Р., Кантор Е. А., Тарасов Д. А. // Материалы конференции «Информационно-вычислительные технологии в решении фундаментальных научных проблем и прикладных задач химии, биологии, фармацевтики и медицины». Секция 2. Москва 2003.– с.12. http://www.ivtn.ru/2-session/enter/

