Для фотометрического определения редкоземельных элементов применяются органические реагенты различных классов [1–5]. Среди этих реагентов весьма перспективными являются реагенты, содержащие в составе диазогруппы [6, 7].
Из литературы известно, что в условиях образования ассоциатов катионно-поверхностно-активных веществ (КПАВ) с кислотно-хромофорными реагентами уменьшается степень протонизации реагентов и поэтому расширяется интервал взаимодействия таких реагентов с металлами со смещением в более кислую среду [8–11].
Поэтому в данной работе исследовано взаимодействие самария с 3-(2-гидрокси-3-сульфо-5-(хлорфенилгидразо) пентан-2,4-дионом в присутствии и в отсутствии КПАВ (хлорид цетилпиридиния ЦПСl, бромид цетилпиридиния ЦПBr, бромид цетилтриметиламмония ЦТАBr).
Экспериментальная часть
3-(2-гидрокси-3-сульфо-5-(хлорфенилазо) пентадион-2,4 (R) синтезировали ранее [12] азосочетанием диазитированного 2-амино-3-сульфо-5-хлорфенола-1 с ацетилацетоном в слабощелочной среде по методике [13] и установили его состав и строение. Использовали 1∙10–1 М водные растворы R, хлорида и бромида цетилпиридиния, бромид цетилтриметиламмония. 1∙10–1 М раствор самария (III) готовили растворением навески Sm(NO3)3∙6H2O солью в воде по методике [14]. Для создания необходимых значений рН использовали фиксонал HCl (рН 1–2) и аммиачно-ацетатные буферные растворы (рН 3–11). Кислотность растворов контролировали на иономере И-130 со стеклянным электродом ЭСЛ-43–07, настроенный по стандартным буферным растворомю оптическую плотность растворов измеряли на спектрофотометре LAMBDA-40 (Perkin Elmer) и фотоколориметре КФК-2МП в кювете с толщиной слоя 1 см. Удельную электропроводность растворов измеряли на кондуктометре Mettler Toledo.
Результаты иих обсуждение
Ранее нами было установлено, что водный раствор R при рН 6 имеет полосы поглощения с максимумом при 378 нм. В этих условиях он образует комплекс с самарием (III), который имеет максимум поглощение при 421 нм. Исследование комплекса в присутствии КПАВ в широком интервале рН показало, что в присутствии КПАВ оптимальная среда комплексообразования смещается в кислую область (рис.1). максимумы светопоглощения комплексов наблюдаются при 432 нм (SmR-ЦПCl), 434 нм (SmR-ЦПBr) и 438 нм (SmR-ЦТАBr).
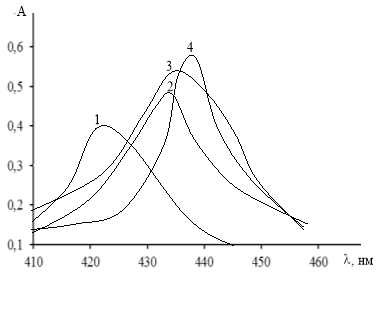
Рис. 1. Спектры поглощения комплексов R с самарием в отсутствие и в присутствии КПАВ. 1 — SmR, 2 — ЦПС1, 3 — SmR-ЦПBr, 4 — SmR-ЦТАBr
Комплексы образуются быстро. Соотношение реагирующих компонентов установлено методами относительного выхода Старика-Барбанеля, сдвига равновесия и изомолярных серий. Молярные коэффициенты поглощения комплексов вычислены из кривых насыщения [15]. Установлены интервалы концентраций, где соблюдается закон Бера (табл.1). из таблицы видно, что смешанолигандные комплексы образуются кислой среде, чем бинарные комплексы самария. Поэтому можно заранее прогнозировать, что в присутствии третьего компонента значительно увеличится избирательность реакций.
Вычислены константы устойчивости однородно- и смешанолигандных комплексов самария(III). Для расчета константы устойчивости комплекса был использован метод пересечения кривых [15]. Согласно расчетам lg1(SmR)=7,260,05; lg1(SmR-ЦПCl)= 9,240,04; lg1(SmR-ЦПBr)=9,410,05; lg1(SmR-ЦТАBr)=9,880,04.
Таблица 1
Основные характеристики реакций комплексов самария(III)
|
Комплекс |
pHопт. |
λmaк, нм |
λ, нм |
·10–3 |
Sm:R |
Интервал подчинения закону Бера, мкг/мл |
|
R |
6 |
421 |
48 |
8,870,01 |
1:2 |
0,30–12,00 |
|
R-ЦПCl |
5 |
432 |
59 |
9,210,02 |
1:2:2 |
0,30–12,00 |
|
R-ЦПBr |
5 |
434 |
61 |
9,490,02 |
1:2:2 |
0,30–12,00 |
|
R-ЦТАBr |
5 |
438 |
65 |
9,980,02 |
1:2:2 |
0,30–12,00 |
Методом кондуктометрического титрования изучены удельные электропроводности исследованных комплексов [16]. Сравнение удельной электропроводности однородно- и смешаннолигандных комплексов самария(III) при рН 6 показывает, что разнолигандные комплексы устойчивее чем бинарные.
Таблица 2
Удельная электропроводность (m10–3 Ом-1см-1) однородно- исмешанодигандного комплекса самария(III)
|
Комплекс |
VR, мл | |||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 | |
|
SmR |
1,10 |
1,10 |
1,00 |
0,95 |
0,91 |
0,87 |
0,86 |
0,84 |
0,83 |
0,88 |
|
SmR-ЦПCl |
1,10 |
1,06 |
0,95 |
0,90 |
0,86 |
0,82 |
0,81 |
0,80 |
0,78 |
0,78 |
|
SmR-ЦПBr |
1,10 |
1,04 |
0,93 |
0,88 |
0,85 |
0,80 |
0,78 |
0,76 |
0,75 |
0,75 |
|
SmR-ЦТАBr |
1,10 |
1,03 |
0,92 |
0,85 |
0,83 |
0,78 |
0,75 |
0,73 |
0,71 |
0,71 |
Изучено влияние посторонних ионов и маскирующих веществ в присутствии и в отсутствии КПАВ (табл.3) и разработана методика определения самария в монаците.
Таблица 3
Допустимые соотношения посторонних веществ ксамарию(III) при его определении однородно (Sm-R) исмешаннолигандных комплексов (погрешность 5%)
|
Ион или вещество |
SmR |
SmR-ЦПCl |
SmR-ЦПBr |
SmR-ЦТАBr |
p-ацетилхлорфосфоназо-ЦПCl [17] |
Арсеназо III [18] |
|
Na(I) |
Не мешает |
Не мешает |
Не мешает |
Не мешает | ||
|
K(I) |
Не мешает |
Не мешает |
Не мешает |
Не мешает |
600 | |
|
Mg(II) |
70 |
212 |
210 |
230 |
100 | |
|
Ca(II) |
115 |
318 |
326 |
337 |
5 | |
|
Ba(II) |
80 |
176 |
170 |
182 |
6 | |
|
Zn(II) |
190 |
513 |
508 |
518 |
100 | |
|
Cd(II) |
315 |
520 |
515 |
527 |
120 | |
|
Mn(II) |
35 |
425 |
420 |
432 |
500 | |
|
Ni(II) |
163 |
453 |
460 |
473 |
1000 | |
|
Co(II) |
163 |
294 |
290 |
296 |
100 | |
|
Cu(II) |
182 |
430 |
422 |
428 |
100 |
мешает |
|
Al(III) |
17 |
224 |
217 |
226 |
100 |
300 |
|
Zr(IV) |
25 |
123 |
125 |
134 |
1 |
мешает |
|
Th(IV) |
3 |
15 |
15 |
23 |
мешает | |
|
V(V) |
40 |
80 |
78 |
85 |
150 | |
|
Mo(VI) |
62 |
253 |
250 |
262 | ||
|
W(VI) |
33 |
430 |
423 |
430 | ||
|
|
25 |
200 |
205 |
212 | ||
|
ЭДТА |
23 |
55 |
53 |
58 |
74 | |
|
Тиомочевина |
223 |
580 |
587 |
595 | ||
|
Лимонная кислота |
45 |
153 |
160 |
168 | ||
|
Na2HPO4∙12H2O |
10 |
62 |
67 |
74 |
мешает | |
|
|
40 |
83 |
80 |
88 |
мешает |
Определение самария вмонаците. 0,1 г образца в чашке из стеклоуглерода растворяют в смеси 3 мл HF + 1 мл HCl + 3 мл HNO3. Полученную пасту обрабатывают 3–4 мл HNO3 при 50–600С до полной отгонки HF. Полученный осадок растворяют в воде, переводят в колбу емк. 100 мл и разбавляют дистиллированной водой до метки. Аликвотную часть полученного раствора помещают в колбу емкостью 25 мл, добавляют 2 мл 1·10–2 М раствора R, 0,5 мл 1·10–3 М раствора ЦТАBr и разбавляют до метки буферным раствором c pH 5. Оптическую плотность растворов измеряют при 490 нм в кювете с ℓ=1 см на KФK-2МП относительно раствора контрольного опыта. При содержании по паспорту 3,79 % Sm найдено 3,740,04 % Sm (n=5; P=0.95).
Литература:
1. Soylak M., Turkoglu O. Spectrophotometric determination of samarium with chrome azurol S in the presence of cetylpyridinium chloride // Talanta, 2000, v.53, № 1, p.125–129
2. Xinzhen D., Jinzhang G., Qun X. Jinwan K. //Simultaneous determination of samarium, europium and terbium with quinaldic acid and phenanthroline by synchronous derivative fluorimetry/ Talanta, 1994, V.41, Issue 2, p.201–204
3. Wei H., Wang W., Liang T. et.al. spectrophotometric determination of lanthanium in molecular sieves with use p-acetylarsenazo // Chin. J. Spectrosc. Lab., 2002, v.19, № 4, p.434–436
4. Yang X., He Q., Wang Y. Studying of color reaction of trivalent europium with a reagent 2-(5-brom-2-pyridilazo)-5-diethylaminophenol and cetyltrimetylammonia // Chin. J. Spectrosc. Lab., 2002, v.19, № 3, p.310–318
5. Wang N., Ren X., Si Z. et.al. Derivative spectrophotometric determination of praseodymium in rare earth mixtures with lomefloxacin // Talanta, 2000, v.51, № 3, p.595–598
6. Гаджиева С. Р., Гусейнов Ф. Э., Чырагов Ф. М. Спектрофотометрическое исследование комплексообразования самария(III) с 2-(2-гидрокси-3-сульфо-5-нитрофенилазо) нафталин-1,8-дигидрокси-3,6-дисульфонатом натрия в присутствии бромида цетилтриметиламмония // Журнал Аналитической Химии. 2005. Т. 60. № 9. С. 924–926.
7. Химия комплексных соединений редкоземельных элементов / Яцимирский К. Б. и др. К., Наукова Думка, 1966. 434 с.
8. Иванов В. М., Мамедова А. М., Ахмедов С. А. Взаимодействие молибдена(VI) с пирогаллоловым красным и бромпирогаллоловым красным в присутствии поверхностно-активных веществ //Вестник Московского Университета. Химия 2003, Т. 44, № 4, с. 253–257
9. Мамедова А. М., Иванов В. М., Ахмедов С. А. Взаимодействие вольфрама(VI) и ванадия(V) с пирогаллоловым красным и бромпирогаллоловым красным в присутствии поверхностно-активных веществ //Вестник Московского Университета. Химия 2004, Т. 45, № 2, с. 117–123
10. Нагиев Х. Д., Чырагов Ф. М., Гюллярли У. А., Гамбаров Д. Г. Фотометриическое определение Zr(IV) с 2,3,4-триоксифенилазо-5'-сульфонафталином в присутствии поверхностно-активных веществ.// Завод. лабор. 2003. Т.69. № 11. с.13–15.
11. Гаджиева С. Р., Гусейнов Ф. Э., Чырагов Ф. М. Изучение цветной реакции эрбия(III) с 2-(2,3-диметил-4-фенилазопирозолон)нафталин-1,8-дигидрокси-3,6-дисульфонатом натрия и хлоридом цетилпиридиния // Журнал аналитической химии, 2006, Т.61, № 12, с.1264–1267
12. Махмудов К. Т. Дис. … канд. xим. наук. Баку: БГУ, 2006, 215 с.
13. Бусев А. И. Синтез новых органических реагентов для неорганического анализа. М.: МГУ, 1972, 245 с.
14. Коростелев П. П. Приготовление растворов для химико-аналитических работ. М.: Металлургия, 1964, 386 с.
15. Булатов М. И., Калинкин И. П. Практическое руководство по фотометри-ческим и спектрофотометрическим методам анализа. Л.: Химия, 1972, 407 с.
16. Худякова Т. А., Крешков А. П. Теория и практика кондуктометрического и хронокондуктометрического анализа. М.: Химия, 1976, 304 с.
17. Hsu C., Li H., Pan J. Spectrophotometric determination of cerium subgroup rare earths in nickel-base alloys in the presence of yttrium with p-acetylchlorophosphonazo and mixed surfactants // Talanta, 1994, v.41, № 8, p.1357–1361
18. Саввин С. Б. Органические реагенты группы арсеназо III. М.: Атомиздат, 1971, 352 с.

