В статье представлены результаты собственного исследования использования сбалансированного по составу препарата ГЭК (гидроксиэтилированного крахмала) - Тетраспана 6 в сравнении с общеизвестными представителями препаратов ГЭК в периоперационной инфузионной терапии (ИТ) гестоза средней и тяжелой степени. Эффективность терапии оценивалась на основании изменения цитокинового профиля от первых к пятым суткам. Оценивалось состояние водных секторов в динамике для определения объема ИТ.
Ключевые слова: гестоз, инфузионная терапия, препараты ГЭК, цитокины, Тетраспан 6, водные сектора.
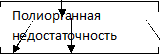
Гестоз – тяжелейшее осложнение беременности, которое занимает лидирующую позицию среди всех причин преждевременных родов, материнской и перинатальной смертности. Учитывая тот факт, что проблеме гестоза уделяется пристальное внимание во всем мире, глобальных изменений в интенсивной терапии за последние 70 лет не произошло, что связано со сложным этиопатогенезом гестоза[1,11]. В первую очередь при гестозе, вследствие декомпенсированной, избыточной выработки провоспалительных цитокинов повреждается эндотелий сосудов, нарушается целостность сосудистой стенки, затем при генерализации циркуляции провоспалительных цитокинов развивается полиорганная недостаточность. В первую очередь нарушаются функции: почек, печени, сердца, головного мозга[11]. Клинически процесс проявляется артериальной гипертензией, как последствие спазма сосудистой стенки, протеинурией, как показатель нарушения функции клубочковой фильтрации и отеками, вследствие повышения проницаемости эндотелия и перехода жидкости из сосудистого русла в интестициальное пространство (см.схема):
- С



 хема
патогенеза полиорганной недостаточности при ССВО
хема
патогенеза полиорганной недостаточности при ССВО
 Повреждающий фактор (эндотоксин,
антитела, травма)
Повреждающий фактор (эндотоксин,
антитела, травма)









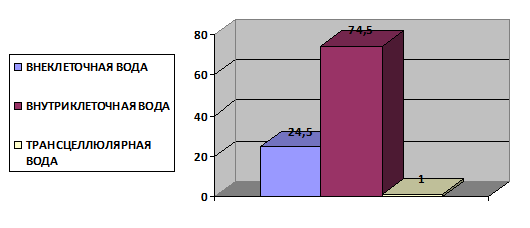
Вода организма образует два водных пространства: внутриклеточное (2/3 общей воды) и внеклеточное (1/3 общей воды). Небольшое количество воды входит в жидкости полостей тела: брюшной, плевральной и т.д., а также в цереброспинальную, внутриглазную, внутрисуставную жидкости [2,7].
1) внутрисосудистый водный сектор, т. е. плазму крови, объем которой составляет около 8 % общей воды организма.
2)
интерстициальный водный сектор, содержащий 1/4 всей воды организма
(15 % массы тела) и являющийся наиболее подвижным, меняющим объем при
избытке или недостатке воды в теле. Включает в себя все жидкие
фракции организма, не заключенные в клеточные мембраны:
плазматическую жидкость и лимфу. В норме объем внеклеточная жидкость
является константой, обеспечиваемой гидромеханическими и
осмотическими компенсаторными механизмами [2]. По данным S.Albert на
циркулирующую жидкость (плазму) приходится 4-5% массы тела, а на
межтканевую жидкость и лимфу - 13-15%.

3) В условиях патологии появляется третье водное пространство - вод полостей тела: брюшной, плевральной и т.д. Третьим жидкостным сектором, очень незначительным у здорового человека, является трансцеллюлярная жидкость. Ее объем составляет 0,5-1% массы тела. При патологических состояниях объем трансцеллюлярной жидкости может существенно возрастать, формируя, так называемое, «третье пространство». Потери жидкости в третье пространство могут достигать значительных масштабов и приводят к тяжелой гиповолемии при отсутствии очевидных внешних потерь жидкости. При гипергидратации, вода по большей части накапливается в интерстициальном водном секторе. Значительная степень гипергидратации проявляется водной интоксикацией. Водная интоксикация может сопровождаться возбуждением нервных центров и появлением мышечных судорог[2,5,7,8].
Детальное изучение механизмов и молекулярных основ системного воспаления при гестозе, расширяет горизонты исследователей для поиска новых вариантов лечения способные воздействовать на звенья патогенеза[9,10,18,19,20].Так как, ключевую роль в патогенезе гестоза играет эндотелиальная дисфункция, при которой жидкость из сосудистого русла переходит в интерстициальное пространство, обуславливая снижение объема циркулирующей крови (ОЦК) и гиповолемию, то для устранения этого состояния основным направлением в лечении гестоза стала инфузионная терапия. Для восполнения ОЦК препаратами выбора остаются растворы ГЭК (гидроксиэтилированного крахмала), способствующие улучшению реологических свойств крови, способные связывать и удерживать воду в сосудистом русле, восполнить внутрисосудистый объем, восстановить поврежденный эндотелия, путем закрытия пор в стенках капилляров молекулами крахмала. Уникальными являются их способность торможения выработки и снижения выброса противовоспалительных цитокинов, ингибирование активации эндотелиоцитов, снижают уровень циркулирующих молекул адгезии, ингибируют выброс фактора Виллебранда из эндотелиоцитов, что было доказано экспериментально и клинически[4,6,19,20]. Как известно, инфузионная терапия не лишена своих недостатков и побочных действий, одним из которых является гипергидратация, что ведет к развитию отека легких и сердечной недостаточности. За последнее время в литературе появились данные об использовании в интенсивной инфузионной терапии нового сбалансированного по электролитному составу раствора ГЭК Тетраспана 6( B Braun®), отличительными преимуществами которого являются:
- сбалансированность по составу, адаптированный к плазме крови, что дает возможность меньшего воздействия на систему гемостаза и функцию тромбоцитов[19,20,21].
-изотоничность и изоионнность раствора, препятствует развитию гипонатриемической энцефалопатии, перемещению жидкости из сосудистого русла в межклеточное, предупреждает развитие отека легких, ионный состав Тетраспана 6 обеспечивает стабильность электролитного баланса и времени свертываемости крови, что обусловлено снижением концентрации кальция в крови[21].
- максимально безопасен для почек, вызывая минимальные изменения уровня специфических почечных белков (глутатионтрансферазы альфа и нейтрофильного желатиназо-ассоциированного липокалина) [19,20].
- благоприятно влияет на системный воспалительный ответ, ограничивая секрецию провоспалительных цитокинов[6,10,14].
Целью нашей работы было оптимизировать инфузионную терапию в периоперационном периоде у родильниц с гестозом средней и тяжелой степени, путем сравнительной оценки особенностей сбалансированного раствора ГЭК Тетраспана 6 и общеизвестных ГЭК на основании определения уровня цитокинов(про- и противо-воспалительных) в сыворотке крови в динамике на фоне инфузионной терапии.
Материалы и методы: Для контроля за объемом проводимой инфузионной терапии и предупреждения гипергидратации мы динамически отслеживали за состоянием водных секторов неинвазивным биоэлектрическим методом ИДИ(интегральной двухчастотной импедансометрией).Уровень цитокинов (ИЛ-1, ИЛ-6, ИЛ-10) в сыворотке крови определяли с помощью набора реагентов «ИНТЕРЛЕЙКИН 1,6,10 – ИФА - Вектор БЕСТ», разработанных в ЗАО «Вектор- БЕСТ» (Новосибирск). Измерения проводили методом сэндвич-варианта твердофазного иммуноферментного анализа с помощью моно - и поликлональных антител согласно рекомендациям производителей. Индикаторным компонентом реакции служил конъюгат пероксидазы хрена со стрептавидином. В качестве стандарта для сравнения в каждой реакции использовались рекомбинантные цитокины, входящие в состав тест - наборов. По данным титрования стандартных образцов строили калибровочные графики для каждого из изучаемых веществ, по которым определяли их уровень в исследуемой сывортке крови в диапазоне детектируемых концентраций от 5 до 250 пг/мл.
Забор крови, в количестве 10-12 мл, проводили из кубитальной вены в стерильный апирогенный шприц на 1-х и 5-х сутках после оперативного родоразрешения. Статистическая обработка проводилась пакетом Microsoft Office Excel 2007. Исследовано 80 родильниц с гестозом: в основной группе n=40, в состав инфузионной терапии входил Тетраспан 6, в группе сравнения n=40 один из растворов ГЭК. В контрольной группе (n=30) родильниц без гестоза инфузионная терапия не включала ГЭК. Обследование проводилось на 1-х и 5-х сутках после оперативного родоразрешения.
Результаты:
Мониторинг водных секторов показал, что в основной группе на 1-х сутках, отмечеается: выраженное увеличение внеклеточной жидкости у 19(47,5%),умеренное увеличение у 16(40%),нормальные значения у 5(12,5%). На 5-х сутках: выраженное -3(7,5%),умеренное-23(57,6%),норма-14(35%). В группе сравнения 1-е сутки: выраженное -19(47,5%),умеренное-15(37,5%),норма-6 (15%), к 5-м суткам: выраженное -7(17,5%),умеренное-22(55%),норма-11(27,5%). Контрольная группа: 1-е сутки: умеренное увеличение внеклеточной жидкости-12(40%),норма-18(60%); 5-е сутки умеренное-5(16,7%),норма-25(83,3%) (см. табл.№)
Таблица 1
|
Изменения показателей водного баланса (увеличение объема внеклеточной жидкости) %% |
|
|
|
|
|
|
|
Выраженное |
|
|
|
|
0 |
0 |
|
Умеренное |
|
|
|
|
|
|
|
Норма |
|
|
|
|
|
|
При анализе маркеров воспаления: на 1 сутках в основной группе: ИЛ1β -121±15,2, ИЛ 6 - 54,3±21,1, ИЛ 10- 61,7±13,6; На 5-е сутки: 114±22,3, ИЛ 6 - 46,6±18,3, ИЛ 10- 54,9±12,6. В группе сравнения-1 сутки: ИЛ1β -123±10,9, ИЛ 6 - 51,3±28,2, ИЛ 10- 63,4±14,1; На 5-е сутки: 119±26,9, ИЛ 6 - 49,9±24,6, ИЛ 10- 59,2±18,2. Контроль: 1-е сутки: ИЛ1β -82±15,2, ИЛ 6 - 33,3±21,1, ИЛ 10- 98,7±13,6; На 5-е сутки: 114±12,6, ИЛ 6 - 27,1±18,3, ИЛ 10- 64,9±12,6(см. табл. №2).
Таблица 2
|
|
Основная группа |
Группа сравнения |
Контрольная группа |
Основная группа |
Группа сравнения |
Контрольная группа |
|
|
Интер-лейкин |
|
1 сутки после родов |
1 сутки после родов |
|
5 сутки после родов |
5 сутки после родов |
|
|
IL 1β |
121±15,2 ¹ ³ |
123 ± 10,9 ¹ ² |
82 ± 15,2 ² ³ |
114±22,3 ¹ ³ |
119±26,9 ¹ ² |
114±12,6 ² ³ |
|
|
IL 6 |
54,3±21,1 |
51,3 ±28,2 |
33,3 ± 21,1 |
46,6±18,3 |
49,9±24,6 |
27,1±18,3 |
|
|
IL 10 |
61,7 ± 13,6 |
63,4±14,1 |
98,7 ± 13,6 |
54,9±12,6 |
59,2±18,2 |
64,9±12,6 |
|
- Различия статистически значимы между группой сравнения и основной группой
- р≤ 0,05
- Различия статистически значимы между группы сравнения и контрольной группой
- р≤ 0,01
- Различия статистически значимы между основной группой и контрольной группой
- р ≤ 0,01
Обсуждение: При мониторинге водных секторов отмечается переход от выраженных нарушений к умеренным, с последующей полной нормализацией значений водного баланса на фоне терапии. Исследование доказывает постепенную стабилизацию состояния водных секторов, переход от выраженных нарушений к более умеренным изменениям жидкостных секторов, что подтверждает необходимость продолжения наблюдения и лечения гестоза в позднем послеродовом периоде. При гестозе отмечается увеличение ИЛ 1, ИЛ6 в группах с гестозом по сравнению с контрольной. Уровень ИЛ 10 заметно выше в контрольной группе. К 5-м суткам: отмечается заметное снижение ИЛ 1, ИЛ 6 в основной группе, и умеренное снижение ИЛ1, ИЛ 6 в гр.сравнения. Рост ИЛ 10 отмечен в основной группе. Восстановление баланса между про- и противовоспалительными цитокинами также отмечается в основной группе. В целом наиболее высокие концентрации противовоспалительных цитокинов отмечено при гестозе средней тяжести, наименьшие — при тяжелом течении гестоза, что возможно связано с развитием так называемого «феномена лейкоцитарной депрессии». Указанный феномен можно считать критерием тяжести патологического процесса. По группе родильниц с гестозом в целом отмечалось заметное снижение уровня противовоспалительных цитокинов по сравнению со здоровыми беременными. По результатам отслеживается более благоприятное течение послеродового течения в основной группе, где применялся Тетраспан 6, на что указывает ранняя стабилизация состояния водных секторов к 5-м суткам по сравнению с группой, где применялись общеизвестные ГЭК. По анализу цитокинового профиля в динамике с 1-х по 5-е сутки определяется тенденция отчетливого снижения уровней про- и противовоспалительных цитокинов по сравнению с группой сравнения.
Выводы: 1. Метод ИДИ является доступным и неинвазивным для оценки состояния водного баланса организма, что обеспечивает контроль объема и количества ИТ и снижает риск гипергидратации в периоперационном и послеродовом периодах.
2.Активность про- противо - воспалительных цитокинов у родильниц с гестозом зависит от объема и состава инфузионной терапии. Определение цитокинов при гестозе целесообразно для определения динамики, выбора состава и продолжительности инфузионной терапии.
3. В группе, где применялся Тетраспан 6, отмечается раннее снижение уровней провоспалительных маркеров и восстановление равновесия цитокинового профиля, за счет моделирующего воздействия Тетраспана 6 на воспалительный ответ, что доказывает его эффективность и рекомендует его к использованию в составе инфузионной терапии средних и тяжелых форм гестоза.
Литература:
Акушерство и гинекология: Клинические рекомендации / Под ред. В. И. Кулакова. — М., 2005.
Галушка С.В., Назаров Б. Ф., Шифман Е. М. Водно-секторальные нарушения у родильниц с преэклампсией. Общая реаниматология. - 2007. - № 4. - С.47-50.
Галушка С.В., Назаров Б.Ф. Применение препаратов гидроксиэтилкрахмала при коррекции вводно-секторальных нарушений у родильниц с гестозом. // Альманах анестезиологии и реаниматологии. Материалы 4-й сессии МНОАР. М . 2004 г С.13.
Гестозы, АФС и гипергомоцистеинемия: Материалы 4-го Рос. форума "Мать и дитя". М 2002; 385-387.
Заварзина О.О. Комплексная интенсивная терапия тяжелых форм гестоза: Автореф. дис. ... д-ра мед. наук. М 1999;
Зайнулина М.С., Петрищев Н.Н. Эндотелиальная дисфункция и ее маркеры при гестозе. Журнал акушерства и женских болезней.- 1997.-№1. – С.59-62.
Иванов Г.Г., Мещеряков Г.Н., Кравченко Н.Р. и др. Биоимпедансометрия в оценке водных секторов организма// Росс. Журнал анест. И инт. Терапии, 1999, №1. С.59-63.
Ильин И.В., Расстригин Н.Н., Суханова Л.П. Осложнения при проведении интенсивной терапии у больных с тяжелыми формами позднего токсикоза// Акуш. и гин. – 1997. - №6.-С. 15-18.
Марков Х. М. Молекулярные механизмы дисфункции сосудистого эндотелия // Кардиология. — 2005. — Т. 45, № 12. — C. 62—72.
Ребров А.П., Сажина Е. Ю., Тома М.И. Эндотелиальная дисфункия и особенности изменения уровня цитокинов и С- реактивного белка у больных хронической сердечной недостаточностью// Рос. Кард.журнал. – 2005. – №2. –С. 26-31.
Репина М. А. Преэклампсия и материнская смертность.- СПб.: СПбМАПО, 2005.
Сидорова И. С. И др. Прогностические критерии тяжести течения гестоза // Патология беременности. — 2007. — № 17. — С. 49—54.
Boldt et al., Anesth Analg 2007; 104: 425-430.
Brunner H., Cockroft J.R., Deanfield J. et al. Endothelial function and dysfunction. Part ΙΙ: Assosiation with cardiovascular risk factors and diseases. A statement by the Working Group on Endothelins and Endothelial Factors of the European society of Hypertension// J. Hypertension. -2005.- Vol.23.- P. 223-246.
Dekker G.A., Sibai B.M. Ethiology and pathogenesis of preeclampsia: current concepts // Am J Obstet Gynecol. – 1998 Nov; 179 (5): 1359-1375.
Egbor M. et al. Preeclampsia and fetal growth restriction: how morphometrically different is the placenta? // Placenta. — 2006. — Vol. 27, N 6—7. — P. 727—734.
Grundamann M., Woywodt A., Kirsch T. et al. Circulating endothelial cells a marker of vascular damage in patients with preeclampsia.// Am J Obstet Gynecol. -2008.-Vol. 198.-P.317-322.
Heinze et al., Eur J anaesth 2005, 22 (34): 78-79.
Jacob L., Heming N., Guidet B. Hydroxyethyl starch and renal dysfunction // Transfusion Alternatives in Transfusion Medicine. - 2007. - 9(3). - P. 182 - 188
Warren B.B., Duriux M. E. Hydroxyethyl starch: safe or not? // J. Anest. Analg.-1997.-Vol.84.-P. 193-199.
Zander R et al. Konsensus optimaler Volumenersat Anaesth Intensivmed