Ранее нами было показано, что целестиновые руды Арикского месторождения Туркменистана состоят в основном из целестина – природного сульфата стронция (SrSO4) и доломита (CaCO3∙MgCO3). В связи с этим нами разработан химический способ обогащения этих руд путем растворения пустой карбонатной породы растворами азотной кислоты [1]. Было установлено, что растворимость доломита составляет более 98% при концентрации HNO3 не ниже 10%. Растворимость мономинерального целестина во всех концентрациях HNO3 не превышает 2,70%. Таким образом, было достигнуто селективное растворение доломита с получением концентрата целестина, содержащего SrSO4 не ниже 98%, что отвечает требованиям ГОСТа, предъявляемым для переработки его на стронциевые соли [2].
Получаемый после растворения доломита и отделения не растворившегося
целестина фильтрат, представляет собой раствор нитратов кальция и
магния. С целью обеспечения комплексного использования исходной руды
представляла интерес разработка способа утилизации этих остаточных
растворов. С этой целью нами изучена возможность получения из этих
растворов индивидуальных соединений магния и кальция. Для этого
выбран способ селективного осаждения Mg(OH)2
с помощью NaOH и Ca(OH)2
основываясь на различии в растворимостях Mg(OH)2
и Ca(OH)2
![]() .
Для изучения условий осаждения Mg(OH)2
из растворов применяли метод потенциометрического титрования, при
котором, регулируя значение pH среды, можно
получить осадок с заранее заданным составом [2]. Результаты
потенциометрического титрования из раствора, содержащего 9,90 г/л
Ca2+ и 1,65 г/л Mg2+
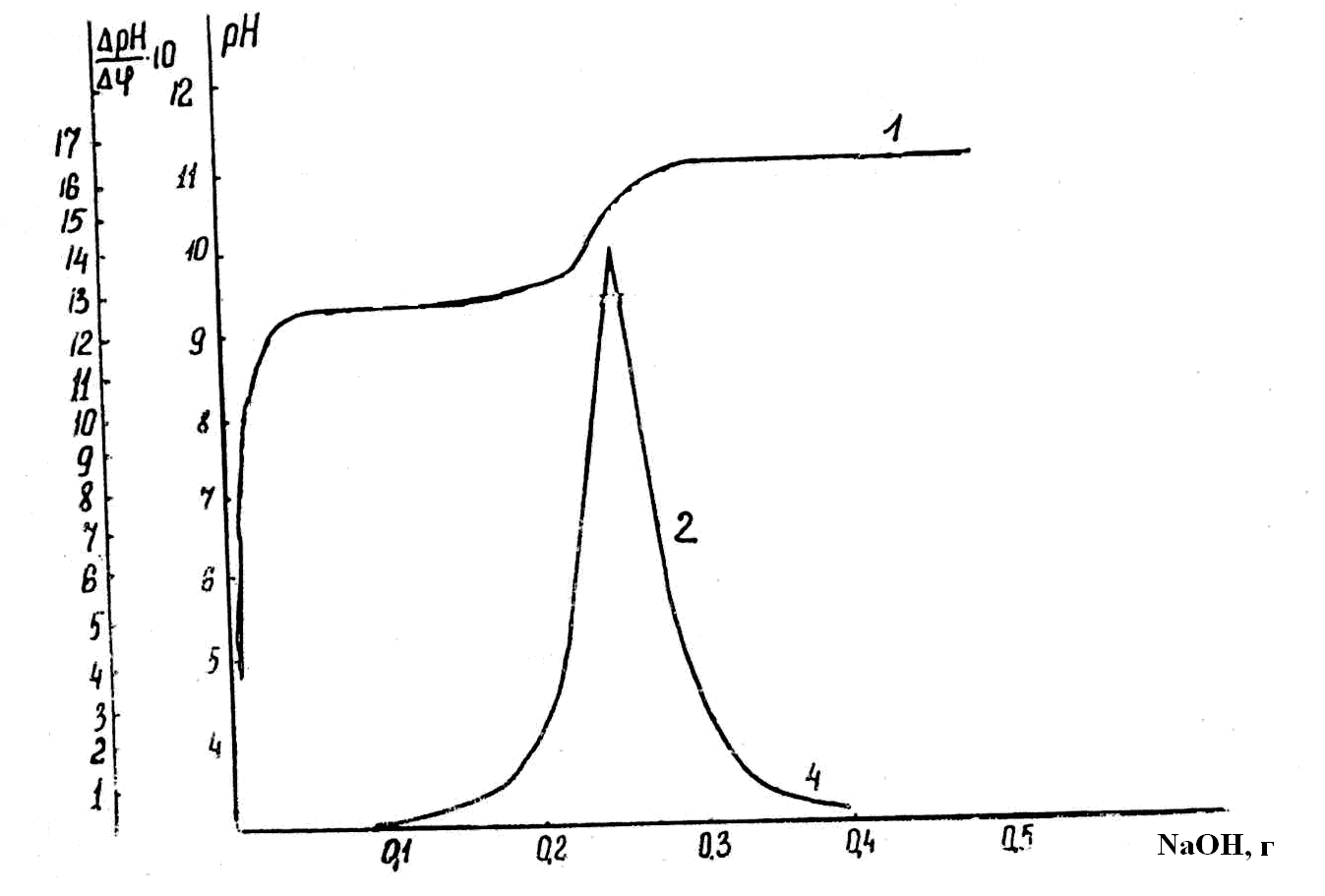
приведены в таблице 1 и на рисунке 1. Кривая титрования
в интегральной форме имеет два скачка потенциала (φ). Первый
характеризует увеличение pH среды до начала
образования Mg(OH)2,
второй указывает на окончание процесса осаждения Mg(OH)2
и начала выделения Са(OH)2.
Нижняя ветвь кривой сменяется буферной областью осаждения Mg(OH)2,
верхняя – буферной областью осадка Са(OH)2.
.
Для изучения условий осаждения Mg(OH)2
из растворов применяли метод потенциометрического титрования, при
котором, регулируя значение pH среды, можно
получить осадок с заранее заданным составом [2]. Результаты
потенциометрического титрования из раствора, содержащего 9,90 г/л
Ca2+ и 1,65 г/л Mg2+
приведены в таблице 1 и на рисунке 1. Кривая титрования
в интегральной форме имеет два скачка потенциала (φ). Первый
характеризует увеличение pH среды до начала
образования Mg(OH)2,
второй указывает на окончание процесса осаждения Mg(OH)2
и начала выделения Са(OH)2.
Нижняя ветвь кривой сменяется буферной областью осаждения Mg(OH)2,
верхняя – буферной областью осадка Са(OH)2.
Вид дифференциальной кривой потенциометрического титрования показывает, что в интервале рН 10,00-11,15 наблюдается резкое изменение рН среды при добавлении небольших количеств осадителя, что соответствует области осаждения Mg(OH)2.
Таблица 1
Потенциометрическое титрование 40% раствором
NaOH V=50 мл., t = 25ºС
|
Добавлен раствор NaOH |
рН суспен-зии |
Добавлен раствор NaOH |
рН суспен-зии |
Добавлен раствор NaOH |
рН суспен-зии |
|||
|
мл |
г |
мл |
г |
мл |
г |
|||
|
|
|
1,67 |
1,20 |
0,661 |
11,50 |
2,50 |
1,377 |
12,15 |
|
0,050 |
0,028 |
8,50 |
1,30 |
0,716 |
11,50 |
2,60 |
1,433 |
12,26 |
|
0,10 |
0,055 |
9,40 |
1,40 |
0,771 |
11,50 |
2,70 |
1,488 |
12,33 |
|
0,20 |
0,110 |
9,51 |
1,50 |
0,826 |
11,55 |
2,80 |
1,542 |
12,40 |
|
0,30 |
0,165 |
9,60 |
1,60 |
0,882 |
11,65 |
2,90 |
1,593 |
12,45 |
|
0,40 |
0,220 |
10,0 |
1,70 |
0,937 |
11,70 |
3,00 |
1,653 |
12,49 |
|
0,50 |
0,275 |
11,15 |
1,80 |
0,992 |
11,73 |
3,10 |
1,703 |
12,51 |
|
0,60 |
0,331 |
11,35 |
1,90 |
1,047 |
11,76 |
3,20 |
1,763 |
12,60 |
|
0,70 |
0,385 |
11,40 |
2,00 |
1,102 |
11,79 |
3,30 |
1,318 |
12,64 |
|
0,80 |
0,441 |
11,45 |
0,10 |
1,157 |
11,84 |
3,40 |
1,376 |
12,67 |
|
0,90 |
0,496 |
11,45 |
2,20 |
1,212 |
11,93 |
|
|
|
|
1,00 |
0,551 |
11,45 |
2,30 |
1,267 |
11,96 |
|
|
|
|
1,10 |
0,606 |
11,48 |
2,40 |
1,322 |
12,10 |
|
|
|
Рис.1. Кривые потенциометрического титрования 40%
раствором NaOH. Состав исходного раствора:
[Mg2+]=1,65; [Ca2+]=9,90 г/л.
1 – в интегральной форме;
2 – в дифференциальной форме
На основании данных потенциометрического титрования поставлены опыты по осаждению Mg(OH)2 из его индивидуальных и совместных с кальцием нитратных растворов. Результаты этих опытов приведены в таблицах 2-5.
В таблице 2 показаны результаты осаждения Mg(OH)2 из раствора Mg(NO3)2 при различных стехиометрических отношениях NaOH:Mg2+. Как видно из данных, уже при соотношении, равном 1:1, степень осаждения Mg(OH)2 достигает 96,4%. При этом рН суспензии составляет 11,20.
Таблица 2
Результаты осаждения Mg(OH)2 c помощью NaOH из раствора Mg(NO3)2
V = 50 мл., t = 25 ºС, τ = 0,5 час
|
№ |
Содержание Mg2+ в исходном растворе, г/л |
Добавлен NaOH при стехиомет-рическом отношении NaOH:Mg2+ |
Содержание Mg2+ в фильтрате после осаждения, г/л |
рН суспензии |
Степень осаждения Mg2+, % |
|
1 |
3,0 |
0:1 |
3,0 |
5,75 |
- |
|
2 |
3,0 |
1,0:1 |
0,108 |
11,20 |
96,4 |
|
3 |
3,0 |
1,25:1 |
0,030 |
12,45 |
99,0 |
|
4 |
3,0 |
1,50:1 |
0,024 |
12,50 |
99,2 |
|
5 |
3,0 |
1,75:1 |
0,012 |
12,55 |
99,6 |
|
6 |
3,0 |
2,0:1 |
0,006 |
12,65 |
99,8 |
В таблице 3 приведены результаты аналогичных опытов по осаждению Са(OH)2 из раствора Ca(NO3)2. Здесь также наблюдается осаждение Са(OH)2, но при значительно высоком значении рН.
Таблица 3
Результаты осаждения Са(OH)2 c помощью NaOH из раствора Са(NO3)2
V = 50 мл., t = 25 ºС
|
№ |
Содержание Са2+ в исходном растворе, г/л |
Добавлен NaOH при стехиометрическом отношении NaOH:Са2+ |
Содержание Са2+ в фильт- рате после осаждения, г/л |
рН суспен-зии |
Степень осаж-дения Са2+, % |
|
1 |
5,0 |
0:1 |
5,0 |
7,1 |
- |
|
2 |
5,0 |
1,0:1 |
1,18 |
12,86 |
76,4 |
|
3 |
5,0 |
1,25:1 |
0,78 |
12,75 |
84,4 |
|
4 |
5,0 |
1,50:1 |
0,60 |
12,65 |
88,0 |
|
5 |
5,0 |
1,75:1 |
0,24 |
12,75 |
95,2 |
|
6 |
5,0 |
2,0:1 |
0,20 |
12,70 |
96,0 |
Таблица 4
Результаты осаждения Mg(OH)2 и Са(OH)2 c помощью NaOH
из раствора Са (NO3)2 + Mg (NO3)2
V = 50 мл., t = 25 ºС
|
№ |
Содержание в исходном растворе, г/л |
Стехиомет-рическое отношение NaOH:Mg2+ |
Содержание в фильтрате, г/л |
рН суспен-зии |
Степень осаждения, % |
|||
|
Mg2+ |
Са2+ |
Mg2+ |
Са2+ |
Mg2+ |
Са2+ |
|||
|
1 |
1,5 |
2,5 |
1:1 |
0,036 |
2,5 |
11,25 |
97,6 |
0 |
|
2 |
1,5 |
2,5 |
1,1:1 |
0,012 |
2,45 |
11,95 |
99,2 |
0 |
|
3 |
1,5 |
2,5 |
1,15:1 |
0,012 |
2,40 |
12,10 |
99,2 |
4,0 |
|
4 |
1,5 |
2,5 |
1,20:1 |
0,011 |
2,20 |
12,60 |
99,3 |
12,0 |
|
5 |
1,5 |
2,5 |
1,25:1 |
0,010 |
2,20 |
12,62 |
99,3 |
12,0 |
|
6 |
1,5 |
2,5 |
1,30:1 |
0,009 |
2,06 |
12,65 |
99,4 |
17,6 |
С целью изучения возможности селективного осаждения Mg(OH)2 из растворов, содержащих также ионы Са2+, проведены опыты на растворах состава Mg(NO3)2 + Ca(NO3)2. Причем, количественное соотношение ионов Ca2+ и Mg2+ в них соответствовало их соотношению в доломите. Осадитель NaOH был добавлен при различных стехиометрических отношениях только по Mg2+. Результаты опытов приведены в таблице 4. Как видно из данных, уже при NaOH:Mg2++1,1:1 степень осаждения Mg(OH)2 составляет 99,2%, при полном отсутствии осаждения ионов Са2+. Следовательно, при оптимальных условиях возможно селективное выделение Mg2+ в виде Mg(OH)2 из кальцийсодержащих растворов.
Таблица 5
Результаты осаждения Mg(OH)2 с помощью 5% Са(OH)2
из раствора Са (NO3)2 + Mg (NO3)2
|
№ |
Содержание в исходном растворе, г/л |
Стехиометрическое отношение Са(OH)2:Mg2+ |
Степень извлечения, % |
Продолжитель-ность отстоя суспензии, час |
||
|
Mg2+ |
Са2+ |
Mg2+ |
Са2+ |
|||
|
1 |
28,67 |
50,30 |
0,95:1 |
97,4 |
0 |
2 |
|
2 |
18,83 |
32,56 |
0,997:1 |
98,2 |
0 |
18 |
|
3 |
56,18 |
98,67 |
1:1 |
99,94 |
0 |
18 |
|
4 |
56,18 |
98,67 |
1,04:1 |
100,0 |
9,4 |
18 |
С целью удешевления способа, была изучена возможность использования в качестве осадителя взамен дорогостоящего NaOH более дешевого и доступного раствора Са(OH)2. Для этого был использован 5% Са(OH)2. В качестве исследуемого объекта были использованы различные растворы, полученные при азотнокислотном обогащении целестиновой руды. Результаты приведены в таблице 5. Из данных видно, что уже при NaOH:Mg2++1,1:1 степень осаждения Mg(OH)2 достигает 99,94 при полном отсутствии выделения Са(OH)2. Остаточный раствор после отделения осадка Mg(OH)2 представляет собой раствор Са(NO3)2.
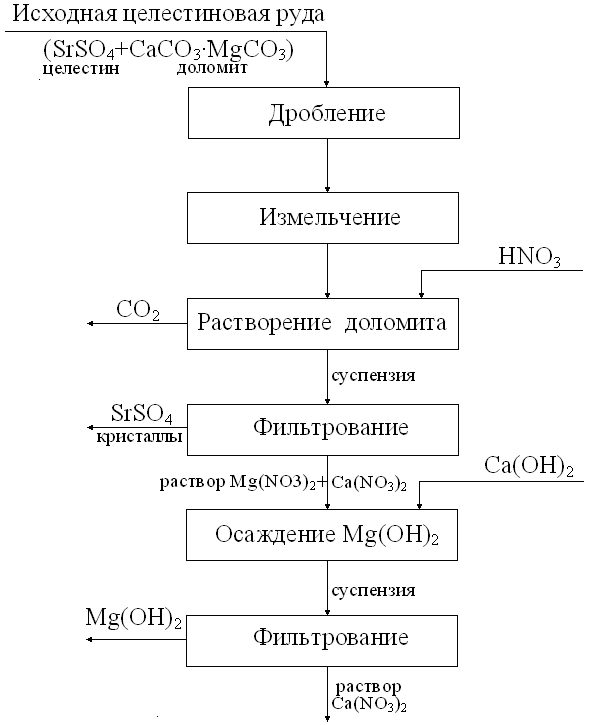
Таким образом, установлена возможность переработки остаточного раствора, получаемого при азотнокислотном обогащении целестиновых руд Арикского месторождения с получением Mg(OН)2 и раствора Са(NO3)2. Это позволяет комплексно и безотходно переработать исходную руду в целом по следующей схеме (рисунок 2).
Рис.2. Принципиальная схема комплексной переработки
целестиновой руды
- Литература:
Ханбердыева Б. Химическое обогащение целестиновых руд Арикского месторождения Туркменистана. //”Молодой ученый”, февраль 2011 г., том 1, № 2 (25).
Евжанов Х. Переработка стронцийсодержащих промышленных вод и минералов. Ашгабат, “Ылым”, 1994.
Вассерман И.М. Химическое осаждение из растворов. Л., “Химия”, 1980.