Политропным процесс называют процесс, протекающий при постоянной теплоемкости ![]() . Политропические процессы часто встречаются на практике, почему они и представляют интерес, в частности, политропическим процессом является адиабатный процесс, т. е. когда тепло не подводится к системе (
. Политропические процессы часто встречаются на практике, почему они и представляют интерес, в частности, политропическим процессом является адиабатный процесс, т. е. когда тепло не подводится к системе (![]() ) и она предоставлена сама себе. Конечно, политропический процесс достаточно лаконично записан для модели идеального газа, но в случае практики модель идеального газа хорошо себя показывает лишь в случае с небольшими давлениями и большими температурами, в дальнейшем газ намного лучше описывается множеством уравнений для реального газа. Наиболее компактную форму имеет уравнение Ван-дер-Ваальса, также оно одно из самых широко известных, поэтому попробуем описать уравнение политропы для реального газа как раз с помощью него.
) и она предоставлена сама себе. Конечно, политропический процесс достаточно лаконично записан для модели идеального газа, но в случае практики модель идеального газа хорошо себя показывает лишь в случае с небольшими давлениями и большими температурами, в дальнейшем газ намного лучше описывается множеством уравнений для реального газа. Наиболее компактную форму имеет уравнение Ван-дер-Ваальса, также оно одно из самых широко известных, поэтому попробуем описать уравнение политропы для реального газа как раз с помощью него.
Ключевые слова: идеальный газ, реальный газ, политропический процесс, адиабатный процесс, RTV, уравнение политропы.
Вывод уравнения политропического процесса модели Ван-дер-Ваальса
1) Запишем уравнение Ван-дер-Ваальса для ![]() молей газа: [2]
молей газа: [2]
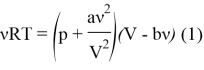
Заметим, что в случае ![]() (заметим, что запись
(заметим, что запись ![]() — некорректно, из-за размерности коэффициентов), уравнение Ван-дер-Ваальса приобретает вид уравнения идеального газа.
— некорректно, из-за размерности коэффициентов), уравнение Ван-дер-Ваальса приобретает вид уравнения идеального газа.
2) В случае реального газа внутренняя энергия складывается из потенциальной энергии взаимодействия молекул, а также ее кинетической составляющей:
![]()
Выражение для ![]() не меняется при переходе от идеального к реальному газу:
не меняется при переходе от идеального к реальному газу:
За наличие сил притяжения отвечает поправка ![]() , а потенциальная составляющая есть работа, растрачиваемая при «разбросе» молекул газа на бесконечность, т. е.:
, а потенциальная составляющая есть работа, растрачиваемая при «разбросе» молекул газа на бесконечность, т. е.:
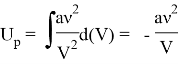
Окончательное выражение для внутренней энергии реального газа:
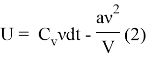
3) Запишем первый закон термодинамики:
![]()
Рассмотрим небольшое изменение объема, так что давление газа практически не изменится и будет верна формула:
![]()
Подставляя все полученное нами выше в первый закон термодинамики, мы получим:
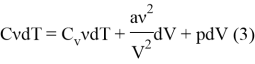
4) Выразим давление из (1):
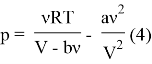
5) Учитывая (3) и (4) получим, что:
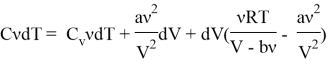
Упрощая данное выражение имеем:
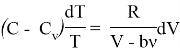
Проинтегрируем полученное нами выражение:
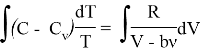
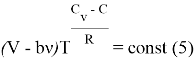
Выражение (5) является уравнением политропы для газа модели Ван-дер-Ваальса в зависимости ![]() . Уточним, что
. Уточним, что ![]() в правой части зависит от начальных параметров нашей системы.
в правой части зависит от начальных параметров нашей системы.
Учитывая (1) и (5) выведем уравнение политропы ![]()
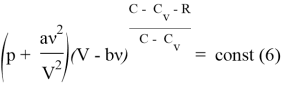
Заметим, что мы не можем «схлопнуть» ![]() , так как для реального газа: [1]
, так как для реального газа: [1]
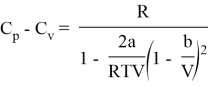
Обобщение на идеальный газ
В случае идеального газа ![]() мы получим уравнение политропного процесса для него, так что формула (6) есть обобщение политропического процесса как для идеального, так и для реального газов.
мы получим уравнение политропного процесса для него, так что формула (6) есть обобщение политропического процесса как для идеального, так и для реального газов.
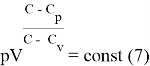
Оценка расхождения уравнения политропы для реального иидеального газов
Для идеального газа
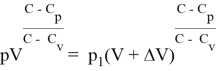
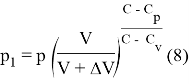
Для реального газа
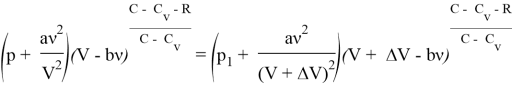
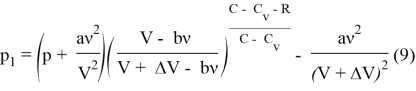
Рассмотрим адиабатный процесс, протекающий над одним молем азота ![]() , начальным давлением в 50 бар и начальным объемом в 1л. Будем откладывать на оси давление
, начальным давлением в 50 бар и начальным объемом в 1л. Будем откладывать на оси давление ![]() и объем
и объем ![]() и построим три графика: зависимость (8), зависимость (9), а так же разницу давлений при одинаковых объемах, т. е. проведём численное моделирование.
и построим три графика: зависимость (8), зависимость (9), а так же разницу давлений при одинаковых объемах, т. е. проведём численное моделирование.
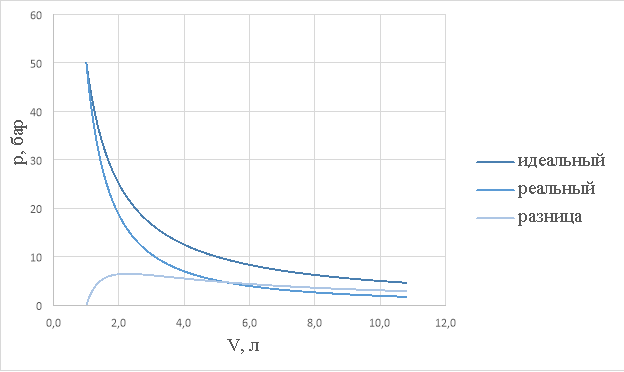
Рис.1.
Заметим из рис.1, что отличия есть и по началу они существенны, но при уменьшении давления графики «сближаются» друг к другу, что так же подтверждается экспериментальными данными. (в действительности, благодаря экспериментам мы знаем, что модель идеального газа хорошо описывает реальный газ при малых давлениях и больших температурах)
Литература:
-
О разности
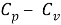 газа Ван-дер-Ваальса. Булыгин В. С., 26 июня 2011 г.
газа Ван-дер-Ваальса. Булыгин В. С., 26 июня 2011 г.
- Сивухин Д. В. Общий курс физики.







