В работе рассмотрено совершенствование производства бутилового ксантогената калия. Дано описание основного метода получения БКК и возможного метода оптимизации. Разработана принципиальная технологическая схема процесса.
Ключевые слова: ксантогенаты щелочных металлов, флотация, БКК, азеотропная сушка, ректификация.
Ксантогенаты щелочных металлов являются основным реагентом-собирателем при обогащении руд цветных, редких и благородных металлов методом флотации. Кроме флотационных процессов ксантогенаты щелочных металлов применяются в следующих отраслях:
– гидроэлектрометаллургии;
– резинотехнической промышленности;
– в сельском хозяйстве для получения инсектицидов, гербицидов, фунгицидов;
– при производстве моторных масел в качестве противоизносных, противозадирных присадок [1].
В настоящее время бутиловый и этиловый ксантогенаты калия производятся во многих странах мира. Одно из крупнейших производств в нашей стране находится в городе Волжский — ОАО «Волжский Оргсинтез».
Технический процесс получения ксантогената калия бутилового основан на взаимодействии бутилового спирта с гидроксидом калия и сероуглеродом в присутствии воды и состоит из стадии синтеза раствора кстантогената (ксантогенирования), сушки раствора ксантогената и ректификации спиртового и водного слоев.
Реакция ксантогенирования протекает в два этапа: на первом этапе происходит образование водно-спиртового раствора алкоголята калия, на втором этапе — взаимодействие полученного алкоголята с сероуглеродом с образованием ксантогената.
Процесс синтеза бутилового ксантогената калия экзотермичен, тепловой эффект реакции 43,5 кДж/моль. Выход продукта составляет 82,6 % [3].
Во многих метода получения БКК реакционную воду, образующуюся при синтезе бутилата калия, не отгоняют. Напротив, синтез ведут при большом избытке воды, так как в дальнейшем необходимо пропускать полученный раствор через форсунки на стадии сушки и гранулирования. Наличие воды вполне закономерно приводит к гидролизу целевого продукта по реакции (1) с образованием исходных веществ, что снижает выход и качество продукта.
C4H9OC(S)SK + H2O → CS2 + C4H9OH + KOH,(1)
На стадии сушки и при хранении целевого продукта также наблюдается реакция (1), что лишний раз указывает на необходимость в поиске способа синтеза БКК без применения избытка воды [2].
Рассматривается способ синтеза БКК без разбавления реакционной массы избытком воды. Также удаляется реакционная вода при взаимодействии сероуглерода с гидроксилом калия путем ректификации.
Основная реакция (суммарная):
![]() (2)
(2)
По этапам:
1) получение водно-спиртового раствора алкоголята калия
![]() (3)
(3)
2) взаимодействие полученного алкоголята с сероуглеродом с образованием ксантогената
![]() (4)
(4)
Наряду с основной реакцией протекают побочные реакции:
![]() (5)
(5)
![]() (6)
(6)
![]() (7)
(7)
![]() (8)
(8)
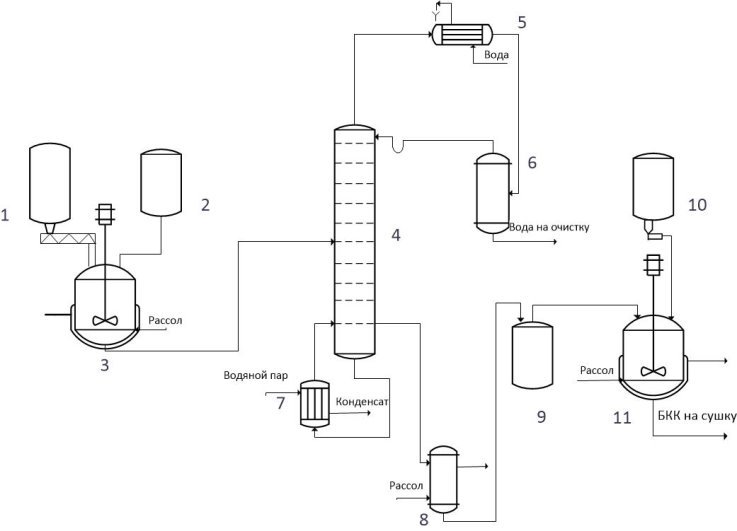
Рис. 1. Принципиальная схема синтеза БКК: 1 — самозагружающийся бункер; 2,9,10 — мерник; 3,11 — реактор; 4 — ректификационная колонна; 5 — дефлегматор; 6 — сборник для воды; 7 — кипятильник; 8 — теплообменник.
Мольное соотношение реагентов:
![]()
В реактор 3 при включенной мешалке подается бутиловый спирт и гидроксид калия. Температура реакции составляет 65–75 °С, время реакции — 2 часа. Далее реакционная масса поступает в ректификационную колонну 4, в которой происходит отгонка реакционной воды во избежание побочных реакций на стадии синтеза. Температура верха колонны — 90–95 °С, куба 120–135 °С. Пары азеотропа конденсируются и с температурой не более 40 °С сливаются в сепаратор 6, где смесь разделяется на водный и спиртовой слои. Спиртовой слой возвращается в виде флегмы, а водный идет на очистку.
После ректификационной колонны раствор бутилата калия в бутаноле подается в теплообменник, где смесь охлаждается до 20°С и транспортирует в мерник 9, из которого поступает на периодический процесс в реактор 11. Там реакционная масса охлаждается до 0 °С и в нее в течение получаса при перемешивании из мерника 10 дозируется сероуглерод. Температура реакции поддерживается в пределах 0–10°С. Реакционная масса дозревает в течение 40 минут. Продукт реакции идет на сушку и гранулирование. Время синтеза — 70 мин., выход составляет 96,1 % [2].
Таким образом, предложенный способ синтеза бутилового ксантогената калия позволяет существенно увеличить выход и чистоту целевого продукта.
Литература:
- Лебедев Н. Н. Теория химических процессов основного органического и нефтехимического синтеза: учеб. для вузов. — М.: Химия, 1984. — 375.
- Оптимизация процесса получения бутилксантогената калия / П. А. Гуревич [и др.] // Вестник технологического университета. — 2015. — Т. 18, вып. 4. — С. 172–174.
- Постоянный технологический регламент производства бутилового ксантогената калия ОА «Волжский Оргсинтез»

