Спектрофотометрическим методом изучено комплексообразование ванадия (V) с азосоединением синтезированным на основе пирогаллола-2,3,4-триокси-4´-сульфоазобензолом (R) в присутствии и отсутствии гидрофобных аминов- диантипирилметана (ДАМ) и диантипропилметана (ДАПМ). Установлено, что в присутствии диантипирилметана (ДАМ) и диантипропилметана (ДАПМ) образуется разнолигандный комплекс и оптимальный рН образования сдвигается в более кислую среду.
Рассчитаны спектрофотометрические характеристики комплексов, определены составы бинарного и разнолигандных комплексов различными методами. Изучение влияния посторонних ионов на комплексообразование показало, что определение ванадия (V)) c 2,3,4-триокси-4´-сульфоазобензолом в присутствии (ДАМ) и (ДАПМ) обладает высокой избирательностью. Разработанную методику применяли для фотометрического определения содержания ванадия (V) в природном объекте (СГХМ-1).
Ванадий в промышленном масштабе стали применять лишь с начала XX в. До настоящего времени его основным потребителем (до 90 %) является черная металлургия. Ванадий используют в производстве быстрорежущих, инструментальных и конструкционных сталей и чугунов. Благодаря его легирующим, раскисляющим и карбидообразующим свойствам повышается качество и эксплуатационные характеристики материалов. Ванадий применяют для получения сплавов на нежелезной основе (медно-ванадиевые, титано-ванадиевые сплавы, ванадиевые бронзы и др.). Большой интерес представляют ванадиевые сплавы с добавками вольфрама, ниобия, циркония и некоторых элементов, сверхпроводящие сплавы ванадия с галлием, кремнием, титаном и т. д. Перспективно использование чистого ванадия и его сплавов в ядерной энергетике, в ракето- и самолетостроении. Соединения ванадия, обладающие ценными каталитическими, люминесцентными, полупроводниковыми и другими свойствами, находят все большее применение в химической, радиоэлектронной, лакокрасочной, керамической, текстильной промышленности, а также в других отраслях народного хозяйства.
Многообразие ионных форм и степеней окисления ванадия определяют его высокую подвижность в земной коре и значительную рассеянность в природе. Ванадий редко образует крупные скопления руд, но легко концентрируется в почвах, наземных и водных растениях. В связи с высокой токсичностью соединений ванадия необходим падежный контроль за его содержанием в окружающей среде, отходах производства, биологических объектах и т. д. Это особенно важно из-за быстрого роста добычи и широкого потребления нефти с высоким содержанием ванадия.
В литературе описано сравнительно много реагентов для фотометрического определения ванадия (V). Среди них резорцилальдегид-формил гидразон, салицилальдегид-семикарбазон, о-оксифенилфлуорон, хлорфосфоназо III, арсеназо III, стильбазо, ПАР, хромазурол S, пирокатехиновый фиолетовый и другие реагенты [1–3]. А также известно, что азосоединения на основе пирогаллола являются перспективными реагентами в аналитической химии для определения ионов ряда металлов [4]. Изучение аналитических свойств азозамещенных пирогаллола показало, что при пользовании их для фотометрического определения неорганических ионов повышается не только чувствительность, но, в ряде случаев, и избирательность определения. Поэтому открытие новых аналитических возможностей азосоединений, синтезированных на основе пирогаллола вызывает практический интерес. В этой же работе c целью повышения чувствительности и избирательности определения ванадия (V) исследована его цветная реакция с азопроизводным синтезированным на основе пирогаллола-c 2,3,4-триокси-4-сульфоазобензолом в присутствии и в отсутствии ДАМ и ДАПМ.
Экспериментальная часть
Аппаратура. Оптическую плотность растворов измеряли на спектрофотометре «Lambda-40» с компьютерным обеспечением (фирмы «Perkin Elmer») и на фотоэлектроколориметре КФК-2 в кювете с толщиной слоя ℓ=1 см. Значение рН анализируемых растворов контролировали рН-метром марки рН-121 со стеклянным электродом. Удельную электропроводность растворов измеряли на кондуктометре КЭЛ-1М2.
Реагенты ирастворы. Реагент синтезирован по методике [4], его состав и строение установлены разными физико-химическими методами анализа.
В работе использовали 1·10–3 М растворы ванадия (V), водный раствор азосоединения, синтезированного на основе пирогаллола реагента (R) и в качестве третьего компонента 1·10–2 М водно-этанольные растворы ДАМ и ДАПМ. Исходный раствор ванадия (V) готовили растворением рассчитанной навески металлического ванадия (V) в НСl, [5], более разбавленные растворы готовили разбавлением исходного раствора.
Для создания необходимой кислотности использовали ацетатно-аммиачные буферные растворы (рН=3–11), фиксанал НСl (рН=0–2). Все использованные реагенты имели квалификацию ч. д.а.
Результаты иих обсуждение
Изучение зависимости комплексообразования от рН показало, что выход комплекса VR максимален при рН=7 и =441 нм. Сам реагент поглощает при =364 нм. Нами было изучено влияние ДАМ и ДАПМ на комплексообразование ванадия (V) с 2,3,4-триокси-4-сульфоазобензолом и установлено, что при введении третьего компонента в раствор бинарного комплекса образуются разнолигандные комплексы V-R-ДАМ и V-R-ДАПМ. Максимальное поглощение разнолигандных комплексов также наблюдаются при =453 нм и = 448 нм.
Таблица 1
Основные фотометрические характеристики реакций ванадия (V) с органическими реагентами
|
Реагент |
λmax, нм |
pH |
Sc:R |
max·10–3 |
Интервал подчинения закону Бера, мкг/мл |
|
1-(2-пиридилазо) резорцин [1] |
540 |
3,9 |
1:2 |
14,7 |
0,05–2,0 |
|
О-оксифенилфлуорон [2] |
530 |
7 |
1:3 |
9,7 |
0,37–4,5 |
|
ТСАБ |
441 |
7 |
1:2 |
12 |
0,05–2,8 |
|
ТСАБ+ДАМ |
453 |
5 |
1:2:2 |
13,75 |
0,05–5,52 |
|
ТСАБ+ДАПМ |
448 |
5 |
1:2:2 |
15,5 |
0,05–6,7 |
Из таблицы видно, что однородно и смешанолигандные комплексы образуются в слабо кислой среде, чем известный комплекс ванадия(V), а также можно заранее прогнозировать, что в присутствии третьего компонента значительно увеличится избирательность реакции.
Спектры поглощения комплексов ванадия (V) с ТСАБ в присутсвии и отсутствии ДАМ и ДАПМ приведены в рис.1
Из рисунка видно, что однородно и смешанолигандные комплексы ванадия (V) имеют максимумы поглошения, которые сдвигаются батохромно по отношению к максимуму поглошения реагента; при переходе от однородно к смешанолигандному комплексу наблюдается значительный батохромный эффект.
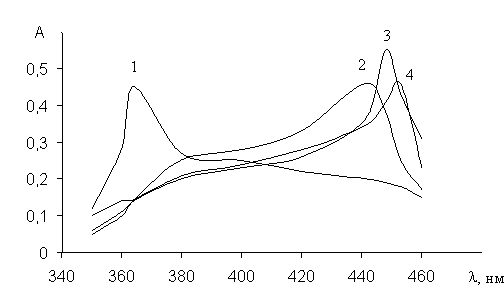
Рис. 1. Спектры поглощения раствора реагента и его комплексов с ванадием (V) в присутствии и отсутствии диантипирилметана и диантипропилметана при оптимальном значении рН соответствующих систем: 1) R; 2) V-R; 3) V-R-ДАМ; 4) V-R-ДАПМ CV=110–3 M; CR=110–3 M; CДАМ= СДАПМ=110–2М, Lambda-40, ℓ=1 см, фон-Н2О
Было изучено влияние рН раствора на оптическую плотность комплексов VR, VR-ДАМ и VR-ДАПМ (рис.2). Как видно, из рисунка максимальное поглошение бинарного и разнолигандных комплексов наблюдается при рН 7 и рН 5.

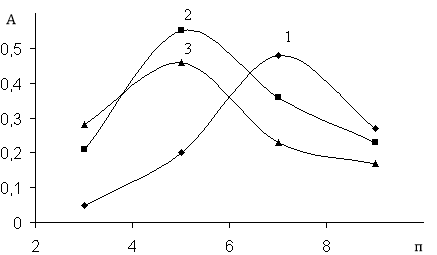
Рис. 2. Зависимость оптической плотности растворов комплекса ванадия (V) от рН в присутствии и отсутствии диантипирилметана и диантипропилметана при опт на фоне холостого опыта: 1. VR; 2. VR-ДАМ; 3. VR-ДАПМ
Установлено, что в присутствии ДАМ и ДАПМ наблюдается повышение чувствительности реакции, т. е. повышается значение молярного коэффициента светопоглощения. Они равны ε=12000 (VR), ε=15500 (VR- ДАПМ), ε=13750 (VR-ДАМ).
Подчинение закону Бера наблюдается в диапазоне концентраций 0,05–2,88 мкг/мл (VR), 0,05–4,8 мкг/мл (VR- ДАМ) и 0,05–5,52 мкг/мл (VR- ДАПМ) соответственно. [6],
Изучено влияние посторонних ионов и маскирующих веществ на комплексообразование ванадия (V) в присутствии и отсутствии ДАМ и ДАПМ. При сравнении избирательности реагентов для определения ванадия (V), известных из литературы и реагента ТСАБ видно, что этот реагент более избирателен в присутствии ДАМ и ДАПМ
Определение скандия вкарбонатносиликатных рыхлых отложениях.
Аттестуемая характеристика: массовая доля компонентов.
SиО2–45,59; ТиО2–0,63; Ал 2О3–11,6; Pb-0,0016; Zr-0,014; CaO-7,05
Фе 2О3–4,62; K2O-2,96; Na2O-0,87; P2O5–0,15; S-0,05; Ba-0,047;
МгО-5,82; Be-0,0002; Co-0,0014; Cr-0,0066; Rb-0,009; Sr-0,03
МнО-0,073; Sn-0,00037; V-0,009; Y-0,0023; Yb-0,00025;
Ъу-0,0048; Zn-0,005; Ga-0,0012; La-0,0032; Li-0,01; Nb-0,0012;
Ni-0,0033
Ход анализа. Для анализа взято 2,5 г образца карбонатносиликатного рыхлого отложения (СГХМ- 1). Растворяют образец в смеси 10 мл HF +5мл HNO3 +15 мл НСl нагревают в графитовом тигле при 500–600 С. Для полной отгонки избытка HF в осадок прибавляют 3 раза 5 мл HNO3. Полученный раствор растворяют в дистиллированной воде, переводят в колбу емкостью 25 мл и разбавляют дистиллированной водой до метки. Аликвоту полученного раствора помещают в 2 колбы вместимостью 25 мл. В первую колбу добавляют 2 мл 110–3М реагента (ТСАБ)+1 мл 1·10–2 М ДАМ, разбавляют до метки с рН 5, во вторую колбу 2 мл 1·10–3 М реагента +1 мл 1·10–2 М ДАПМ и разбавляют до метки с рН 5. Оптическую плотность растворов измеряют при 4 нм в кювете ℓ=1 см на КФК-2 относительно раствора фона. По калибровочной кривой определяют содержание ванадия (V) в пробе. Полученные данные показаны в таблице 2.
Таблица 2
Результаты определения ванадия (V) в карбонатносиликатных рыхлых отложениях (СГХМ-1)
|
Образец (СГХМ-1) |
Найдено,% |
По паспорту,% |
Найдено, мкг/мл |
|
V-R-ДАМ |
0,0091±0,0007 |
0,009 |
0,0072 |
|
V-R- ДАПМ |
0,0091±0,0006 |
0,009 |
0,0072 |
Литература:
- В. Н. Музгин, Л. Б. Хамзина, В. Л. Золотавин, И. Я. Безруков Аналитическая химия ванадия// ИЗДАТЕЛЬСТВО «НАУКА», MOCKВА, 1981, 245c.
- Курбатова Л. Д., Оносова С. П., Курбатов Д. И. Всероссийская конференция по аналитической химии, посвященная 100-летию со дня рождения академикка И. П. Алимарина»,Аналитика России». Москва, 2004, с.364–365.
- Дегтев М. И., Мельников П. В. Журнал «Заводская лаборатория», № 5, 1998 г. с.12
- Гамбаров Д. Г.//Новый класс фотометрических реагентов –азосоединений на основе пирогаллола. Дис.док.хим.наук. М.: МГУ, 1984,с.383
- Лазарев А. И. Харламов И. П. Яковлев П. Я. Яковлева Е. Ф. Справочник химика-аналитика.М.: Металлургия, 1976.с.184
- Бусев А. И. ТипцоваВ.Г., Иванов В. М. Практическое руководство по аналитической химии редких элементов.М:.Химия.1966.412с

