Широкое использование ванадия в современной технике, в частности, авиационной и атомной промышленности, электроламповой технике, энергетических ядерных реакторах, в производстве лаков и красок вызывает необходимость создания быстрых, избирательных и чувствительных методов определения этого элемента как в готовой продукции, так и в объектах окружающей среды.
В последнее время широко исследуются разнолигандные комплексы металлов с хромофорными органическими реагентами и модификаторами этих реагентов- поверхностно-активными веществами (ПАВ). С помощью ПАВ оказывается возможным одновременное участие в процессе взаимодействия как функционально-аналитических, так и аналитически-активных групп. Это позволяет наиболее полно вовлечь в процесс взаимодействия хромофорную систему реагентов и получить максимальные аналитические эффекты. Вследствие этого, фотометрические методы, разработанные на их основе, обладают высококонтрастностью, высокой чувствительностью и избирательностью.
В настоящей работе приводятся результаты спектрофотометрического исследования разнолигандных комплексов (РЛК) ванадия с 2,2’,3,4-тетраокси-3'-сульфо-5'-нитроазобензолом, изучены влияния цетилтриметиламмоний бромистого (ЦТМАВr) и цетилпиридиний хлористого (ЦПСl) и n-полибензолпиридиний хлористого (ПВПСl).
Реагенты ирастворы. Реагент-2,2',3,4-тетраокси-3'-сульфо-5'-нитроазобензол синтезирован по известной методике, описанной в [1], его состав и строение установлены методами элементного анализа и ИК-спектроскопии.
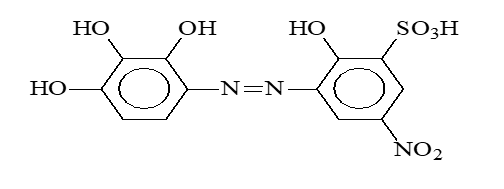
Данный реагент-2,2',3,4-тетраокси-3'-сульфо-5'-нитроазобензол хорошо растворим в воде. Исходный раствор ванадия с концентрацией 1·10–1 М готовили по известной методике [2]. Более разбавленные растворы готовили разбавлением исходного раствора. Использовали 1·10–3М раствор ванадия и 1·10–3М водный раствор реагента — 2,2’,3,4-тетраокси-3’-сульфо-5’-нитроазобензола. В качестве третьего компонента использовали 1·10–3М водно-этанольные растворы цетилтриметиламмоний бромистого (ЦТМАВr), полибензолпиридиний хлористого(ПВПСl) и цетилпиридиний хлористого (ЦПСl). Измерения проводили в двух интервалах значений рН. Растворы с рН 12 приготовили с помощью фиксанала НСl, а растворы с pH 311 с помощью аммиачно-ацетатных буферных растворов.
Изучение спектров поглощения однороднолигандного и разнолигандных комплексов ванадия с 2,2’,3,4-тетраокси-3'-сульфо-5'-нитроазобензолом в присутствии КПАВ показало, что образование РЛК сопровождается батохромным сдвигом по сравнению со спектром однороднолигандного комплекса. Изучение зависимости светопоглощения комплексов от рН среды показало, что максимальное образование обоих комплексов наблюдается в кислой среде (рН=1–2).
Таблица 1
Некоторые спектрофотометрические характеристики комплексов ванадия (V) с 2,2’,3,4-тетраокси-3'-сульфо-5'-нитроазобензолом вприсутствии КПАВ
|
Реагент |
Длина волны, λmax, нм |
pH
|
Bi: R |
МКП, max·10–3 |
Интервал подчинения закону Бера, мкг/мл |
|
VR |
467 |
4 |
1:2 |
10,65 |
0,1–2,5 |
|
VR + ЦПСl |
489 |
2 |
1:2:1 |
21,0 |
0,05–2,5 |
|
VR +ЦТМАВr |
527 |
2 |
1:2:1 |
22,5 |
0,1–2,9 |
|
VR +ПВПСl |
495 |
2 |
1:2:1 |
16,5 |
0,1–4,2 |
Изучение зависимости комплексообразования от рН показало, что выход комплекса VR максимален при рН 4 (λмах=467 нм), реагент имеет максимум светопоглощение при 397 нм. При введении поверхностно-активных веществ в систему VR образуются разнолигандные комплексы, с образованием которых наблюдается батохромный сдвиг по сравнению со спектром бинарного комплекса. В присутствии цетилтриметиламмоний бромистого(ЦТМАВr) образуется трехкомпонентное соединение оптимальное при рН2, =527 нм (VR-ЦТМАВr), а при введении цетилпиридиний хлористого (ЦПСl) и полибензолпиридиний хлористого ПВПСl образуются трехкомпонентные соединения оптимальные при рН 2, а =489 и 495 нм. Было изучено влияние рН раствора на оптическую плотность комплексов VR, VR-ЦПСl, VR-ЦТМАВr, VR-ПВПСl. При образовании разнолигандных комплексов рН комплексообразования сдвигается в более кислую среду. В дальнейшем для установления оптимальных условий были изучены влияние концентрации реагирующих веществ, температуры и времени на образование бинарного и разнолигандных комплексов.
Эти соединения ванадия образуются сразу и устойчивы в течении более суток и при нагревании до 700С. Соотношение реагирующих компонентов в комплексах установлено методами относительного выхода Старика-Барбанеля, сдвига равновесия и изомолярных серий [3. Молярные коэффициенты светопоглощения комплексов вычислены из кривых насыщения. Установлены интервалы концентраций, где соблюдается закон Бера.
Изучение влияния посторонних ионов и маскирующих веществ на комплексобразования ванадия в виде бинарного и разнолигандных комплексов показало, что в присутствии поверхностно-активных веществ значительно увеличивается избирательность реакции.
Установлено, что разработанные методики определения ванадия с реагентом в присутствии цетилтриметиламмоний бромистого и цетилпиридиний хлористого обладают высокой избирательностью. Так, определению ванадия в виде разнолигандных комплексов не мешают многократные количества щелочных и щелочноземельных металлов.
Литература:
- Гамбаров Д. Г.// Новый класс фотометрических реагентов-соединений на основе пирогаллола. Автореферат дис. док. хим. наук. М.:МГУ, 1984, 38 c.
- Лазарев А. И., Харламов И. П., Яковлев П. Я., Яковлева Е. Ф. Справочник химика-аналитика. М.: Металлургия, 1976, с 184
- Булатов М. И., Калинкин И. П. Практическое руководство по фотометрическим и спектрофотометрическим методам анализа. Л.: Химия, 1972. 407 с.







