Оценена динамика изменения «пустых» фосфатидилхолиновых (ФХ) липосом и липосом с α-липоевой кислотой при длительном хранении (в течение 18 месяцев) при Т = +4 0С. Изучено взаимодействие липосомальных нанокнструкций с компонентами плазмы здоровых доноров и пациентов, перенёсших острый ишемический инсульт. Методом динамического светорассеяния (ДРС) показано, что инкубирование в течение 4 часов липосомальной формы ЛК в плазме крови здоровых доноров не приводит к изменению размеров диаметров липосом.
Ключевые слова: липосомы, α-липоевая кислота, динамическое светорассеяние, плазма
Введение
Применение липосом в качестве систем доставки лекарств в наше время является перспективным подходом к повышению эффективности лечения. Включение лекарств в состав липосом способствует повышению биологической активности, биодоступности инкапсулированного препарата, а также позволяет увеличить терапевтический индекс (соотношение терапевтического эффекта и токсичности) лекарства [1]. В основном в медицинской практике применяется внутривенное введение липосомальных препаратов [2]. Поэтому необходимо иметь подробную информацию об их взаимодействии с различными компонентами плазмы крови липопротеиновыми комплексами и клетками крови.
Целью данной работы является исследование временной динамики изменения размеров липосом, содержащих липоевую кислоту в плазме крови, в течение недели после забора крови у здоровых доноров и пациентов, перенесших ишемический инсульт, с помощью методов динамического светорассеяния.
Материалы иметоды.
В работе использовали фосфатидилхолин Lipoid S-100 94 % чистоты, выделенный из бобов сои («Lipoid GmbH», Германия), α-липоевую кислоту (± α-Lipoic аcid, «Sigma–Aldrich», США), фосфатидилхолиновые липосомы с α-липоевой кислотой (содержащие α-липоевую кислоту), полученные на кафедре БТиПФ Московского технологического университета (МИТХТ). Для взятия венозной крови использовали стандартные пробирки (V=4,5мл) с антикоагулянтом цитратом натрия 3,2 % Vacuette®, кат. № 454329 (Австрия). Плазму крови, обедненную тромбоцитами, получали с использованием мульти центрифуги СМ-6МТ ELMI (Латвия). Для измерения рН среды физиологического раствора использовали pH-метр-милливольтметр pH-150 «РИАП» (Россия) и Sartorius PB-11. Для определения размеров полученных липосом и оценки их взаимодействия с компонентам плазмы методом динамического светорассеяния использовали анализатор размеров частиц и дзета-потенциала частиц и плоских поверхностей Delsa Nano C, Beckman Coulter Inc (США). и. Для измерения вязкости плазмы использовали в вибрационный вискозиметр SV-1A(«A&D Company Limited», Япония).
Измерение размеров липосомальных наночастиц методом динамического светорассеивания.
В программе прибора DelsaNano C, установленной на компьютере, задавали следующие параметры:
1) Параметры измерения (Measurement parameters). Выбирали MeasurementCond 100 (для измерения мелких стабильных наночастиц), (Repetition) 4 повтора.
2) Параметры анализа (Analysis parameters). Выбирали NNLS (обработка данных с помощью метода наименьших квадратов).
3) Параметры ячейки (Cell parameters). Выбирали Size call glass 1500 (т к. использовали кювету с V=1,5 мл)
4) Свойства растворителя (Diluent properties). В качестве среды, в которой проводились измерения размеров НЧ, использовали воду со следующими (физическо-химическими) параметрами: Т= 25 0С, вязкость — 0,89 Па*сек., коэффициент преломления — 1,33, диэлектрическая проницаемость — 78,3.
Полученные образцы липосом растворяли в физиологическом растворе (V=960 мкл, рН = 6,5) в 25 раз, после чего проводили измерения размеров частиц на приборе Delsa Nano C, Beckman Coulter Inc. (США) при Т = 25 0С.
Подготовка образцов крови.
Эксперименты проводили in vitro на образцах крови, взятых у здоровых доноров и у пациентов, перенесших ОНМК. У всех участников было получено добровольное согласие на взятие биоматериала. Обедненную тромбоцитами плазму (ОТП) получали центрифугированием крови в течение 25 мин. при 840 g., при комнатной температуре.
Измерение динамики изменения размеров липосом с липоевой кислотой в плазме методом динамического светорассеивания.
Метод определения размера липосом заключался в следующем. Наливали в прозрачную пластиковую кювету 1 мл обедненной тромбоцитами плазмы (БТП) и помещали в вибрационный вискозиметр SV-1A («A&D Company Limited», Япония). При использовании термостата в режиме 37 0С вязкость БТП = 1,53 Па*сек. Для каждого образца данную процедуру повторяли 3 раза. После чего исследуемый образец ставили в кюветное отделение анализатора размера наночастиц, Delsa Nano C, (Beckman Coulter Inc., США), включали термостат (Т = 37 0С) и регистрировали распределение размеров компонентов плазы по интенсивности в течение 4-ех часов. К исследуемым образцам с обедненной тромбоцитами плазмы (V = 960 мкл) добавляли «пустые» фосфатидилхолиновые липосомы или липосомы с липоевой кислотой (V = 40 мкл), перемешивали и аналогичным образом регистрировали динамику изменения размеров наночастиц, при инкубировании их в плазме крови (Т = 37 0С) в течение 4-ех часов.
Результаты иобсуждение.
Ранее на кафедре БТиПФ Московского технологического университета (МИТХТ) были получены липосомы с α-липоевой кислотой (α-ЛК), характеризующиеся эффективностью включения субстанции равной 85 % и обладающие пролонгированным действием. Также было оценено эффективное влияние липосомальной формы липоевой кислоты на агрегацию тромбоцитов как у здоровых доноров, так и у пациентов, перенёсших ишемический инсульт [3, 4].
В настоящей работе оценивалась стабильность липосом с α-ЛК и «пустых» фосфатидилхолиновых липосом при длительном хранении при Т = +4 0С (в течение 18 месяцев) и динамика изменения размеров липосомальных препаратов при инкубировании их в плазме крови здоровых доноров и пациентов, перенёсших ишемический инсульт (Т= 37 0С) в течение 4-ех часов.
Динамика изменения фосфатидилхолиновых липосом с липоевой кислотой при хранении в течение длительного времени при Т = +4 0С
На первом этапе работы определялась динамика изменения размеров «пустых» фосфатидилхолиновых (ФХ) липосом или липосом с α-ЛК в физиологическом растворе (рН=6,5) при хранении в течение длительного времени (9 и 18 месяцев) при Т = +4 0С. Размеры частиц определяли методом динамического светорассеивания (ДРС). В ходе работы были получены следующие результаты, представленные на рис.1.
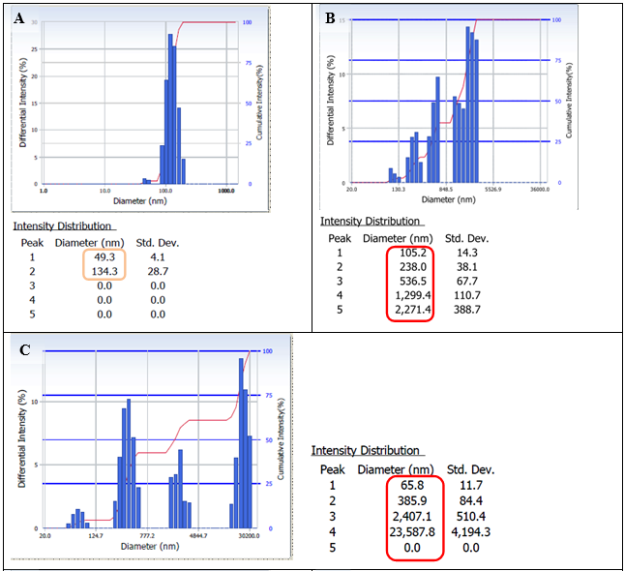
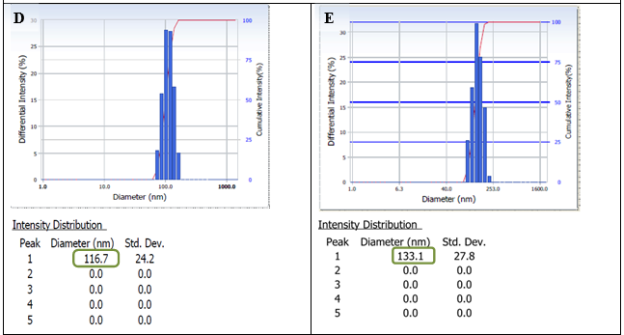
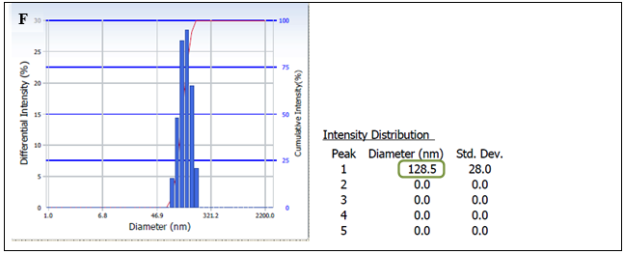
Рис.1. Распределение размеров наночастиц от интенсивности светорассеяния в физиологическом растворе (рН=6,4): «пустых» фосфатидилхолиновых липосом (A), через 9 месяцев (B), через 18 месяцев (С); липосом, содержащих ЛК (D), через 9 месяцев (E), через 18 месяцев (F)
В результате проведенных исследований было обнаружено, что размеры «пустых» ФХ липосом, за время хранения (9 месяцев) значительно увеличились. В образце содержалось несколько фракций частиц, 65 % частиц имели размер более 1 мкм: 1,3 мкм (15 %) и 2,3 мкм (50 %) (Рис. 1 A, B). При хранении «пустых» ФХ липосом в течение 18 месяцев происходило уменьшение количества фракций с маленькими наночастицами (НЧ) 65 нм (5 %), 380 нм (30 %) и увеличение образования более крупных агрегатов, включающие фракции с размерами частиц до 2 микрон (20 %) и до 23 микрон (45 %) (Рис. 1, С).
Изменения же размеров частиц липосом с α-ЛК не происходило. Данные наночастицы после хранения при Т = +4 0С в течение 9 и 18 месяцев представляли собой однородную систему с размером частиц 130 нм (Рис. 1, D, Eи F).
Эти результаты можно объяснить тем, что липоевая кислота, по-видимому, стабилизирует липосомы за счет её взаимодействия с поверхностью мембраны (ФХ) и изменения её поверхностного заряда. И при этом наночастицы с α-ЛК не агрегируют между собой.
Исследование взаимодействия липосом, содержащих α-липоевую кислоту, с компонентами плазмы крови человека.
Плазма крови представляет с собой сложную, многокомпонентную биологическую систему, состоящую из различных органических (белки, белок-липидные комплексы, липопротеины, хиломикроны и др.) и неорганических (катионы: Na+, K+, Ca2+, Mg2+; анионы: Cl-, HCO3-, HPO42- и др.) соединений с разными размерами (Таблица 1). В отличие от сыворотки крови, в которой процессы деградации белков и их агрегации, обеспечивающие свертывание крови уже прошли, в плазме крови эти процессы ингибированы благодаря действию антикоагулянтов (например, гепарина). Однако замедление этих процессов не гарантирует отсутствия их влияния на структуры и концентрации молекул белков и их комплексов в плазме крови [5, 6].
Таблица 1
Основные классы липопротеинов вплазме крови человека [6].
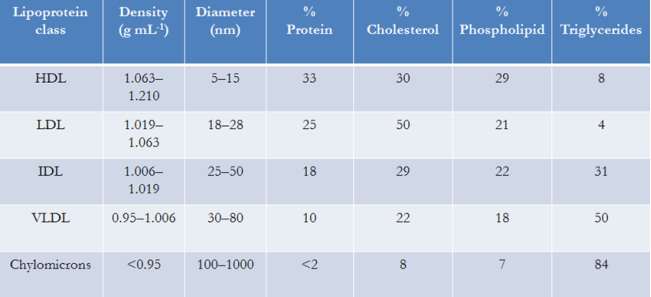
Следовательно, необходимо учитывать, что, попадая в плазму крови, липосомы могут взаимодействовать со всеми ее компонентами, что приводит к изменению размеров, морфологии данных наночастиц и их свойств [7, 8]. Такой процесс может происходить в следующих направлениях. Во-первых, механическое налипание молекул белков плазмы на поверхность липосомы могут увеличивать ее средний гидродинамический диаметр. Во-вторых, эти же компоненты плазмы, находясь в контакте, друг с другом и «сжимая» липосому, могут деформировать липидный бислой частицы тем самым, уменьшая ее размер.
Поэтому на данном этапе работы проводили исследования динамики изменения «пустых» ФХ-липосом и липосом с α-ЛК в плазме в течение четырех часов, используя метод ДРС. Для этого моделировали систему циркулирования липосом в плазме. Из анализа литературных источников было установлено, что липосомы циркулируют в крови в течение нескольких часов [9–11]. Исходя из этих данных, мы выбрали максимальное время инкубации 4 часа.
Эксперименты проводили in vitro на образцах крови, полученных у условно здоровых доноров. Образцы с полученными липосомами добавляли к плазме крови после чего проводили измерение размеров НЧ с помощью анализатора размеров частиц Delsa Nano C, (Beckman Coulter Inc., США) при их инкубировании в плазме (Т = 37 0С) в течение 4 часов. Полученные данные обрабатывали в программе DelsaNano v3.73. Результаты, полученных исследований, представлены на рисунке 2.
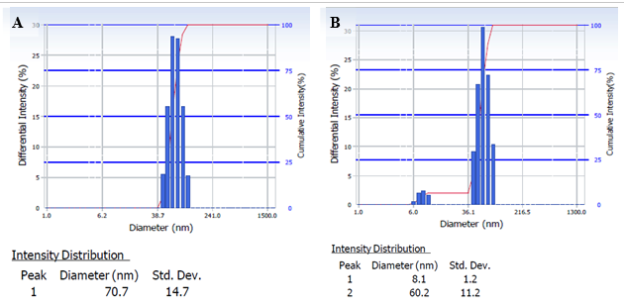
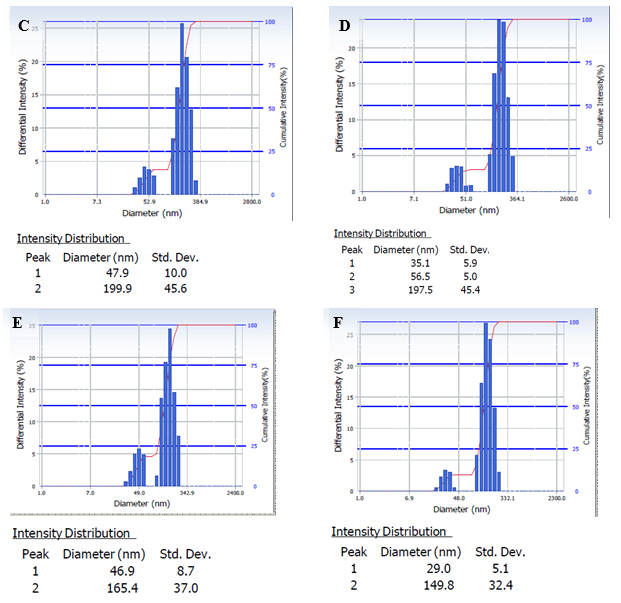
Рис. 2. Распределение наночастиц от интенсивности светорассеяния: в плазме (здор. доноры) (A), через 4 часа (B); в плазме (здор. доноры) с пустыми липосомами (C), через 4 часа (D); в плазме (здор. доноры) с α-ЛК-липосомами (E), через 4 часа (F)
В результате проведенного эксперимента было обнаружено, что плазма крови представляет с собой бисистему, содержащую фракцию компонентов плазмы с размером 60- 70 нм (100 %) (Рис. 2; А). При увеличении времени инкубации плазмы (Т= 37 0С) до 4-х часов (Рис 2; В) происходит изменение размеров наночастиц в сторону уменьшения их диаметров и увеличение количества фракций НЧ: 8 нм (15 %) и 60 нм (85 %). По-видимому, можно предположить, что происходило изменение размеров компонентов плазмы за счет образования новых типов липопротениов, различных белковых, белок-липидных комплексов и др. (размер которых находится в диапазоне 50–100 нм, Рис 2; В) в процессе инкубирования плазмы в течение 4-часов без липосом. Последующее добавление как и «пустых» ФХ-липосом, так и липосом с α-ЛК в плазму без инкубации привело к незначительному уменьшению размеров и содержания компонентов в плазме (46 нм, 30 %), и к появлению новой фракции, содержащей липосомальные наноконструкции с размерами 199 нм (70 %) — «пустые» ФХ-липосомы; и 165 нм (70 %) — α-ЛК-липосомы (Рис. 2; С, Е). В результате полученных данных было установлено, что при инкубации липосом в плазме в течение 4 часов их размеры практически не изменились (197 нм (70 %) — «пустые» ФХ-липосомы; и 150 нм (75 %) — α-ЛК-липосомы) (Рис. 2; D, F). Полученные данные исследования свидетельствует об отсутствии агрегации липосомальных наноконструкций между собой и взаимодействия с компонентами плазмы, приводящими к изменению их размеров.
В дальнейшем, после проведения дополнительных исследований, планируется применение липосомальной формы α-ЛК при комплексной терапии острых нарушений мозгового кровообращения (ОНМК). Поэтому на завершающем этапе работы проводили исследования динамики изменения «пустых» ФХ-липосом и липосом с α-ЛК в плазме у пациентов с острой ишемией головного мозга в течение 4-х часов.
Эксперименты проводили in vitro на образцах крови, полученных у пациентов, перенёсших острый ишемический инсульт. Образцы с полученными липосомами добавляли к плазме крови после чего проводили измерение размеров НЧ с помощью анализатора размеров частиц Delsa Nano C, (Beckman Coulter Inc., США) при их инкубировании в плазме (Т = 37 0С) в течение 4 часов. Полученные данные обрабатывали в программе DelsaNano v3.73. Результаты, полученных исследований, представлены на рисунке 3.
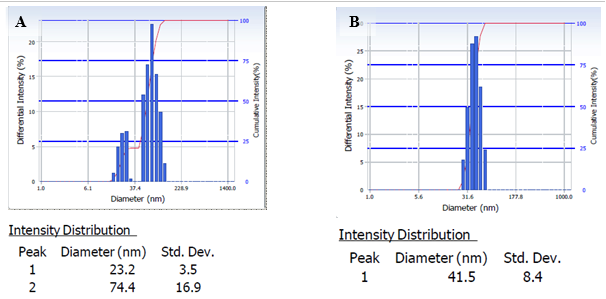
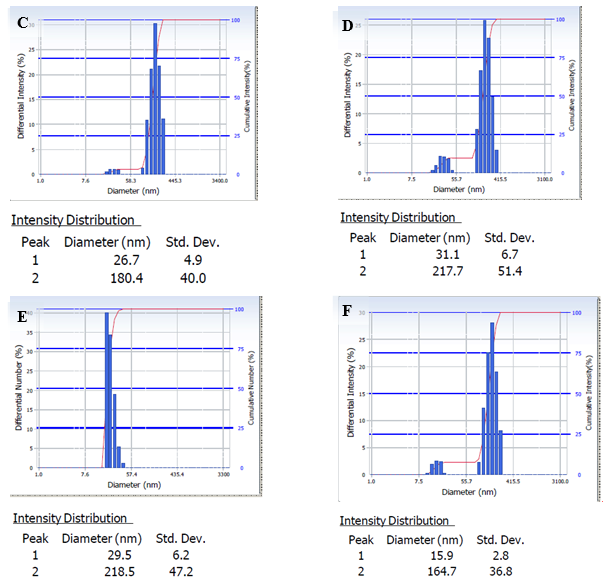
Рис.3. Распределение наночастиц от интенсивности светорассеяния: в плазме (пациенты с ОНМК) (A), через 4 часа (B); в плазме (пациенты с ОНМК) с пустыми ФХ- липосомами (C), через 4 часа (D); в плазме (пациенты с ОНМК) с α-ЛК-липосомами (E), через 4 часа (F).
В результате проведенных исследований было обнаружено, что плазма крови у пациентов, перенесших инсульт, состоит из небольших агрегатов различных белковых и белок липидных комплексов с размерами 25 нм (30 %) и 75 нм (70 %) (Рис. 3; А). При инкубировании данных образцов без липосом в течение 4-х часов происходило уменьшение размеров этих комплексов до 40 нм (Рис. 3; В). Добавление как «пустых» ФХ-липосом, так и липосом с α-ЛК в плазму без инкубации привело к появлению новой фракции, содержащей липосомальные наноконструкции с размерами 180 нм (85 %) — «пустые» ФХ-липосомы; и 218 нм (95 %) — α-ЛК-липосомы (Рис. 3; С, Е) и к значительному уменьшению содержанию компонентов плазмы крови, причем размеры их не изменились. По-видимому, незначительное увеличение размеров самих липосом (от 140 до 180 или 218 нм (См. Рис. 1 — А, D; Рис.3 С, Е) произойти в результате незначительных взаимодействий как и «пустых» ФХ- липосом, так и α-ЛК-липосом с компонентами плазмы (доноры с ОНМК) и образованию небольших агрегатов. При инкубировании и «пустых» ФХ- липосом в плазме (доноры с ОНМК) в течение 4-х часов происходило незначительное увеличение диаметра липосомальных конструкций от 180 нм до 217 нм (70 %), в результате взаимодействия плазменных компонентов с липосомами, и, при этом, происходило незначительное увеличение содержания фракции с непрореагировавшими с липосомами плазменными компонентами 30 нм (30 %) (Рис. 3; D). Инкубирование α-ЛК-липосом в плазме (ОНМК-пациенты) в течение длительного времени, наоборот, привело к уменьшению размеров НЧ (от 220 нм до 164 нм) и к незначительному образованию фракции, с пламенными компонентами (Рис. 3; F). Полученные результаты исследований свидетельствуют об отсутствии агрегации самих липосом, но незначительном изменении размеров «пустых» ФХ- липосом в результате взаимодействия с компонентами плазмы пациентов с ОНМК. Причем было отмечено, что липосомы с α-ЛК не образовывали агрегатов с плазменными компонентами. Полученные результаты можно объяснить тем, что липоевая кислота, по-видимому, стабилизирует липосомы за счет её взаимодействия с поверхностью мембраны (ФХ) и изменения её поверхностного заряда, в результате чего не происходит взаимодействия с компонентами плазмы и образования агрегатов.
Заключение.
Таким образом в ходе работы было показано, что липосомы, содержащие α-липоевую кислоту по сравнению с «пустых» фосфатидилхолиновыми липосомами стабильны при длительном хранении (в течение 18 месяцев при Т = +4 0С), не образуют агрегаты и не изменяют размеры. Изучение методом ДРС взаимодействия липосом, содержащих α-липоевую кислоту с компонентами плазмы крови здоровых доноров и пациентов с ОНМК показало, что не происходило существенного изменения размеров диаметров наночастиц при инкубировании α-ЛК-липосом в этих системах в течение 4-х часов.
Литература:
1. А. Ю. Барышников. Наноструктурированные липосомальные системы как средство доставки противоопухолевых препаратов. // ВЕСТНИК РАМН,2012, № 3, 24–31с.
2. J. Mahallagam, J. Nemunaitis et al. Phase-I study of intravenously administered ATI-1123, a liposomal docetaxel formulation in patients with advanced solid tumor. // Cancer Chemother Pharmacol., 2014, 74, 1241–1250 с.
3. В. А. Щелконогов, Сорокумова Г. М., О. А. Баранова А. В. Чеканов, К. Д. Казаринов и др. Липосомальная форма липоевой кислоты: получение и определение антиагрегационной и антиоксидантной активности.// Биомедицинская химия. 2016, 5, 577–583 с.
4. В. А. Щелконогов, Сорокумова Г. М., О. А. Баранова А. В. Чеканов, К. Д. Казаринов и др. Антиагрегационная эффективность липосомальной формы липоевой кислоты. (тезисы доклада, англ., русс.) Международная научно-практическая конференция «Биотехнологии в комплексном развитии регионов». 15–17 марта 2016, Москва.
5. Л. Л. Чайков. Метод динамического светорассеяния откроет новые возможности для медицинской диагностики.// Научные исследования, диагностика в медицине, 2014 г., http://science.spb.ru/allnews/item/1768-metod-dinamicheskogo-svetorasseyaniya (Дата обращения 28.09.17).
6. M. K. Campbell, & S. O. Farrell Biochemistry (5ed.). // Thomson Books Cole., 2006., 793 с.
- van der Vusse G. J. Albumin as fatty acid transporter. //Drug Metab Pharmacokinet 2009, 24(4) с.300–307.
- S. Guo, X. Shi, F. Yang, L. Chen, E. J. Meehan, C. Bian, M. Huang. Structural basis of transport of lysophospholipids by human serum albumin. //Biochem J, 2009, с.23–30.
9. O. S. Juliana, A. L. Elaine, D. C. Geovanni, M. C. Marzola, R. Domenico et.al. pH-Sensitive, Long-Circulating Liposomes as an Alternative Tool to Deliver Doxorubicin into Tumors: a Feasibility Animal Study. // World Molecular Imaging Society, Mol. Imaging Biol., 2016, (DOI: 10.1007/s11307–016–0964–7).
10. A. E. Tamer, V. P. Torchilin. Tumor-Targeted Nanomedicines: Enhanced Antitumor Efficacy In vivo of Doxorubicin-Loaded, Long-Circulating Liposomes Modified with Cancer-Specific Monoclonal Antibody.// Clin Cancer Res, 2009, (DOI:10.1158/1078–0432.CCR-08–2392).
11. Gert Storm, J. A. Daan. Crommelin. Liposomes: quo vadis?// research focus, PSTT Vol. 1, № 1, April 1998.







