Заболевания тканей пародонта — одна из актуальных проблем в стоматологии. Гингивит — это воспалительное заболевание слизистой оболочки десен, наиболее часто встречающееся у детей подросткового возраста. Конечно, гингивит может развиться у кого угодно — на это влияет множество различных факторов. Но все же взрослые чаще страдают пародонтитом и пародонтозом, а гингивит поражает больше детское население. Особенно ему подвержены подростки в период интенсивного роста. Встречаемость гингивита достигает около 98 %, часто поражает детей и молодых людей в возрасте 13–27 лет. Внедрение, а также разработка наиболее эффективных методов лечения заболеваний тканей пародонта, за последние несколько лет, занимают одно из первых мест в исследованиях российских и зарубежных авторов. В микробиологии ротовой полости важно разработать методы для быстрого изучения состава и/или содержимого десневой борозды и ротовой жидкости в клинике, прогноз длительности ремиссии и моменты обострения на основе микробиологических данных. Таким образом, исследование микробного гомеостаза имеет современную теоретическую и практическую значимость, так как он раскрывает механизмы взаимодействия микроорганизмов и тканей полости рта.
Микробиологические исследования ротовой жидкости и содержимого зубодесневой борозды обследуемых нами пациентов проводилось на базе бактериологической лаборатории отделения микробиологических исследований на инфекционную патологию Центра государственного санитарно-эпидемиологического надзора в Воронежской области.
При взятии материала для микробиологического исследования соблюдались следующие правила:
- До взятия материала не применялись никакие лекарственные полоскания.
- Перед забором материала пациенты не чистили зубы.
- Взятие материала на каждом из этапов работы проводилось во второй половине дня (с 14 до 16 часов), через 2 часа после приема пищи.
- Полученный для исследования материал доставлялся в бактериологическую лабораторию в течение 30 минут после забора.
Для микробиологического исследования у пациентов с хроническим катаральным гингивитом производился забор следующего материала:
‒ ротовая жидкость, путем сплевывания, собиралась в стерильные флаконы в количестве 1 мл, которые закрывали стерильной крышкой,
‒ содержимое зубодесневой борозды брали на стерильный, гигроскопичный ватный фитилек на стоматологическом зонде и опускали также в стерильный флакон с 1 мл физиологического раствора, закрывая стерильной крышкой.
Выделение микроорганизмов из их естественной среды обитания — тканей и жидкостей полости рта — осуществлялось путем посева исследуемых материалов на искусственные питательные среды. Используемый нами метод носит название культурального исследования.
Посев на питательные среды исследуемого материала проводили, взяв 0,1 мл ротовой жидкости и 0,1 мл из флакона, в котором находился физиологический раствор и содержимое зубодесневой борозды.
Первичный посев материала для исследования проводили на плотную питательную среду в чашках Петри. Набрав материал в пипетку, и приоткрыв чашку, наносили одну каплю на среду и втирали шпателем по всей поверхности агара.
Для выделения общей микрофлоры посев проводили на кровяной агар, который готовили следующим образом. К расплавленному и охлажденному до 45–50 °С питательному агару (рН 7,4–7,6) прибавляют 5–10 % дифибринированной или цельной свежевзятой крови животного (барана, кролика, крупного рогатого скота) или отходы человеческой крови, последнюю предварительно проверяют на стерильность посевом на сахарный бульон, который оставляют на 18–20 часов в термостате. Агар с кровью тщательно перемешивают, избегая образования пены, и разливают по чашкам слоем 3–4 мм. Выращивание проводится в термостате при температуре 37 °С, в течение 18–20 часов.
Среда Эндо использовалась для выявления кишечной микрофлоры. Для ее изготовления 100 мл обычного агара (рН 7,4) растапливают на водяной бане или в текучепаровом аппарате, охлаждают до 70 °С и прибавляют 1 г химически чистой лактозы, предварительно растворенной в стерильной пробирке в небольшом количестве дистиллированной воды и прокипяченной.
В отдельных пробирках готовят: 1) 2–3 мл спиртового насыщенного раствора основного фуксина, 2) 10 мл 10 % водного раствора сульфита натрия (Na2SO3). В стерильную пробирку отмеривают 1 мл раствора фуксина и прибавляют раствор сульфита натрия, до обесцвечивания фуксина (бледно- розовый цвет). Приготовленную смесь вливают в растопленный агар, хорошо перемешивают, избегая образования пены, и разливают по чашкам слоем 3–4 мм. Горячий агар имеет бледно-розовый цвет, при застывании он становится бесцветным. Выращивание проводится в термостате при температуре 37 °С, в течение 18–20 часов.
Для выявления грибов рода Candida в исследуемом материале, его посев проводили на среду Сабуро. Основой этой среды является дрожжевая вода. На 1 литр водопроводной (недистиллированной) воды берут 80 г прессованных пекарских дрожжей (или 20 г сухих дрожжей), кипятят 15 минут, пропускают через бумажный фильтр, разливают по флаконам и стерилизуют при 1 атм. 20 минут. К 100 мл стерильной, дрожжевой воды добавляют 1 % пептона, 2 % агара, нагревают до растворения агара, затем добавляют 4 % глюкозы (или мальтозы), фильтруют, разливают в пробирки (рН 5,8) и стерилизуют при 0,5 атм. 20 минут. После стерилизации среду в пробирках скашивают. Выращивание проводится в термостате при температуре 37 °С в течение 5 суток.
Интерпретацию полученных результатов микробиологического исследования материалов проводили, учитывая дифференциальные признаки, образовавшихся в ходе роста колоний, характерные для каждого вида бактерий.
Для стафилококков характерны золотистые (S. aureus) или белые (S. epidermidis, S. saprofhyticus) колонии. У микрококков колонии окрашены, как правило, в желтый (с различными оттенками — от желто-зеленого до оранжевого) или розовый (вплоть до красного) цвета. Подавляющее число штаммов S. aureus и некоторые штаммы S. epidermidis растворяют эритроциты, образуя прозрачную зону гемолиза вокруг колоний. Микрококки гемолитическими свойствами не обладают.
Стрептококки дифференцирую между собой по виду гемолиза на кровяном агаре, который обусловлен лизисом эритроцитов. При этом вокруг колоний образуется прозрачная зона, вплоть до полного просветления среды шириной от десятых долей до нескольких миллиметров. Колонии β- гемолитических стрептококков могут быть: мукоидные диаметром 1,5–2,5 мм, правильной округлой формы, напоминающие своим видом капельки росы; шероховатые, 1,5–2,5 мм в диаметре, круглые колонии, серовато-белого цвета, с характерным слегка приподнятым центром; гладкие, мелкие, 1–1,5 мм в диаметре, колонии сферической формы с ровным краем, с блестящей влажной поверхностью. α-гемолитические или зеленящие стрептококки образуют на кровяном агаре α-реакцию в виде полупрозрачной, зеленоватого оттенка зоны, и образованием мелких колоний, диаметром 1–1,5 мм серовато-зеленоватого цвета с гладкой или шероховатой поверхностью. γ — стрептококки инертны в отношении эритроцитов и гемоглобина; они не меняют вид кровяного агара и называются негемолитическими.
Нейссерии растут на поверхности кровяного агара в виде круглых гладких колоний с ровными краями, блестящей поверхностью или шероховатых колоний неправильной формы с неровными краями с причудливой поверхностью, некоторые имеют желтый пигмент. Различные виды Moraxella растут в виде крупных полупрозрачных, круглых, влажных, иногда слизистых колоний с небольшой зоной гемолиза или без него. Микробы рода Acinetobacter растут в виде крупных, белых, круглых, блестящих часто слизистых колоний, возможно с небольшой зоной гемолиза вокруг.
Колонии Corybebacterium круглые, непрозрачные, маслянистые мелкие или крупные, кремовые, бледно-желтые, оранжево-коричневые, гладкие без зон гемолиза.
На среде «Эндо» колонии представителей семейства Enterobacteriaceae выпуклые, с правильными округлыми очертаниями, более или менее опалесцирующие, иногда слизистые. Они могут быть окрашены в красный цвет с наличием металлического блеска, могут быть бесцветными, приобретать розоватый или сероватый оттенок с более или менее выраженным темным центром, особенно у более крупных колоний.
Колонии грибов рода Candida выпуклые, сметанообразные, глянцевидные, но не мокрые, гладкие или слегка морщинистые, сначала белые, а затем кремовые.
Производили подсчет числа выросших колоний на питательных средах из 0,1 мл ротовой жидкости и из 0,1 мл из флакона, содержащего 1мл физиологического раствора и содержимое зубодесневой борозды.
При проведении микробиологических исследований ротовой жидкости и содержимого зубодесневой борозды были обнаружены следующие основные виды микроорганизмов: стрептококки, стафилококки, микрококки, нейссерии, Corynebacterium spesits, Enterodacter species, Pseudomonas species, Candida albicans. Наиболее часто встречались, 20 % и более случаев обнаружения, β-гемолотические стрептококки, нейссерии, грибы Candida albicans.
Количественные микробиологические показатели данных микроорганизмов наиболее достоверно снижались после проведения профессиональной гигиены полости рта, аналогично показателям клинических исследований. Поэтому проводили анализ динамики следующих микроорганизмов: β — гемолитических стрептококков, Neisseria, Candida albicans.
К резидентным, то есть постоянно присутствующим в полости рта микроорганизмам, относятся наиболее часто встречающиеся аэробы родов Streptococcus и Neisseria, а также грибы рода Candida. Большинство β- гемолитических стрептококков человека относятся к Str.pyogenus и всегда воспринимаются как потенциальная угроза для организма. Нейссерии постоянно присутствуют в полости рта, достигая 3–5 % от видимого количества. Грибы рода Candida выявляют в полости рта примерно у 40–50 % здоровых людей, но в очень небольших количествах.
В таблице 1 (а также рис. 1 и 2) представлены данные среднего количества колоний в ротовой жидкости и содержимом зубодесневой борозды исследуемых микроорганизмов у пациентов с хроническим катаральным гингивитом легкой и средней степени тяжести.
Таблица 1
Среднее количество колоний вротовой жидкости исодержимом зубодесневой борозды β-гемолитических стрептококков, Neisseria, Candidaalbicans пациентов схроническим катаральным гингивитом легкой исредней степени тяжести до лечения
|
Виды бактерий |
Ротовая жидкость |
Зубодесневая борозда | ||
|
Легкий гингивит |
Средний гингивит |
Легкий гингивит |
Средний гингивит | |
|
Str.β |
95,5 ± 0,98* |
102,6 ± 3,0* |
141,1 ± 0,52* |
147,9 ± 0,47* |
|
Neisseria |
51,6 ± 0,8* |
61,0 ± 0,39* |
7,4 ± 0,3* |
10,3 ± 0,46* |
|
Candida |
41,7 ± 0,63* |
52,6 ± 0,29* |
5,3 ± 0,3* |
7,9 ± 0,4* |
* р < 0,05
Как видно из таблицы, независимо от степени тяжести заболевания в содержимом зубодесневой борозды чаще и в большем количестве обнаруживаются колонии β-гемолитического стрептококка (в 1,3 раза), а ротовой жидкости Neisseria (в 2,7 раза) и Candida albicans (в 5 раз) соответственно.
Анализируя данные среднего количества колоний микроорганизмов в содержимом зубодесневой борозды, представленные в таблице 8, можно увидеть, что β-гемолитические стрептококки в большем количестве по обоим показателям присутствуют при хронических катаральных легких гингивитах (в 1,7 и 2,8 раза соответственно). Среднее количество колоний Neisseria при гингивитах средней степени тяжести в 4,6 раза больше чем при легких гингивитах, при равном количестве случаев обнаружения данного вида микроорганизмов в содержимом зубодесневой борозды. Среднее количество колоний грибов Candida albicans достоверно не отличалось при хронических катаральных гингивитах легкой и средней степени тяжести, при большей частоте обнаружения при легких формах гингивита в 6,1 раза.
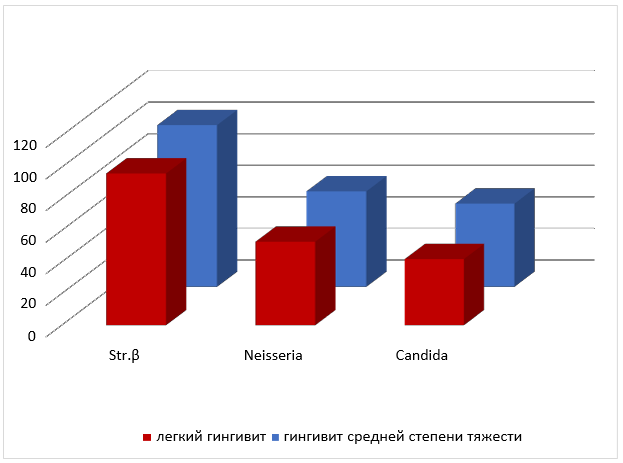
Рис. 1 Среднее количество колоний в ротовой жидкости β- гемолитических стрептококков, Neisseria, Candida albicans пациентов с хроническим катаральным гингивитом легкой и средней степени тяжести до лечения.
При сравнительном анализе данных таблицы 1 (рис. 1 и 2), следует отметить, что среднее количество колоний β-гемолитических стрептококков и случаев их обнаружения при хронических катаральных гингивитах легкой и средней степени тяжести было больше в содержимом зубодесневой борозды. Те же показатели колоний Neisseria и грибов Candida albicans, были выше в ротовой жидкости у всех обследуемых нами детей.
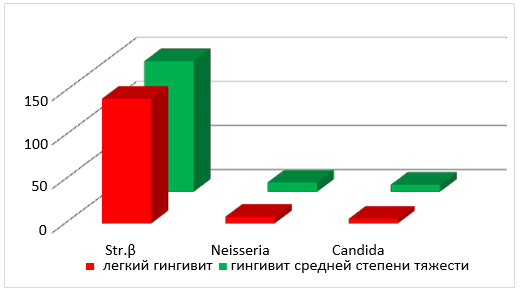
Рис. 2. Среднее количество колоний в содержимом зубодесневой борозды β-гемолитических стрептококков, Neisseria, Candida albicans пациентов с хроническим катаральным гингивитом легкой и средней степени тяжести до лечения.
Таблица 2
Среднее количество колоний β-гемолитических стрептококков, Neisseria, Candidaalbicans вротовой жидкости исодержимом зубодесневой борозды пациентов схроническим катаральным гингивитом
|
Виды бактерий |
Ротовая жидкость |
Зубодесневая борозда |
|
Str.β |
80,9 ± 4,89* |
126,3 ± 7,70* |
|
Neisseria |
55,4 ± 3,29* |
16,0 ± 0,91* |
|
Candida |
36,4 ± 2,21* |
6,1 ± 0,39* |
* р < 0,05
Независимо от степени тяжести заболевания в содержимом зубодесневой борозды чаще и в большем количестве обнаруживаются колонии β-гемолитического стрептококка (в 1,6 раза), а ротовой жидкости Neisseria (в 3,4 раза) и Candida albicans (в 6 раз) (таб. 2, рис.3).
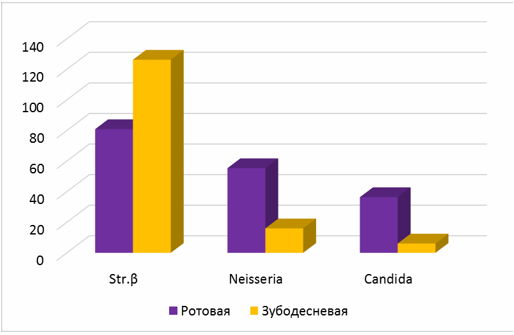
Рис. 3 Среднее количество колоний β-гемолитических стрептококков, Neisseria, Candida albicans в ротовой жидкости и содержимом зубодесневой борозды пациентов с хроническим катаральным гингивитом
Количественные микробиологические показатели микроорганизмов: стрептококки, стафилококки, микрококки, нейссерии, Corynebacterium spesits, Enterodacter species, Pseudomonas species, Candida albicans, наиболее достоверно снижались после проведения профессиональной гигиены полости рта, аналогично показателям клинических исследований. Поэтому проводили анализ динамики следующих микроорганизмов: β — гемолитических стрептококков, Neisseria, Candida albicans после проведения лечебно- профилактических мероприятий с применением иммунной терапии у подростков с хроническими катаральными гингивитами препаратом «Имудон». Данные об изменении микробиологических показателей в ротовой жидкости и в содержимом зубодесневой борозды у подростков с хроническими катаральными гингивитами до лечения и после проведения лечения представлены в таблицах 3 и 4.
Таблица 3
Среднее количество колоний β-гемолитических стрептококков, Neisseria, Candidaalbicans вротовой жидкости пациентов по этапам исследования.
|
Виды бактерий |
Этапы исследования | |||
|
До лечения |
После лечения | |||
|
Основнаягруппа |
Контрольнаягруппа |
Основнаягруппа |
Контрольнаягруппа | |
|
Str.β |
95,9 ± 0,3* |
94,1 ± 0,5* |
29,2 ± 0,4* |
34,7 ± 0,29* |
|
Neisseria |
53,0 ± 0,4* |
54,3 ± 0,4* |
4,5 ± 0,2* |
8,7 ± 0,3* |
|
Candida alb. |
41,6 ± 0,2* |
42,1 ± 0,3* |
1,9 ± 0,3* |
3,0 ± 0,3* |
* p < 0,05
Таблица 4
Среднее количество колоний β-гемолитических стрептококков, Neisseria, Candidaalbicans всодержимом зубодесневой борозды пациентов по этапам исследования
|
Видыбактерий |
Этапы исследования | |||
|
До лечения |
После лечения | |||
|
Основнаягруппа |
Контрольнаягруппа |
Основнаягруппа |
Контрольнаягруппа | |
|
Str.β |
141,2 ± 0,5* |
138,0 ± 0,5* |
16,9 ± 0,2* |
28,4 ± 0,5* |
|
Neisseria |
7,3 ± 0,3* |
6,8 ± 0,3* |
1,8 ± 0,3* |
2,8 ± 0,2* |
|
Candida alb. |
5,1 ± 0,2* |
4,9 ± 0,2* |
0,3 ± 0,3* |
1,8 ± 0,2* |
* p < 0,05
Как показано в таблицах, изменения среднего количества колоний β- гемолитического стрептококка и количества случаев его определения, как в ротовой жидкости, так и в содержимом зубодесневой борозды напрямую зависит от гигиенического состояния полости рта. То есть, с улучшением гигиенического состояния полости рта уменьшается среднее количество колоний β-гемолитического стрептококка в ротовой жидкости и уменьшается среднее количество колоний β — гемолитического стрептококка в содержимом зубодесневой борозды. Следовательно, подтверждается возможность участия β — гемолитических стрептококков, в образовании зубной бляшки.
Изменялись и количественные микробиологические показатели ротовой жидкости и содержимого зубодесневой борозды Neisseria и Candida albicans. Показатели данных видов микроорганизмов значительно снизились после проведения у детей основной группы с применением иммунной терапии препаратом «Имудон» и профессиональной гигиены полости рта, а также коррекции гигиенического состояния полости рта. Так, среднее количество колоний Neisseria в ротовой жидкости уменьшилось в 13,6 раза, в содержимом зубодесневой борозды среднее количество колоний уменьшилось в 32 раза. То есть, с уменьшением количества колоний Neisseria и Candida albicans уменьшается интенсивность воспаления десны у пациентов с хроническим катаральным гингивитом легкой или средней степени тяжести.
Таким образом, после проведения профессиональной гигиены полости рта и коррекции гигиенического состояния полости у подростков с хроническими катаральными гингивитами, с уменьшением интенсивности воспаления и улучшением гигиенического состояния полости рта изменялись и количественные микробиологические показатели исследуемых микроорганизмов. Профессиональная гигиена полости рта является эффективным методом профилактики и лечения хронических катаральных гингивитов у детей 12–15 летнего возраста при создании устойчивой мотивации пациентов на улучшение гигиенического состояния полости рта, что подтверждается проведенными нами клиническими и лабораторными исследованиями.
Литература:
- Боровский Е. В. Биология полости рта / Е. В. Боровский, В. К. Леонтьев. — Москва: Медицина, 1991. — 301 с.
- Боровский Е. В. Диагностика и лечение воспалительных заболеваний пародонта / Е. В. Боровский, Г. М. Барер, Т. И. Лемецкая // Профилактика, лечение и реабилитация воспалительных заболеваний челюстно-лицевой области: сб. науч. тр. — Москва, 1988. — С. 20–22.
- Жажков Е. Н. Комплексное лечение хронического катарального гингивита и пародонтита легкой степени с использлванием плазменного потока аргона: автореф. дис. … канд. мед. наук / Е. Н. Жажков. — Смоленск, 2000. — 20 с.
- Каргальцева Н. М. Микроскопическое исследование десневых карманов / Н. М. Каргальцева // Институт стоматологии. — 2001. — № 2. — С. 61–62.
- Кражак А. И. Лечение хронического катарального гингивита с применением календулы иммобилизованной на полисорбе / А. И. Кражак, Н. Н. Гаража // Стоматология. — 2001. — № 5. — С. 11.
- Мельниченко Э. М. Сравнительная характеристика индексов гигиены полости рта для дошкольников / Э. М. Мельниченко, Е. А. Сатыго // Новое в стоматологии. — 2000. — № 2. — С. 11–18.
- Местные факторы иммунитета, оксид азота, регенерация тканей в патогенезе пародонтита и коррекция их нарушений / Н. В. Кипиани [и др.] // Аллергология и иммунология. — 2003. — № 3. — С. 387–389.
- Орехова Л. Ю. Показатели неспецифической клеточной защиты с хронической инфекцией полости рта и нейроциркуляторной дистопией / Л. Ю. Орехова, М. Я. Левин, М. Г. Пачкория // Пародонтология. — 2004. — № 1. — С. 19–21.
- Сатыго Е. А. Состав и свойства ротовой жидкости у принимающих таблетки NaF детей с различными уровнями гигиены полости рта / Е. А. Сатыго // Стоматология. — 2000. — № 2. — С. 34.
- Судаков К. В. Иммунные механизмы системной деятельности организма: факты и гипотезы / К. В. Судаков // Иммунология. — 2003. — № 6. — С. 372–380.
- Улитовский С. Б. Гигиена полости рта, как метод профилактики заболеваний пародонта / С. Б. Улитовский // Новое в стоматологии. — 2000. — № 4. — С. 32–40.

