Проведено комплексное изучение уровня инфекционной безопасности донорской крови и факторов, ассоциированных с наличием маркеров парентеральных инфекций (анти-ВИЧ, анти-ВГС и HBsAg) среди донорской популяции.
Оценена чувствительность и специфичность тестирования донорской крови на anti-HIV, anti-HCV, anti-Паллидум и HBsAg в лаборатории Республиканского Центра Крови, после чего проводили сравнение чувствительности тестирования донорской крови на парентеральные инфекции до и после внедрения системы контроля качества в лабораторную службу Центра крови.
Сравнительный анализ качества лабораторной диагностики в РЦК показал, что чувствительность тестирования донорской крови на маркеры парентеральных инфекций составила: анти-ВГС (92,1 %), HBsAg (97,6 %) и анти-паллидум (20,4 %).
Повышение чувствительности тестирования на маркеры вирусных гепатитов является статистически значимым и свидетельствует об эффективности внедрения системы контроля качества лабораторной диагностики в РЦК, осуществляемой при технической поддержке СиДиСи/ЦАР и Министерства здравоохранения КР.
Ключевые слова: гемотрансмиссивные инфекции, безопасная кровь, чувствительность, маркеры
В последние годы во многих странах возникли трудности с набором и сохранением донорских кадров, связанные с резким ростом инфекций, связанных с гемотрансфузиями: гепатита В и С, СПИДа, сифилиса (1–6, 9–10).
В многочисленных как отечественных, так и зарубежных публикациях (7- 9) отмечается, что одним из факторов повышенного риска передачи гемотрансмиссивных инфекций являются первичные доноры.
Этот контингент лиц (в основном, люди молодого возраста) составляет большинство т. н. “семейных” доноров, предлагающих свою кровь для больных, получающих лечение в Национальном хирургическом центре МЗ КР.
Однако, известно, что именно эти доноры крови подвержены риску заражения инфекционными агентами пропорционально распространенности заболевания среди населения страны. Наблюдается также значительное повышение частоты HBsAg- носителей среди первичных доноров (14), а среди HBsAg-негативных доноров выявлен существенный уровень анти-НВс IgM-позитивных лиц.
В связи с этим, обеспечение вирусной безопасности крови и ее компонентов, в частности, для хирургического центра с высокой операционной активностью, является важнейшей совместной задачей как хирургов, так и службы крови, в частности, в аспекте изучения встречаемости и анализа динамики выявления маркеров гемотрансмиссивных инфекций, особенно при отборе перспективных первичных доноров (11–14).
В целях оценки состояния инфекционной безопасности донорской крови в Кыргызской Республике, на базе Республиканского Центра Крови (РЦК) Министерства здравоохранения КР, при содействии и непосредственном участии специалистов Национального центра хирургии МЗ КР, а также регионального офиса Центров по контролю и профилактике заболеваний (CDC) в Центральной Азии, было проведено специальное исследование, задачами которого были:
- Оценить уровень инфекционной безопасности донорской популяции, которая прошла обследование и сдала кровь как в РЦК, так и в выездных условиях
- Определить факторы, ассоциированные с наличием маркеров парентеральных инфекций (анти-ВИЧ, анти-ВГС и HBsAg) среди донорской популяции
- Оценить чувствительность и специфичность тестирования донорской крови на anti-HIV, anti-HCV, anti-Паллидум и HBsAg в лаборатории Республиканского Центра Крови
- Сравнить чувствительность тестирования донорской крови на парентеральные инфекции до и после внедрения системы контроля качества в лабораторную службу Центра крови
Материал иметоды:
Контингент: С апреля по июнь 2012 г. на базе Республиканского Центра крови и в выездных условиях было собрано 2500 образцов сывороток крови доноров. В исследуемую группу вошли все доноры, сдавшие кровь однократно за этот период, независимо от их типа (доноры крови или/и плазмы) и вида (безвозмездные, платные, и доноры-родственники для больных Национального центра хирургии МЗ КР). Для забора крови у доноров использовали закрытые системы одноразового пользования (гемаконы).
Анкетирование: Сбор эпидемиологических данных проводили на основе специально разработанной анкеты. Анкета включала демографические данные и возможные факторы риска инфицирования доноров крови.
Было собрано 843 заполненных вопросника на отстраненных доноров на до-лабораторном этапе с целью описания донорской популяции, что составило 33,7 % от общего числа опрошенных доноров. Вопросник включал демографические данные, а также причину отстранения (временную или постоянную) от дачи крови.
Получение образца сыворотки крови: По окончании забора крови в гемакон, после получения согласия донора, согласно разработанным операционным процедурам, дополнительно собирали кровь в 2 пробирки-спутника и в пробирку в объеме 8 мл для проведения данного исследования.
Каждый собранный образец сыворотки крови делили на 2 аликвота. Одну часть использовали для рутинного скрининга в лаборатории Центра крови; другую, предназначенную для исследования в Национальной Референс-лаборатории МЗ КР, помещали в специально предназначенные контейнеры «Nalgene», которые замораживали при температуре -30˚С. Исследуемые образцы шифровались согласно правилам “анонимного связанного тестирования”. По завершении сбора 2500 образцов сывороток крови, они одномоментно были переданы в Референс-лабораторию, согласно разработанному СОПу с заполнением акта приема передачи и с соблюдением холодового режима. Функция референс-лаборатории была возложена на Центр контроля качества лабораторной диагностики инфекционных болезней.
Тестирование образцов сывороток крови доноров влаборатории Республиканского Центра крови.
Использованные тест-системы
В лаборатории Центра крови исследуемые образцы (n=2500) были тестированы методом ИФА, при использовании тест-систем Российского производства:
‒ anti-HIV «РекомбиБест анти-ВИЧ 1, 2» (серии 897, 929, 959), производитель «Вектор Бест», г. Новосибирск; «ИФА-анти-ВИЧ унифицированная» (серия 3), производитель НПО «Диагностические Системы», г. Нижний Новгород.
‒ anti-HCV «РекомбиБест анти-ВГС» (серии 1067, 1540, 1547, 1593, 1594, 1656), производитель «Вектор Бест», г. Новосибирск.
‒ HBsAg «Вектогеп В — HBs антиген» (серии 1051, 1052, 1067, 1072, 1074), производитель «Вектор Бест», г. Новосибирск.
Диагностика сифилиса осуществлялась методом микрореакции и РПГА в клинико-биохимической лаборатории.
Обеспечение контроля качества исследований, проведенных в лаборатории Центра крови
Входной контроль тест-систем для диагностики ВИЧ инфекции каждой серии проводился в РО СПИД, после чего тест-системы централизованно поступали в центры крови. Входной контроль тест-систем для диагностики вирусных гепатитов В и С каждой серии проводился в Центре контроля качества лабораторной диагностики инфекционных болезней (ЦККЛДИБ) согласно договору между РЦК и ЦККЛДИБ.
Внутрилабораторный контроль качества проводился ежедневнопри каждой постановке, с использованием внутрилабораторных стандартных образцов на анти-ВИЧ, анти-ВГС собственного производства; внутрилабораторные стандартные образцы на HBsAg получали из ЦККЛДИБ.
Тестирование образцов сывороток крови доноров вРеференс-лаборатории
Контрольный скрининг аналогичных образцов сывороток крови доноров (n=2500) проводили на базе ЦККЛДИБ в три этапа:
I этап— скрининг 2500 образцов сывороток крови доноров методом ИФА, с использованием тест-систем Российского производства:
‒ anti-HIV «КомбиБест анти-ВИЧ 1+2» (набор 2), серия 946, производитель «Вектор Бест» г. Новосибирск *
‒ anti- HCV «РекомбиБест анти-ВГС-стрип», серия 1656, производитель «Вектор Бест» г. Новосибирск *
‒ HBsAg «Вектогеп В-HBs-антиген стрип» (комплект 3), серия 1100, производитель «Вектор Бест» г. Новосибирск *
‒ anti-Luis «РекомбиБест антипаллидум-суммарные антитела» (комплект 2), серия 1090, производитель «Вектор Бест» г. Новосибирск *
II этап— все положительные образцы крови доноров + 10 % из числа отрицательных образцов, тестировали методом ИФА, при использовании экспертных тест-систем:
‒ anti-HIV «Murex anti-HIV 1.2.0», серия L 101110, производитель «ABBOTT GmbH & Co KG», Великобритания. *
‒ anti-HCV «Murex anti-HCV version 4», серия 7F 51–01, производитель «ABBOTT GmbH & Co KG», Южная Африка. *
‒ HBsAg «Murex HBsAg version 3», серия H 098110, производитель «ABBOTT GmbH & Co KG», Великобритания *
‒ anti-Luis «Murex ICE Syphilis», серия L 130110, производитель «ABBOTT GmbH & Co KG», Великобритания *
III этап— образцы, в которых подтверждено наличие маркера anti-HIV в экспертной тест-системе протестированы в иммуноблоте «Naw IAV BLOT I», производитель «BIO-RAD», США.* [1]
Обеспечение контроля качества исследований, проведенных в Референс лаборатории
Качество результатов обеспечивалось соблюдением правил и условий проведения пре-аналитического, аналитического и пост-аналитического этапов лабораторного исследования и контролировалось с помощью выполнения программы внутрилабораторного контроля качества, включающего:
- «входной» контроль тест-систем на anti-HIV, anti-HCV, HBsAg с использованием внутрилабораторных референс — панелей сывороток для оценки диагностической эффективности тест-систем, содержащих:
‒ Позитивные и негативные образцы на анти-ВИЧ
‒ Позитивные и негативные образцы на анти-ВГС
‒ Позитивные и негативные образцы на HBsAg
‒ Позитивные и негативные образцы на анти-Паллидум
- Использование низкотитражных внутрилабораторных стандартов при каждой постановке для выявления недопустимых погрешностей и оценки степени точности проводимых исследований.
Использование системы внутрилабораторного контроля качества позволило гарантировать надежность полученных результатов.
Все референс — панели и стандартные образцы были разработаны и аттестованы в ЦККЛИДБ согласно требований ISO (GUIDE 34–35) и ВОЗ (WHO Working/Report 3. — Geneva — 2000). Референс-панель сывороток на HBsAg была откалибрована по международному стандарту HBsAg NIBS 00/588.
Значения равные или выше оптической плотности критического уровня учитывали как положительные, т. е. содержащие исследуемые маркеры. Значения ниже ОП критического уровня учитывали как отрицательные, т. е. не содержащие исследуемые маркеры.
Чувствительность и специфичность использованных тест-систем была определена как 100 % при входном контроле качества. Выявление случайных и систематических погрешностей при постановке ИФА проводили по внутрилабораторным позитивным стандартам и учитывали при построении контрольной карты Шухарта, с применением правил Вестгарта. Данные контрольных измерений погрешности, впоследствии были проанализированы и устранены.
Определение чувствительности испецифичности (Таблица 4-х полей)
Испытуемая
Система (ЦК)

Чувствительность — способность системы выявлять истинно положительные результаты. Формула: А/(А+С) х 100%
Специфичность— способность испытуемой системы выявлять истинно отрицательные результаты. Формула: D/(D+B) x 100%
Определение “положительных” случаев на основании лабораторного тестирования
‒ ВИЧ положительными считали доноров, у которых положительные результаты скринингового и экспертного тестов ИФА подтверждались в иммуноблоте.
‒ HBsAg, анти-ВГС, анти-Паллидум положительными считали доноров, у которых положительные результаты скринингового теста в ИФА подтверждались экспертным тестом в ИФА
Ввод иобработка данных
По результатам анкетирования доноров крови была создана база данных. Статистический анализ демографических данных и факторов риска инфицирования доноров проводили с использованием компьютерной программы EpiInfo 2000.
Результаты исследования
Факторы, ассоциированные с наличием маркеров парентеральных инфекций среди доноров крови
Характеристика донорской популяции
Всего было исследовано 2500 доноров, из них 1507 (60,3 %) — жители г. Бишкека и 993 (39,7 %) жители других населенных пунктов; из них 72,4 % составили мужчины (1810/2500). Большинство 1601 (64 %) исследуемых доноров, составили люди, пришедшие в Центр крови, и лишь 899 (36 %) доноров было обслужено в выездных условиях. Минимальный возраст доноров был равен 18 годам, максимальный — 60 лет, медиана возраста — 28 лет, мода — 20 лет. Наибольшее количество доноров наблюдается в возрастных группах от 18 до 30 лет (55,2 %), рис. 1.
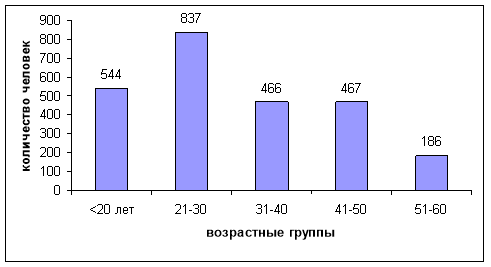
Рис. 1. Возрастное распределение абсолютного количества доноров (n=2500)
Доля доноров с первой группой крови составила 34 %, второй группы — 29,5 %, третьей группы — 28 %, и четвертой группы — 8,5 %. Положительный резус — фактор был у 93,6 % доноров.
По типу сдачи крови платные доноры составили 12,6 %, доноры-родственники — 49,9 %, безвозмездные — 37,5 %.
54 % доноров имели среднее и среднее специальное образование, 43 % — высшее и неоконченное высшее образование, и почти 3 % — неполное среднее образование.
В качестве мотивации для донорства, 84,1 % доноров указывали на желание помочь больному, 12,3 % — получить деньги, 3,6 % доноров указали другие причины.
Данные распространенности ВИЧ, вирусных гепатитов В и С, антител к сифилису и повышенного уровня АЛТ представлены на рис. 2.
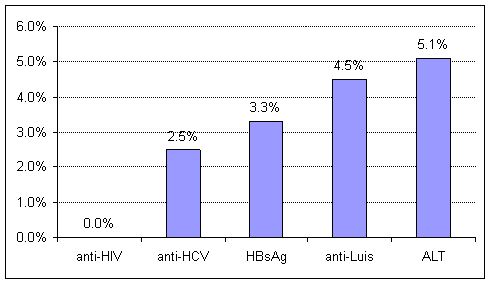
Рис. 2. Процент распространенности случаев anti-HIV, anti- HCV, HBsAg, anti-Паллидум и АЛТ среди доноров крови, г. Бишкек, апрель-июль 2012 г.
Возраст отстраненных доноров составил от 18 до 59 лет (средний возраст 34,0±11,4), из них 52,9 % составили мужчины (446/843). Из числа 843 отстраненных доноров, большинство, то есть 510 человек (60,5 %) были жителями г. Бишкека.
Большинство из них (676 человек, т. е. 80,2 %) имели постоянную работу.
По роду занятий большинство отстраненных доноров были медработники — 23 % (157/843); студенты — 17,7 % (119/843); служащие — 16,6 % (112/843) и военнослужащие -10,8 % (73/843).
При изучении мотивации среди отстраненных доноров 80,7 % человек указывали на желание помочь больному; в получении денег было заинтересовано 12,6 % потенциальных доноров. Большинство отстраненных доноров — это первичные доноры 65,8 % (555/843); доноры — родственники — 50,4 % и безвозмездные доноры — 36,9 %. Наиболее частой причиной отстранения было “временное отстранение от кроводачи” — 62,1 % (522/843). В структуре причин отстранения доминирующую долю занимают следующие группы причин: соматические — 38,7 %; анемия — 23,1 %; недавние хирургические вмешательства — 5,1 %; перенесенный в анамнезе вирусный гепатит — 5 % и низкий вес — 2,1 %. На базе РЦК за время исследования было отстранено 539 человек, что составляет 63,9 % от общего числа отстраненных доноров. Доля отстраненных от кроводачи в условиях РЦК и на выезде была примерно одинакова — 25 % и 25,3 %, соответственно.
Распространенность anti-HIV среди различных групп доноров
Среди исследуемой популяции доноров не было ни одного случая anti-HIV ИФА положительного, подтвержденного в иммуноблоте. Согласно определению случая ВИЧ — инфекции в данном исследовании не было ни одного ВИЧ-инфицированного донора.
Распространенность anti-HCV среди различных групп доноров
Среди исследуемой популяции доноров было выявлено 63 анти-ВГС положительных человека. Из этого числа анти-ВГС положительных доноров, двое были исключены из дальнейшего анализа ввиду наличия у них второго маркера — HBsAg, что помешало бы определить ассоциацию именно с наличием анти-ВГС. В группу сравнения вошло 2355 доноров, у которых не было обнаружено анти-ВГС и HBsAg. В таблице 1 представлены факторы, ассоциированные с наличием антител к ВГС, которые имели статистическую значимость в моновариабельном анализе.
Как видно из таблицы, распространенность анти-ВГС выше среди лиц, получавших переливание крови в анамнезе (ОР 4,4; 95 %ДИ 1,8–10,6); подвергавшихся оперативному лечению (ОР 1,8; 95 %ДИ 1,1–3,1); имевших в анамнезе факт задержания правоохранительными органами (ОР 2,4; 95 %ДИ 1,1–5,3); находившихся в местах лишения свободы (ОР 9,3; 95 %ДИ 2,6–33,6); среди лиц, не имеющих высшего образования (ОР 1,9; 95 %ДИ 1,1–3,2).
Повышенный уровень АЛТ во время тестирования ассоциировался с наличием анти-ВГС (ОР 5,0; 95 % ДИ 2,6–9,7). Распространенность анти-ВГС была ниже в возрастной группе доноров до 30 лет (ОР 0,44; 95 % ДИ 0,26–0,73); в группе доноров, сдающих кровь на регулярной основе (ОР 0,2; 95 % 0,03–1,4).
С целью исключения возможного влияния факторов смешивания был проведен многофакторный анализ.
В таблице 2 представлены факторы, имеющие статистическую значимость в многофакторном анализе. Значимыми факторами, ассоциированными с наличием анти-ВГС были установлены следующие: получение переливания крови в анамнезе (ОР 126,8; 95 %ДИ 13,8–1164,4); факт задержания правоохранительными органами (ОР 7,0; 95 %ДИ 1,3–37,8), повышенный уровень АЛТ (ОР 6,3; 95 %ДИ 1,1–35,2). При этом, регулярность донаций крови является “защитным” фактором (ОР 0, 3; 95 % ДИ 0, 1–0,96).
Таблица 1
Факторы, ассоциированные сналичием анти-ВГС среди доноров (моновариабельный анализ)
|
Факторы риска |
размер группы, (n) |
инфицированные, n (%) |
ОР |
95% ДИ |
р |
|
Получали переливание крови |
63 |
6 (9, 5 %) |
4,4 |
1,8–10,6 |
0,0001 |
|
Не получали переливание крови |
2355 |
55 (2, 3 %) | |||
|
Было оперативное лечение в анамнезе |
521 |
20 (3, 8 %) |
1,8 |
1,1–3,1 |
0,03 |
|
Не было оперативного лечения в анамнезе |
1897 |
41 (2, 2 %) | |||
|
Регулярно сдают кровь |
212 |
1 (0, 5 %) |
0,2 |
0,03–1,4 |
0,06 |
|
Не регулярно сдают кровь |
974 |
24 (2, 5 %) | |||
|
Были ли задержаны правоохранительными органами |
145 |
8 (5, 5 %) |
2,4 |
1,1–5,3 |
0,02 |
|
Не были задержаны правоохранительными органами |
2273 |
53 (2, 3 %) | |||
|
Повышенный уровень АЛТ |
122 |
12 (9,8 %) |
5,0 |
2,6–9,7 |
<0,0001 |
|
Нормальный уровень АЛТ |
2296 |
49 (2,1 %) | |||
|
Были ли в местах лишения свободы |
16 |
3 (18,8 %) |
9,3 |
2,6–33,6 |
0,0001 |
|
Не были в местах лишения свободы |
2402 |
58 (2,4 %) | |||
|
Делали татуировку |
166 |
7 (4,2 %) |
1,8 |
0,8–4,0 |
0,15 |
|
Не делали татуировку |
2252 |
54 (2,4 %) | |||
|
Сами себе могут делать инъекции |
256 |
9 (3,5 %) |
1,5 |
0,7–3,04 |
0,28 |
|
Не могут делать себе инъекции |
2161 |
52 (2,4 %) | |||
|
Возраст до 30 лет |
1321 |
21 (1,6 %) |
0,4 |
0,3 -0,7 |
0,001 |
|
Возраст более 30 лет |
1097 |
40 (3,6 %) | |||
|
Образование среднее |
1371 |
43 (3,1 %) |
1,9 |
1,1 -3,2 |
0,03 |
|
Образование высшее и неоконченное высшее |
1047 |
18 (1,7 %) |
Таблица 2
Факторы, ассоциированные сналичием анти-ВГС среди доноров (многофакторный анализ)
|
Вероятные факторы риска |
ОР |
НГ 95%ДИ |
ВГ 95%ДИ |
Р |
|
Получение переливания крови в анамнезе |
126,8 |
13,8 |
1164,4 |
<0,0001 |
|
Регулярные донации крови |
0,3 |
0,1 |
0,96 |
0,04 |
|
Были задержаны правоохранительными органами |
7,0 |
1,3 |
37,8 |
0,02 |
|
Повышенный уровень АЛТ |
6,3 |
1,1 |
35,2 |
0,04 |
Распространенность HBsAg среди различных групп доноров
При исследовании сывороток крови, полученных от доноров, было обнаружено 82 сыворотки с наличием HBsAg. Из анализа было исключено 2 HBsAg-позитивных случая ввиду наличия также антител к ВГС. Таким образом, в исследование вошло 80 человек — случаев, контрольной группой было 2357 доноров, чьи сыворотки не содержали анти-ВГС и HBsAg.
В таблице 3 представлены изучаемые факторы, ассоциированные с наличием HBsAg, имеющие статистическую значимость в моновариабельном анализе. Распространенность HBsAg была статистически выше среди доноров, впервые сдающих кровь (ОР 2,9; 95 %ДИ 1,7–4,8); среди мужчин (ОР 4,1; 95 %ДИ 1,9–8,9); среди лиц возрастной группы до 30 лет (ОР 2,6; 95 %ДИ 1,6–4,3); среди военных (ОР 4,1; 95 %ДИ 2,5–6,4). Распространенность HBsAg была статистически ниже среди доноров, сдающих кровь на регулярной основе (ОР н/о; р<0,04); состоящих в браке (ОР 0,6; 95 %ДИ 0,4–0,95); проживающих в г. Бишкек (ОР 0,3; 95 %ДИ 0,2–0,6); лиц, сдававших кровь на базе РЦК (ОР 0,6; 95 %ДИ 0,4–0,9).
Таблица 3
Факторы, ассоциированные сналичием HBsAg среди доноров (моновариабельный анализ)
|
Факторы риска |
Число обследованных, n |
Инфицированные n (%) |
ОР |
95%ДИ |
р |
|
Впервые сдают кровь |
1258 |
60 (4,8 %) |
2,9 |
1,7–4,8 |
0,0001 |
|
Повторно сдают кровь |
1179 |
20 (1,7 %) | |||
|
Регулярно сдают кровь |
211 |
0 |
Не определено |
Не определено |
0,04 |
|
Не регулярно сдают кровь |
970 |
20 (2,1 %) | |||
|
Состоят в браке |
1177 |
29 (2,5 %) |
0,6 |
0,4–0,95 |
0,03 |
|
Не состоят в браке |
1897 |
41 (2,2 %) | |||
|
Имеют внебрачные отношения |
96 |
5 (5,2 %) |
2,4 |
0,9–6,5 |
0,07 |
|
Не имеют внебрачных отношений |
974 |
24 (2,5 %) | |||
|
Живут в Бишкеке |
1467 |
28 (1,9 %) |
0,4 |
0,2 -0,6 |
0,0001 |
|
Живут в другом населенном пункте |
970 |
52 (5,4 %) | |||
|
Имеют медицинское образование |
320 |
5 (1,6 %) |
0,4 |
0,2 -1,1 |
0,06 |
|
Не имеют медицинского образования |
2117 |
75 (3,5 %) | |||
|
Сдавали кровь в Центре крови |
1561 |
41 (2,6 %) |
0,6 |
0,4 -0,9 |
0,02 |
|
Сдавали кровь в выездных условиях |
2402 |
58 (2,4 %) | |||
|
Мужчины |
1767 |
73 (4,1 %) |
4,1 |
1,9–8,9 |
0,0001 |
|
Женщины |
670 |
7 (1 %) | |||
|
Возраст менее 30 лет |
1159 |
59 (4,3 %) |
2,6 |
1,6–4,3 |
0,0001 |
|
Возраст более 30 лет |
1078 |
21 (1, 9 %) | |||
|
Военные |
383 |
33 (8, 6 %) |
4,1 |
2,5–6,4 |
0,0001 |
|
Прочие специальности |
2054 |
47 (2, 3 %) |
С целью нивелирования роли факторов смешивания был проведен многофакторный анализ (данные приведены в таблице 4).
Факторы, ассоциированные с наличием HBsAg, имеющие статистическую значимость в многофакторном анализе — это мужской пол (ОР 2,8; 95 %ДИ 1,2–6,4) и военные по профессии (ОР 2,7; 1,5–4,7). Из общего числа доноров, вошедших в исследование, военнослужащие составили 391 человек, из них 73,9 % (289/391) сдавали кровь в выездных условиях. HBsAg был выявлен у 8, 7 % доноров (34/391). Распространенность HBsAg среди военнослужащих возрастной группы 18–22 года, которые могут быть новобранцами, составила 8,9 % (25/280); и в возрастной группе более 22 лет — 8,1 % (9/111).
Таблица 4
Факторы, ассоциированные сналичием HBsAg среди доноров (многофакторный анализ)
|
Вероятные факторы риска |
ОР |
НГ 95%ДИ |
ВГ 95%ДИ |
р |
|
Мужской пол |
2,8 |
1,2 |
6,4 |
0,02 |
|
Военнослужащие |
2,7 |
1,5 |
4,7 |
0,01 |
Чувствительность тестирования донорской крови
Чувствительность тестирования на ВИЧ инфекцию
При лабораторном исследовании 2500 образцов сывороток крови в Референс лаборатории, антитела к ВИЧ выявлены не были (табл. 5). В лаборатории Центра крови 10 образцов сывороток доноров были определены как положительные (ложноположительные). Специфичность тестирования в Центре крови составила 99,6 % по отношению к результатам Референс-лаборатории.
Таблица 5
Сопоставление результатов тестирования образцов сывороток крови доноров на анти-ВИЧ
|
Лаборатория Центра крови |
Референс лаборатория |
Всего | |
|
Положит. |
Отрицат. | ||
|
Положит. |
0 |
10 |
10 |
|
Отрицат. |
0 |
2490 |
2490 |
|
Всего |
0 |
2500 |
2500 |
Чувствительность тестирования на гепатит С
Антитела к вирусу гепатита С выявлены у 63/2500 (2,6 %) доноров крови. Чувствительность тестирования на анти-ВГС в Центре крови составила 92,1 % (58/63) (табл. 6). Специфичность тестирования донорской крови в лаборатории Центра крови составила 98,6 %.
Таблица 6
Сопоставление результатов тестирования образцов сывороток крови доноров на anti-HCV
|
Лаборатория Центра крови |
Референс лаборатория |
Всего | |
|
Положит. |
Отрицат. | ||
|
Положит. |
58 |
34 |
92 |
|
Отрицат. |
5 |
2403 |
2408 |
|
63 |
2437 |
2500 | |
Чувствительность тестирования на поверхностный антиген вируса гепатита В
Поверхностный антиген вируса гепатита В (HBsAg) был определен у 82/2500 (3,3 %) доноров. Чувствительность тестирования на HBsAg, проведенного в лаборатории Центра крови, составила 97,6 % (80/82), а специфичность — 98,3 % (табл. 7).
Таблица 7
Сопоставление результатов тестирования образцов сывороток крови на HBsAg
|
Лаборатория Центра крови |
Референс лаборатория |
Всего | |
|
Положит. |
Отрицат. | ||
|
Положит. |
80 |
41 |
121 |
|
Отрицат. |
2 |
2377 |
2379 |
|
82 |
2418 |
2500 | |
Чувствительность тестирования на анти-Паллидум
Маркер анти-Паллидум определен у 4,5 % (113/2500) доноров. Чувствительность тестирования в лаборатории Центра крови составила 20, 4 % (23/113), а специфичность — 99,9 % (табл. 8).
Таблица 8
Сопоставление результатов тестирования образцов сывороток крови доноров на анти-Паллидум
|
Лаборатория Центра крови |
Референс лаборатория |
Всего | |
|
Положит. |
Отрицат. | ||
|
Положит. |
23 |
1 |
24 |
|
Отрицат. |
90 |
2386 |
2476 |
|
113 |
2387 |
2500 | |
Обобщенная оценка результатов тестирования лаборатории Центра крови
Сравнительный анализ тестирования 2500 образцов показал довольно высокую чувствительность системы скрининга донорской крови на маркеры анти-ВГС (92,1 %), HBsAg (97,6 %) и очень низкую чувствительность тестирования на анти-Паллидум (20,4 %) по отношению к результатам тестирования в Референс лаборатории (таблица 9).
При сравнении результатов чувствительности данного исследования с результатами базовой оценки, повышение чувствительности является статистически значимым. Так, для анти-ВГС чувствительность тестирования была 78 % (p<0, 001), а для HBsAg — составляла 51 % (p<0, 0001).
Таблица 9
Сравнительный анализ качества тестирования донорской крови вусловиях лаборатории Центра крови иРеференс лаборатории
|
Маркеры |
Кол-во положительных образцов (Референс лаборатория) |
Кол-во положительных образцов (Центр крови) |
Чувствительность |
|
anti-HIV |
0 |
0 |
100 % |
|
anti-HCV |
63 |
58 |
92,1 % |
|
HBsAg |
82 |
80 |
97,6 % |
|
anti-Паллидум |
113 |
23 |
20,4 % |
Поскольку образцы тестируются на несколько инфекций, не все ложноотрицательные образцы были выданы в лечебные учреждения для их клинического использования (таблица 10).
Таблица 10
Использование крови иее компонентов, собранных от доноров, инфицированных гепатитами В, Си сифилисом
|
Распределение донорской крови (Центр крови) |
Маркеры, выявленные вобразцах крови доноров (Референс Лаборатория) |
Всего | |||
|
anti-HIV |
anti-HCV |
HBsAg |
anti-Паллидум | ||
|
+ |
+ |
+ |
+ | ||
|
Кровь/компоненты, выданные в лечебные учреждения |
0 |
4 |
2 |
87 |
93 |
|
Образцы крови, уничтоженные в результате контаминации по нескольким инфекциям или другой причины брака |
0 |
59 |
80 |
26 |
165 |
|
Всего |
0 |
63 |
82 |
113 |
258 |
Выводы
- Распространенность маркеров парентеральных инфекций продолжает оставаться одним из наиболее значимых качественных индикаторов отбора доноров крови
- Согласно результатам нашего исследования, чувствительность тестирования донорской крови в лаборатории РЦК на анти-ВИЧ, анти-ВГС, HBsAg и анти- Паллидум составила 100 %, 78 %, 51 % и 23 %, соответственно.
- Распространенность маркеров парентеральных инфекций среди изучаемой популяции доноров (2500 человек) составила для анти-ВИЧ, анти-ВГС, HBsAg и анти-Паллидум 0 %, 4 %, 4 % и 5 %, соответственно. Установлено достоверное снижение распространенности анти-ВГС среди донорской популяции с 4 % в 2004 г. до 2,5 % в 2008 г., соответственно (p < 0, 01).
- Анализ качества лабораторной диагностики в РЦК показал, что 3,4 % донорской крови отбраковывается в результате ложноположительных тестов на парентеральные инфекции (ВИЧ, ВГС и ВГВ).
-
Установлено, что система отбора доноров на сегодняшний день не может считаться достаточно эффективной, так как:
-
выявлена ассоциация наличия анти-ВГС со следующими факторами:
- получением переливания крови в анамнезе,
- пребыванием в местах лишения свободы
-
установлена ассоциация HBsAg с такими факторами как
- мужской пол
- профессия (среди военнослужащих распространенность HBsAg была статистически выше).
-
выявлена ассоциация наличия анти-ВГС со следующими факторами:
- Донорство крови на регулярной основе является благоприятным фактором в плане динамического прослеживания маркеров инфицирования парентеральными инфекциями.
- Сравнительный анализ качества лабораторной диагностики в РЦК показал, что чувствительность тестирования донорской крови на маркеры парентеральных инфекций составила: анти-ВГС (92,1 %), HBsAg (97,6 %) и анти-Паллидум (20,4 %).
- Повышение чувствительности тестирования на маркеры вирусных гепатитов является статистически значимым по сравнению с результатами исследования в 2004 г. и свидетельствует об эффективности внедрения системы контроля качества лабораторной диагностики в РЦК, осуществляемой при технической поддержке СиДиСи/ЦАР и Министерства здравоохранения КР. Наиболее вероятной причиной низкого качества скрининга донорской крови на сифилис, является использование учреждениями службы крови низко-чувствительных методов диагностики (микро-реакций).
Рекомендации:
- Необходимо усовершенствовать процесс отбора доноров на “предлабораторном” этапе в соответствии с существующими нормативно-правовыми документами. Следует включить в типовую анкету донора вопрос о фактах задержания правоохранительными органами и/или заключения в местах лишения свободы, а также включить этот вопрос в обязательном порядке при осмотре потенциального донора врачом-терапевтом перед донацией
- Пересмотреть целесообразность привлечения военнослужащих к донорству, учитывая высокую (статистически достоверную) распространенность HBsAg в данной популяции доноров. Безусловно, контингент таких доноров составляет группу относительного риска
- Сконцентрировать усилия на развитии стратегии регулярного безвозмездного донорства на национальном уровне, поскольку распространенность маркеров парентеральных инфекций значительно ниже именно среди доноров, сдающих кровь на регулярной основе
- Стимулировать участие лабораторий скрининга крови в программах внутреннего и внешнего контроля качества
- Проводить скрининг донорской крови на сифилис методом ИФА
- С целью уменьшения ложноположительных результатов тестирования на парентеральные инфекции, осуществить переход на использование аттестованных ВОЗ панелей тест-систем
Литература:
- Голосова Т. В., Никитин И. К. Гемотрансмиссивные инфекции, 2003, М., Медицинское информационное агентство, с. 192
- Голосова Т. В., Бондаренко И. А. Трансфузионные инфекции: эпидемиология, диагностика в службе крови; Вестник службы крови России, 2007, 1, с. 16–21
- Ярославцева Н. Г., Багрянцева С. Ю., Голосова Т. В., Гуляева А. А. и др., Частота выявления маркеров ВИЧ и вирусов гепатитов у доноров и в компонентах и в препаратах плазмы (в ИФА и ПЦР), Вестник службы крови России, 2005, 2, с. 28–34
- Голосова Т. В., Филатов Ф. П., Общие принципы национальной концепции вирусной безопасности гемотрансфузий; Гематология и трансфузиология, 2001, 3, с. 84–86
- Голосова Т. В., Сомова А. В., Туполева Т. А., Филатов Ф. П., Тестирование доноров и эволюция посттрансфузионного гепатита; Российский журнал гастроэнторологии, гепатологии, копропроктологии, 1999, 1, с. 32–36
- Голосова Т. В. Современное состояние проблемы ВИЧ-инфекции и ее диагностика; Вестник службы крови России, 1998, 3, 23–25
- Жибурт Е. Б., Караваев А. А., и др., Особенности национальной оценки риска передачи инфекций при переливании крови; Вестник Росздравнадзора, 2013, 1, с. 75–77
- Красняков В. К., Гемотрансмиссивные инфекции у доноров Санкт-Петербурга; Актуальные вопросы гематологии и трансфузиологии; Матер. Рос. Научн.-практич. конференции СПб, 2004, с. 129
- Скрининг донорской крови на гемотрансмиссивные инфекции. Рекомендации ВОЗ, 2010, с. 83
- Offergeld R., Ritter S., Hamouda O., HIV, HCV, HBV and syphilis surveillance among blood donors in Germany, 2008–2010; Bundesgesundheitsblatt, 2012, Aug., 55 (8): 907–13
- Shah SM, Khattak IU, Ali A., Tariq M., Seropositivity for hepatitis B and C in voluntary blood donors; J. Ajub Med Coll Abbottabad, 2010, JulySeptember; 22 (3), 149–51
- Zou S., Stramer SL., et al; Current incidence and residual risk of hepatitis B infection among blood donors in the United States; Transfusion, 2009, Aug., 49 (8): 1609–20
- Zaller N., Nelson KE, et al., Demographic characteristics and risks for TTI among blood donors in Xianjiang autonomous region, PRC; Transfusion, 2006, Feb., 46 (2); 265–7
- Niamh Mullen, Majority of TTI from first time donors; Medical Observer, 2012, Nov.
[1] Все помеченные * тест-системы предоставлены CDC/CAR

