В экспедиции по степи Крыма был определен уровень колонизации корней культурных и дикорастущих растений грибами арбускулярной микоризы. Для исследования выбраны виды интенсивно образующие микоризу. Определено, что частота встречаемости микоризной колонизации изменялась от 0 до 96,2 %. В целом при продолжении полива из местных источников подземных и надземных вод и благодаря нормальным гидротермическим условиям 2016 года отличия в частоте встречаемости микоризации корней растений были вызваны видовым составом исследуемых популяций. Очень низкая частота встречаемости отмечена в вариантах с неправильной агротехникой и организацией орошения, а также болезнями растений.
Ключевые слова: грибы арбускулярной микоризы, колонизация, почвы степи Крыма, орошение
Введение в эксплуатацию Северо-Крымского канала (СКК) в 1964 году привело к увеличению поливных земель до 400 тыс. га (максимальная загрузка в 80-е годы), введению в эксплуатацию ранее неиспользованных земель северного Крыма, повышению уровня грунтовых вод и засолению некоторых агроландшафтов. После остановки подачи воды в русло СКК многие поливные культуры (рис, соя, кукуруза и др.) были выведены из севооборотов, и заменены на более засухоустойчивые (подсолнечник, сорго, рапс и др.). Некоторые сельхозпроизводители, выращивающие овощные и садовые культуры, перешли на орошение водных ресурсов местного стока и подземных источников с различным уровнем солености. Это может приведет к изменениям водного и солевого баланса почв полуострова, что коснется всех экосистем и ее компонентов, в том числе и микробиоты.
Грибы, особенно микроскопические, наверное, самые недооцененные и наименее исследованные организмы [9]. Грибы арбускулярной микоризы (АМ) являются экологически облигатными симбионтами 80 % видов наземных растений [13]. Применение грибов АМ в сельскохозяйственной практике способствует увеличению поступления питательных веществ из почвы в растения, что нередко приводит к увеличению работы фотосинтетического аппарата и азотфиксирующей активности [5, 10, 12]. Ранее исследователями нашего Института было проведена оценка степени микоризации культурных и дикорастущих растений в Крыму и на Юге Украины [3]. Поэтому целью исследований было определить распространение грибов АМ и уровень их колонизации растений в различных условиях доступности водных ресурсов.
Материалы иметоды исследований. Окрашивание корней растений проводили с помощью чернил [16], а количественный учет микоризной колонизации по Trouvelot et al. [14] микрокопированием. Статистическую обработку проводили методом ошибки средней по Доспехову [2].
Результаты иобсуждение. Экспедиция проведена в августе 2016 г. по участкам, где подведены каналы СКК и по которым ранее осуществляли полив из вод Днепра (рис. 1).
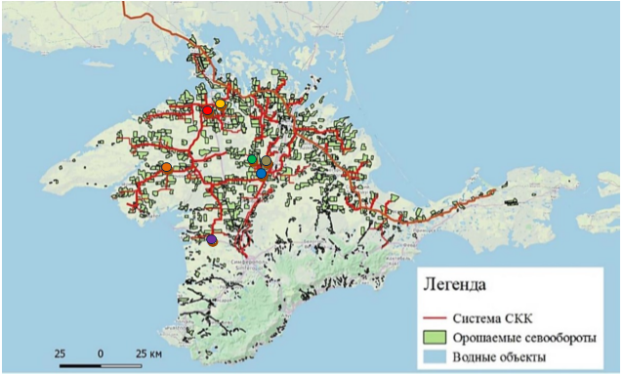
Рис. 1. Карта Крыма с системой СКК и расположением бывших поливных полей [6], а также участков для проведения данных исследований: зеленый — с. Клепинино, синий — с. Петровка, серый — с. Ближнее, фиолетовый — с. Червоное, оранжевый — с. Елизаветово, желтый — с. Курганное, красный — с. Ручьи
Отобраны образцы почв и корней растений для проведения исследований. При выборе участков отбора выбирались поля, где ранее полив осуществляли из вод СКК, а растительный материал по принципу наибольшего сродства к микоризации. Участки:
- Чернозем южный среднемощный тяжелосуглинистый, Красногвардейский район с. Петровка, Яблоня Malus domestica 10-летний сад, разнотравье междурядий, полив: капельное орошение, задерненные междурядья и культивированные ряды.
- Чернозем южный среднемощный тяжелосуглинистый, Красногвардейский район с. Клепинино, Сорго зерновое Sórghum bicólor, богара, участок в непосредственной близости к целине, агротехника полная.
- Чернозем южный среднемощный тяжелосуглинистый, Красногвардейский район с. Клепинино, Лен Línum sp., Мятлик Poa sp., Тысячелистник Achilléa sp., Овсяница валли́сская (Типчак) Festúca valesiáca, Пырей Elytrígia, целина.
- Чернозем южный среднемощный тяжелосуглинистый турбированный, Красногвардейский район с. Ближнее, Черешня Prúnus ávium 10-летний сад, участок с постоянным пересаживанием деревьев, разнотравье междурядий, полив капельное орошение, задерненные междурядья и культивированные ряды.
- Лугово-черноземная почва среднемощная тяжелосуглинистая, Красногвардейский район с. Ближнее, Черешня Prúnus ávium 10-летний сад, низина участок с наилучшим развитием деревьев, разнотравье междурядий, полив капельное орошение, задерненные междурядья и культивированные ряды.
- Чернозем южный маломощный тяжелосуглинистый, Красногвардейский район с. Ближнее, Черешня Prúnus ávium 10-летний сад, участок с хлорозными деревьями, разнотравье междурядий, полив капельное орошение, задерненные междурядья и культивированные ряды.
- Чернозем южный маломощный глинистый, Сакский район с. Червонное, Перец болгарский Cápsicum ánnuum, полив капельное орошение, источник воды подземный, агротехника полная.
- Чернозем южный маломощный глинистый, Сакский район с. Червонное, Лук репчатый Állium cépa, полив дождеванием, источник воды подземный, агротехника полная.
- Чернозем южный маломощный глинистый, Сакский район с. Червонное, Укроп пахучий Anethum graveolens, полив дождевание, источник воды подземный, агротехника полная.
- Чернозем южный слабогумусоакумулятивный, Сакский район с. Елизаветово, Эспарцет Onobrychis viciifolia, Пшеница озимая Triticum aestivum, бинарный посев, no-till технология в течении 10 лет, полива нет с 2000 г.
- Чернозем южный слабогумусоакумулятивный, Сакский район с. Елизаветово, Кукуруза Zéa máys, no-till технология в течении 9 лет, полива нет с 2000 г.
- Темно-каштановая почва слабогумусоакумулятивная, Красноперекопский район с. Курганное, Кориандр посевной Coriándrum sátivum, Люцерна посевная Medicago sativa, бодяк полевой Cirsium arvense, рисовый чек, агротехника полная, полива нет с 2014 г.
- Темно-каштановая почва слабогумусоакумулятивная, Красноперекопский район с. Ручьи, Подсолнечник Heliánthus ánnuus, рисовый чек, агротехника полная, полива нет с 2014 г.
- Темно-каштановая почва слабогумусоакумулятивная, Красноперекопский район с. Ручьи, Морковь Daucus sativus, полив капельное орошение, агротехника полная.
По характеристикам участков для исследований видно, что на участках № 12 и 13 до 2014 года был рисовый севооборот в специализированных чеках площадью по 3–3,5 га с заливным типом выращивания. Полив здесь прекращен и восстановлен в ближайшем будущем не будет. Участки № 7, 10–15, 20 поля, на которых изменили источник орошения (реки Крыма и водные скважины). № 16, 17 — участки с нулевой обработкой почвы в течении 9–10 лет, где ранее также был полив из СКК, но землепользователи отказались от полива по технологическим причинам в 1999–2000 гг. Участок № 2 и № 3 взяты в исследования как контрольные, здесь полив никогда не применялся.
В 2016 году контрольные участки имели частоту встречаемости грибов АМ в корнях растений выше среднего: 49,2–73,2 % (рис. 3). Отличия в степени микоризации в этих вариантах скорее всего были обусловлены различными этапами развития: молодые растения сорго в сравнении со зрелыми растениями разнотравья целины.
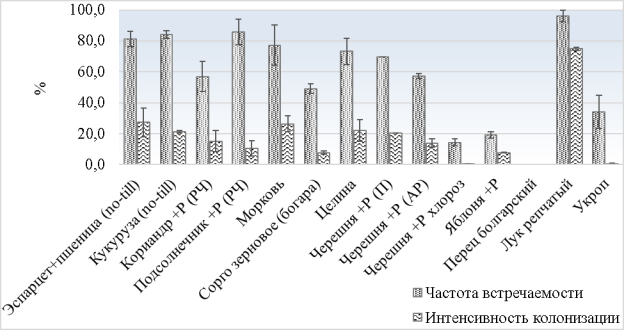
Рис. 2. Развитие микоризной колонизации в корнях растений (полевые отборы, 2016 г.). Примечания: +Р — разнотравье в посевах и посадках сельхозкультур, РЧ — рисовый чек, П — пересаживаемая черешня, АР — активный рост
В рисовых севооборотах микориза во время роста риса не образуется или образуется в небольшом количестве [11, 15]. Грибы АМ при таком виде растениеводства сохраняют свою жизнеспособность и колонизируют последующие культуры в рисовом севообороте, чем обеспечивают существование популяции. Это подтверждается данным исследованием при изучении микоризации кориандра (учет после уборки культуры) с частотой встречаемости 56,8 % интенсивностью колонизации 15,2 % и подсолнечника 85,7 % и 10,5 % соответственно, а также высокопроизводительным секвенированием в затопленных посевах риса [17].
Низкая встречаемость микоризной колонизации обусловлена как видом растений (яблоня 19,2 %), так и фазой их развития (укроп 34,2 %, учет после уборки урожая). Также отмечено влияние заболеваний (черешня с хлорозом), где уровень колонизации снизился в 4,0 и более раз по сравнению со здоровыми растениями. При выращивании перца болгарского была неправильно подобрана технология выращивания, при которой проходило подтапливание корней и микориза не образовалась. Наибольшую частоту встречаемости и интенсивность микоризации выявлено у лука 96,2 % и 74,6 % соответственно. Лук используется как растение-накопитель в бинарных способах культивирования грибов АМ и в лабораторных опытах, и при производстве биопрепаратов на их основе [8].
Также необходимо отметить что 2016 год был достаточно влажным, поэтому растения в богарных условиях хорошо развивались и образовывали симбиоз с грибами АМ [1].
Таким образом, выявлено что изменение источника орошения не влияет на популяцию грибов АМ, при ее наличии она интенсивно колонизирует корни растений с частотой встречаемости 14,4–96,2 % и интенсивностью колонизации 7,8–74,9 %. В целом при продолжении полива из местных источников подземных и надземных вод и благодаря нормальным гидротермическим условиям 2016 года отличия в частоте встречаемости микоризации корней растений были вызваны различными их видами. Очень низкая частота встречаемости отмечена в вариантах с неправильной агротехникой и организацией орошения, а также болезнями растений.
Работа выполнена при поддержке гранта РФФИ № 16–34–00548 мол_а
Литература:
- Декадный агрометеорологический бюллетень по территории Республики Крым за 2016 год / Региональный центр по гидрометеорологии в РК. — Симферополь, 2016. — не опубликовано.
- Доспехов Б. А. Методика полевого опыта — М.: Агропромиздат, 1985. — 352 с.
- Косенко Н. М., Андрєєва Н. О., Патика В. П. Ендомікоризні гриби у ґрунтах півдня України // Землеробство. — 1994. — № 70. — С. 91–95.
- Лабутова Н. М. Методы исследования арбускулярных микоризных грибов — СПб.: Инновационный центр защиты растений ВИЗР, 2000. — 24 с.
- Лабутова Н. М., Левина Р. Л. Влияние способа инокуляции на формирование тройного симбиоза и продуктивность сои // Аграрный вестник Урала. — № 2 (81). — 2011. — С 6–8.
- Хитров Н. Б., Роговнева Л. В., Дунаева Е. А., Попович В. Ф., Паштецкий В. С., Клименко О. Е. Постирригационное состояние пахотных почв степного Крыма // Таврический вестник аграрной науки. — 2016. — № 1(5). — С. 91–100.
- Becerra A., Bartoloni N., Cofré N., Soteras F., Cabello M. Arbuscular mycorrhizal fungi in saline soils: Vertical distribution at different soil depth // Braz J Microbiol. — 2014. — Vol. 45(2). — P. 585–594.
- Dalpе Y., Monreal М. Arbuscular mycorrhiza inoculum to support sustainable cropping systems // Crop Management. — doi:10.1094/CM-2004–0301–09-RV. — 2004. — [Электронный ресурс]. — Режим доступа: www.plantmanagementnetwork.org/pub/cm/review/2004/amfungi/.
- Dighton J. Fungi in Ecosystem Processes / N.Y.: Marcel Dekker, 2003. — 432 p.
- Jakobsen I., Rosendahl L. Carbon flow into soil and external hyphae from roots of mycorrhizal cucumber plants // New Phytologist. — 1990. — Vol. 115. — P. 77–83.
- Lumini E., Vallino M., Alguacil M. M., Romani M., Bianciotto V. Different farming and water regimes in Italian rice fields affect arbuscular mycorrhizal fungal soil communities / Ecol. Appl. — 2011. — Vol. 21(5). — P. 1696–1707.
- Rillig M. C., Allen M. F. What is the role of Arbuscular mycorrhizal fungi in plant-to-ecosystem responses to elevated atmospheric CO2? // Mycorrhiza. — 1999. — Vol. 9. — P. 1–8.
- Smith S. E., Read D. J. Mycorrhizal symbiosis [3 ed.] / London: Academic Press. — 2008. — 815 р.
- Trouvelot A., Kough J. L., Gianinazzi-Pearson V. et al. Mesure du taux de mycorhization VA d’un systeme radiculaire. Recherche de methodes d’estimation ayant une signification fonctionnelle // Physiological and genetical aspects of mycorrhizae; eds. Gianinazzi-Pearson V., Gianinazzi S. — Paris: INRA, 1986. — P. 217–221.
- Vallino M., Greppi D., Novero M., Bonfante P., Lupotto E. Rice root colonisation by mycorrhizal and endophytic fungi in aerobic soil // Ann. Appl. Biol. — Vol. 154. — 2009. — P. 195–204.
- Vierheilig H., Coughlan A. P., Wyss U., Piche Y. Ink and Vinegar, a Simple Staining Technique for Arbuscular-Mycorrhizal Fungi // Applied and Environ. Microbiol. American Society for Microbiology. — 1998. — Vol. 64(12). — P. 5004–5007.
- Wanga Y., Lia T., Lia Y., Olof Björna L., Rosendahl S., Axel Olssonc P., Lia S., Fu X. Community Dynamics of Arbuscular Mycorrhizal Fungi in High-Input and Intensively Irrigated Rice Cultivation Systems // Appl. Environ. Microbiol. — 2015. –Vol. 81 (8). — P. 2958–2965.

