В работе приводятся теоретические основы выбора дисперсной фазы для получения химически стойкого серного композита. В качестве критерия использованы рассчитанные значения изобарно-изотермического потенциала. Сделан вывод, что кварцсодержащие наполнители, сульфаты натрия, калия, магния, кальция и марганца инертны к действию серы и агрессивных сред.
Ключевые слова: сера, серный композит, наполнитель, энергия Гиббса
Большинство породообразующих минералов, а также наиболее распространенные соединения, входящие в состав минералов, являются по отношению к сере химически активными, что, во многих случаях, приводит к образованию растворимых веществ, снижающих показатели эксплуатационных свойств. К химически активным наполнителям относятся вещества, способные вступать в химическое взаимодействие с вяжущем с образованием на границе раздела фаз «дисперсионная среда-дисперсная фаза» соединений различного состава, которые оказывают значительное влияние на процессы формирования структуры материала и его физико-механические и эксплуатационные свойства.
В настоящей работе выбор наполнителя для изготовления серных композитов, стойких в различных средах осуществляли с применением критериального подхода [1]. На практике в качестве критерия для оценки направленности процесса используют изобарно-изотермический потенциал![]() :
:
![]() ,(1)
,(1)
где ![]() – энтальпия процесса;
– энтальпия процесса; ![]() энтропия процесса;
энтропия процесса; ![]() температура.
температура.
Изменение энтальпии Н и энтропии S реакции согласно закону Гесса (первое следствие из закона Гесса) равны:
![]() ,(2)
,(2)
![]() ,(3)
,(3)
где
Тепловой эффект реакции при другой температуре (отличной от стандартной) согласно закону Кирхгофа равен:
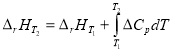 ,(4)
,(4)
где ![]() и
и ![]() — тепловые эффекты реакции при Т2 и Т1соответственно;
— тепловые эффекты реакции при Т2 и Т1соответственно; ![]() – изменение теплоёмкости системы реагирующих веществ в конечном и начальном состоянии.
– изменение теплоёмкости системы реагирующих веществ в конечном и начальном состоянии.
При расчёте ![]() возможны следующие варианты:
возможны следующие варианты:
1) ![]() ; 2)
; 2) ![]() ; 3)
; 3) ![]() .
.
Первый вариант означает, что при данных условиях (температуре, давлении, концентрации и т. д.) возможно самопроизвольное протекание исследуемого процесса. Второй вариант — созданных внешних условий недостаточно для проведения процесса, система находится в состоянии равновесия. Третий вариант — при данных условиях протекание процесса невозможно.
В данной работе термодинамический подход использовался для оценки возможности следующих химических взаимодействий: 1) между наполнителем и серой в процессе приготовления материала; 2) между наполнителем и агрессивной средой в процессе эксплуатации материала; 3) между сульфидами, образующимися на границе раздела фаз «сера-наполнитель», и агрессивной средой.
По результатам термодинамического анализа, которому были подвергнуты основные породообразующие минералы, а также наиболее распространенные соединения, входящие в состав минералов, осуществляли выбор дисперсной фазы (табл. 1). Главным критерием выбора наполнителя являлась его химическая инертность к взаимодействию с серой и к действию различных кислот и солей.
Таблица 1
Результаты термодинамических расчётов*
|
Компонент наполнителя |
Энергия Гиббса, кДж/моль |
||||||||||||||||||||||||
|
Образование сульфида при температуре изготовления (Т= 160˚С) |
Эксплуатационные среды |
||||||||||||||||||||||||
|
кислоты |
соли |
||||||||||||||||||||||||
|
соляная |
серная |
азотная |
хлорид натрия |
сульфат магния |
|||||||||||||||||||||
|
T=25оC |
T=50оC |
T=25оC |
T=50оC |
T=25оC |
T=50оC |
T=25оC |
T=50оC |
T=25оC |
T=50оC |
||||||||||||||||
|
Оксиды |
|||||||||||||||||||||||||
|
NaO |
-287,9 |
|
|
|
|
|
|
– |
– |
|
|
||||||||||||||
|
K2O |
-499,3 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
MgO |
-161,7 |
|
|
|
|
|
|
|
|
– |
– |
||||||||||||||
|
CuO |
-162,2 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
CaO |
-66,3 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
ZnO |
-81,5 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
BaO |
-146,8 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
SiO2 |
302,3 |
|
|
– |
– |
– |
– |
|
|
– |
– |
||||||||||||||
|
PbO |
-108,6 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
MnO |
-21,1 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
FeO |
-36,92 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
Соли |
|||||||||||||||||||||||||
|
Na2CO3 |
193,0 |
|
|
|
|
|
|
– |
– |
|
|
||||||||||||||
|
Na2SO4** |
242,4 |
|
|
– |
– |
|
|
– |
– |
– |
– |
||||||||||||||
|
K2CO3 |
149,7 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
K2SO4** |
256,3 |
|
|
– |
– |
|
|
|
|
– |
– |
||||||||||||||
|
MgCO3 |
-92,5 |
|
|
|
|
|
|
|
|
– |
– |
||||||||||||||
|
MgSO4** |
1915,7 |
|
|
– |
– |
|
|
|
|
– |
– |
||||||||||||||
|
CuCO3 |
680,5 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
CuSO4 |
-45,2 |
|
|
– |
– |
|
|
|
|
– |
– |
||||||||||||||
|
CaCO3 |
148,7 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
CaSO4 |
184,0 |
|
|
– |
– |
|
|
|
|
– |
– |
||||||||||||||
|
ZnCO3 |
-97,2 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
ZnSO4 |
22,8 |
|
|
– |
– |
|
|
|
|
– |
– |
||||||||||||||
|
BaCO3 |
207,9 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
PbCO3 |
-66,8 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
PbSO4 |
77,4 |
|
|
– |
– |
|
|
|
|
– |
– |
||||||||||||||
|
MnCO3 |
49,2 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
MnSO4** |
93,3 |
|
|
– |
– |
|
|
|
|
– |
– |
||||||||||||||
|
FeCO3 |
-10,6 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
FeSO4 |
61,4 |
|
|
– |
– |
|
|
|
|
– |
– |
||||||||||||||
Примечания: в числителе — значения энергии Гиббса для процесса взаимодействия наполнителя с агрессивной средой; в знаменателе — то же для процесса взаимодействия сульфидов, образующихся на границе раздела фаз «сера — наполнитель», с агрессивной средой; * — значения термодинамических величин взяты из справочной литературы [2…4]; ** — применение наполнителя возможно только после экспериментальной проверки в разбавленных растворах указанных солей и кислот.
Из анализа табл. 1 видно, что для изготовления серных материалов, стойких в растворах различных кислот и солей, целесообразно использовать кварцсодержащие наполнители (андезит, опоку, диабаз, кварц и др.), а также сульфаты натрия, калия, магния, кальция и марганца. Эти наполнители инертны к действию серы и агрессивных сред. На что указывает изобарно-изотермический потенциал (![]() ). Сульфаты натрия, калия, магния и марганца являются растворимыми в воде, поэтому их применение возможно только после экспериментальной проверки в разбавленных растворах указанных кислот и солей. Поэтому, в качестве наполнителя для изготовления химически стойких композитов на основе серного вяжущего предлагается использовать кварцевую муку, полученную измельчением речного кварцевого песка (р. Сура). Кроме инертности, кварцевый песок является еще и доступным и широко распространенным сырьём в Пензенской области.
). Сульфаты натрия, калия, магния и марганца являются растворимыми в воде, поэтому их применение возможно только после экспериментальной проверки в разбавленных растворах указанных кислот и солей. Поэтому, в качестве наполнителя для изготовления химически стойких композитов на основе серного вяжущего предлагается использовать кварцевую муку, полученную измельчением речного кварцевого песка (р. Сура). Кроме инертности, кварцевый песок является еще и доступным и широко распространенным сырьём в Пензенской области.
Литература:
- Антонов, А. В. Системный анализ [Текст] / А. В. Антонов. — М.: Высшая школа, 2004. — 454 с.
- Карапетьянц, М. Х. Основные термодинамические константы неорганических и органических веществ [Текст] / М. Х. Карапетьянц, М. Л. Карапетьянц. — М.: «Химия», 1968. — 472 с.
- Рабинович, В. А. Краткий химический справочник [Текст] / В. А. Рабинович, З. Я. Хавин. — Л.: «Химия», 1978. — 392 с.
- Равдель, А. А. Краткий справочник физико-химических величин [Текст] / А. А. Равдель, К. П. Мищенко. — Л.: «Химия», 1974. — 200 с.
- Стромберг, А. Г. Физическая химия [Текст] / А. Г. Стромберг, Д. П. Семченко. М.: «Высшая школа», 1999. — 527 с.







