В работе изучена кинетика коррозионного поведения стали 20Л в солянокислом растворе. Исследовано влияние ингибиторов (цистеина и глутатиона) на коррозионную стойкость стали. Приведена сравнительная оценка коррозионных потерь стали в присутствии ингибиторов разной концентрации.
Ключевые слова: коррозионная стойкость, ингибиторы коррозии, скорость коррозии, ингибирующий эффект.
Проблема повышения коррозионной стойкости низколегированных сталей, имеющих широкое применение в производстве различного оборудования и металлоконструкций, на сегодняшний день весьма актуальна. Наибольшее количество углерода, определяющего свойства стали, содержится в цементите, который характеризуется более положительным электродным потенциалом по сравнению с другими структурными составляющими, и, следовательно, выполняет функцию катода при электрохимической коррозии. Низколегированные стали отличаются невысокой коррозионной стойкостью в хлоридсодержащих средах, поскольку анионы хлора, инициируя образование питтингов, облегчают анодный процесс [1. с. 124]. В работе [2, с. 90] отмечается, что на пассивность поверхностной оксидной пленки оказывает влияние соотношение хрома и железа в ней: чем больше содержание хрома, тем меньше вероятность питтингообразования и тем выше степень пассивности.
Наиболее эффективным способом борьбы с коррозионными потерями вообще и питтинговой коррозией в частности является использование ингибиторов. Так, авторами [3, с. 357] установлено, что коррозионная стойкость низколегированных сталей (Ст3) в солянокислых растворах в присутствии органических азотсодержащих ингибиторов серии ИНКОРГАЗ-50 и ИНКОРГАЗ-2Р заметно повышается. В работе [4, с. 559] описано положительное влияние фосфорной кислоты на коррозионную стойкость стали Х18Н10Т в 0,1 н и 0,5 н растворах HCl. Об эффективной защите сталей в различных агрессивных средах ингибированием коррозионного процесса органическими гетероциклическими соединениями класса азолов сообщается авторами [5, с. 38]. В последнее время в литературе стали появляться сведения об ингибирующих свойствах некоторых серосодержащих антиоксидантов. Так, авторы [6, с. 438] использовали в качестве ингибитора коррозии углеродистой стали в растворе соляной кислоты метионин и его производные, обладающие высокими защитными свойствами за счет образования хемосорбированной экранирующей пленки на поверхности сплава. Известно также ингибирующее действие L-цистеина по отношению к коррозионному разрушению цинка в 0,5 М растворе NaCl [7, с. 101].
Целью настоящей работы было изучение кинетики и механизма коррозии стали 20Л в растворе соляной кислоты в присутствии серосодержащих аминокислот цистеина и глутатиона.
Реактивы, материалы, методы исследований
Для проведения исследований были взяты образцы стали 20Л (с содержанием хрома до 0,25 мас. %; углерода — до 0,25 мас. %, кремния — до 0,52 мас. %), полученные в индукционной тигельной печи со шпинельной футеровкой методом переплава. В качестве шихтовых материалов использовали стальной и чугунный лом. Для раскисления использовали ферросилиций ФС75 (ГОСТ 1415–78) и алюминий. Исследования проводились гравиметрическим методом с использованием аналитических весов. В качестве коррозионной среды использовали 0,1 М раствор соляной кислоты. Функцию ингибиторов коррозии выполняли цистеин (0,05 мас. %, 0,1 мас. %, 0,3 мас. %) и глутатион (0,1 мас. % и 0,2 мас. %). Время экспозиции образцов стали 20Л в указанных растворах варьировалось от 24-х до 600 часов. Перед испытаниями образцы были подвергнуты шлифовке и полировке.
По рассчитанным значениям скорости коррозии К (г/см2*ч) были построены кинетические зависимости К = f().
![]() (1)
(1)
m — изменение массы образца, г;
s– площадь образца, см2;
— время, ч.
Эффективность использованных ингибиторов оценивали по степени их защитного действия:
![]() (2)
(2)
К0 — скорость растворения сплава в растворе без ингибитора, г/см2*ч;
К1 — скорость растворения сплава в растворе с ингибитором, г/см2*ч.
Продукты коррозии образцов стали были проанализированы на содержание в них железа и хрома фотометрическим методом с использованием фотоэлектроколориметра КФК-2 [9, с. 20].
Результаты иобсуждение
Как видно из рис. 1, скорость коррозии стали в растворе HCl сначала резко возрастает (область 1а), достигая максимума при =400ч, а затем практически не изменяется (область 2а) вследствие образования достаточно плотной пленки из продуктов коррозии, главным образом, железа:
Fe0–2e– Fe2+ (3)
Переходу ионов железа из кристаллической решетки сплава в раствор способствуют два фактора: кислая среда и хлорид-ионы, обладающие высокой проникающей способностью.
Введение в коррозионную среду цистеина тормозит процесс ионизации металла. Молекула цистеина представляет собой серосодержащую аминокислоту (HS–CH2–CH(NH2)–COOH), в которой наиболее реакционно способной является сульфгидрильная (тиольная) группа –SH.
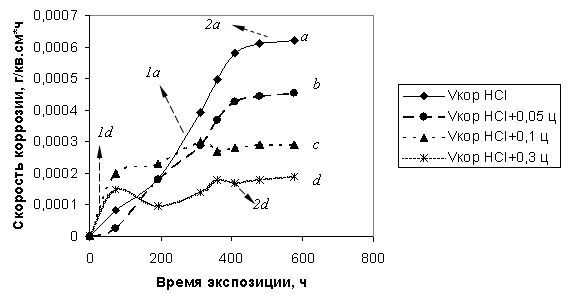
Рис. 1. Зависимость скорости коррозии стали 20Л от времени экспозиции в индивидуальном растворе HCl (0,1М) — а и с добавками цистеина: 0,05 мас. % — b; 0,1 мас. % — с; 0,3 мас. % — d
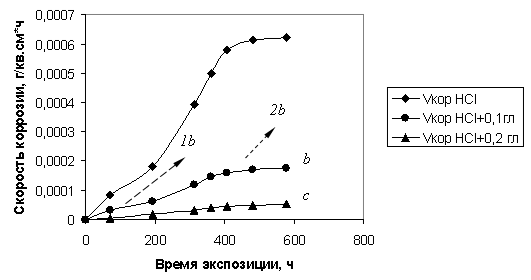
Рис. 2. Зависимость скорости коррозии стали 20Л от времени экспозиции в индивидуальном растворе HCl (0,1М) — а и с добавками глутатиона: 0,1 мас. % — b; 0,2 мас. % — с.
Известно, что катионы многих d-металлов, обладая высоким сродством к сульфгидрильным группам, активно взаимодействуют с серосодержащими аминокислотами, образуя труднорастворимые тиолаты (меркаптиды) металлов [8, с. 39]:
2R-SH + Fe2+ R-S–Fe–S-R + 2H+ (4)
Из рис. 1 видно, что скорость коррозии стали в присутствии цистеина значительно ниже, чем в индивидуальном растворе соляной кислоты в связи с образованием цистеината железа, выполняющего функцию экранирующей пленки, которая препятствует переходу ионов железа в раствор. Скорость коррозии стали уменьшается с увеличением содержания цистеина в растворе и достигает минимального значения при концентрации цистеина, равной 0,3 мас. % (области 1d и 2d).
Введение в коррозионный раствор глутатиона также способствует уменьшению коррозионных потерь (рис. 2). Глутатион (трипептид -глутамилцистеинилглицин) известен как сильнейший антиоксидант, защищающий клетки организма от свободных радикалов за счет активной сульфгидрильной группы [9, с. 1185]. Глутатион с ионами тяжелых металлов также образует труднорастворимые тиолаты. Из рис. 2 видно, что в присутствии глутатиона (0,1 мас. %) уменьшается область активного растворения (область 1b) и понижается скорость коррозии в пассивном состоянии (область 2b). Введение в раствор соляной кислоты 0,2 мас. % глутатиона приводит к понижению скорости коррозии более чем в десять раз. Следовательно, глутатион, как и цистеин обладает достаточно высоким ингибирующим эффектом по отношению к коррозионному разрушению стали. В таблице 1 приведены значения защитного действия использованных ингибиторов при =408 ч, соответствующем максимальной скорости коррозии стали в активном состоянии. Из табл. 2 следует, что максимальная эффективность ингибирования коррозионного процесса стали 20Л достигается при содержании в растворе соляной кислоты 0,3 мас. % цистеина и 0,2 мас. % глутатиона.
Таблица 1
Значения защитного действия цистеина иглутатиона (Z)
|
№ |
Ингибитор |
Z,% |
|
|
1 |
Цистеин |
0,05 |
26,6 |
|
0,10 |
51,8 |
||
|
0,30 |
70,7 |
||
|
2 |
Глутатион |
0,1 |
72,3 |
|
0,2 |
92,2 |
||
С целью подтверждения полученных данных о высокой степени защиты стали 20Л от коррозионного разрушения при использовании цистеина и глутатиона продукты коррозии были проанализированы на содержание в них железа и хрома фотометрическим методом. Результаты исследований приведены в таблице 2. С целью получения достоверных результатов были использованы методы определения железа с сульфосалициловой кислотой (по образованию желтого комплекса) и с о-фенантролином (по образованию орнжево-красного комплекса). Для построения градуировочного графика в первом случае использовали стандартный раствор соли железа концентрацией 0,06 мг/см3; оптическую плотность измеряли при длине волны 416 нм. При использовании о-фенантролина в качестве комплексообразователя ионов железа (II) готовили серию стандартных растворов железа (III) по методике [10, с. 58] и измеряли оптическую плотность при длине волны 510 нм. Содержание хрома определяли по оптической плотности окрашенного в красно-фиолетовый цвет соединения (=546 нм), полученного окислением дифенилкарбазида хромом (VI).
Как следует из табл. 2, результаты определения железа в продуктах коррозии, найденные разными методами, хорошо согласуются между собой. При этом наименьшие коррозионные потери металла обнаружены в присутствии цистеина концентрацией 0,3 мас. % и глутатиона концентрацией 0,2 мас. %.
Таблица 2
Содержание железа ихрома впродуктах коррозии
|
№ |
Состав раствора |
Содержание железа, мг/л |
Содержание хрома, мг/л |
|
|
Фотометрический метод с сульфосалициловой кислотой |
Фотометрический метод с о-фенантролином |
Фотометрический метод с дифенилкарбазидом |
||
|
1. |
HCl 0,1М |
1,07 |
1,15 |
0,06 |
|
2. |
HCl 0,1М + цистеин 0,05 мас. % |
0,39 |
0,37 |
0,035 |
|
3. |
HCl 0,1М + цистеин 0,1 мас. % |
0,38 |
0,38 |
0,025 |
|
4. |
HCl 0,1М + цистеин 0,3 мас. % |
0,34 |
0,25 |
0,013 |
|
5. |
HCl 0,1М + глутатион 0,1 мас. % |
0,95 |
1,0 |
0,055 |
|
6. |
HCl 0,1М + 0,3 мас. % |
0,44 |
0,44 |
0,013 |
Содержание хрома в продуктах коррозии уменьшается так же в присутствии 0,3 мас. % цистеина и 0,2 мас. % глутатиона. Очевидно, что результаты определения коррозионных потерь железа и хрома, найденные фотометрическим методом, хорошо согласуются с кинетикой коррозионных процессов стали 20Л в индивидуальном растворе соляной кислоты и в присутствии ингибиторов.
Выводы.
- Определены кинетические закономерности коррозионного процесса стали 20Л в растворе соляной кислоты.
- Установлено, что цистеин и глутатион характеризуются высоким ингибирующим эффектом по отношению к коррозионному разрушению стали 20Л в солянокислом растворе.
- Уменьшение коррозионных потерь стали 20Л в растворе HCl в присутствии цистеина и глутатиона подтверждается фотометрическим методом. Обнаружено, что максимальная степень защиты стали достигается при содержании цистеина 0,3 мас. %, глутатиона — 0,2 мас. %.
Литература:
- Попова А. А. Методы защиты от коррозии. М.: Лань. 2014. 271 с.
- Наривский А. Э., Солидор Н. А. Коррозионные процессы и скорость роста питтингов сталей AISI 304 и 08Х18Н10Т в модельных оборотных водах. // Вестник Приазовского государственного технического университета. Серия: Технические науки. — 2011. — № 23. — С. 87–97.
- Цыганкова Л. Е., Корякина Е. А. Коррозия и защита стали Ст3 в 0,01 н HCl ингибиторами серии «АМДОР» ИНКОРГАЗ-50 и ИНКОРГАЗ-2Р. // Вестник Тамбовского университета. Серия: Естественные и технические науки. — 2012. — № 1. — С. 357–359.
- Бердникова Г. Г., Провоторов И. С. Влияние добавок фосфорной кислоты на коррозии хромоникелевой нержавеющей стали Х18Н10Т в солянокислых растворах. // Вестник Тамбовского университета. Серия: Естественные и технические науки. — 2011. — № 2. — С. 558–561.
- Комов Д. Н., Махммод Адиба А., Матикенова А. А., Исайчева Л. А., Кривенько А. П., Казаринов И. А. Влияние ингибиторов ряда тетразолов на коррозионно-электрохимическое поведение стали в фосфорнокислых растворах. // Известия Саратовского университета. Новая серия. Серия Химия. Биология. Экология. — 2014. — № 2. — С. 32–39.
- Zhe Zhang, Ningchen Tian, Lingchi Zhang, Ling Wu. Inhibition of the corrosion of carbon steel in HCl solution by methionine and its derivatives. // Corrosion Science. — 2015. — Vol. 98. — P. 438–449.
- Shkirsriy V., Keil P., Hintze-Bruening H., Leroux F., Brisset F., Ogle K., Volovitch P. The effects of L-cysteine on the inhibition and accelerated dissolution processes of zinc metal. // Corrosion Science. — 2015. — Vol. 100. — P. 101–112.
- Торчинский Ю. М. Сульфгидрильные и дисульфидные группы белков. М.: Наука, 1971. 228 с.
- Dalle-Donne I., Rossi R., Giustarani D., Colombo R., Mizani A. Action s-glutationylation: evidence against a thiol-disulfide exchange mechanism. // Free Radical Biology & Medicine. 2003, Volume 35, № 10. P.1185.
- ГОСТ 12350–78. Стали легированные и высоколегированные. Методы определения хрома. Государственный стандарт Союза СССР. 1980.







