Ключевые слова: этиленгликоль, окись этилена, реакция гидратации, полиэфирные волокна, параметры процесса.
Из широкого круга производных гликолей этиленгликоль по объёму производства и значимости в хозяйственной деятельности занимает особое место. В основном, это обусловлено его широким применением в химической, текстильной, автомобильной, авиационной и нефтегазовой промышленности. Примерно 50–60 % мирового производства этиленгликоля используют для получения синтетических полиэфирных волокон на основе полиэтилентерефталата, 20–30 % при производстве антифризов и гидравлических жидкостей. Также известно применение его в процессах синтеза полиуретанов, алкидных смол, различных композиций смазочно-охлаждающих жидкостей для обработки металлов.
На сегодняшний день основными производителями этиленгликоля обычно выступают фирмы, имеющие собственные производства по получению оксида этилена. На рынке РФ этот продукт предлагают ПАО «Нижнекамскнефтехим» (г. Нижнекамск, Республика Татарстан), ПАО «Казаньоргсинтез» и ПАО «Сибур-Нефтехим» (г. Дзержинск, Нижегородская область). Однако, из-за отсутствия на сегодняшний день на предприятиях химической промышленности РФ установок по переработке этиленгликоля в полиэфирные волокна, примерно 60–70 % производимого продукта экспортируется и лишь остальная часть используется при производстве антифризов и других технологических жидкостей.
В таблице 1 представлены технические требования к этиленгликолю высшего и первого сорта согласно ГОСТ 19710–83 [1, c.2].
Таблица 1
Технические характеристикиэтиленгликоля(согласно ГОСТ19710–83)
|
Показатель |
Значение |
|
|
Высший Сорт |
Сорт 1 |
|
|
Массовая доля этиленгликоля. %. не менее |
99,8 |
98,5 |
|
Массовая доля диэтиленгликоля. %. не более |
0,05 |
1,0 |
|
Цвет в единицах Хазена, не более: в обычном состоянии |
5 |
20 |
|
после кипячения с соляной кислотой |
20 |
- |
|
Массовая доля остатка после прокаливания, %, не более |
0,001 |
0,002 |
|
Массовая доля железа. %. не более |
0,00001 |
0,0005 |
|
Массовая доля воды, %, не более |
0,1 |
0,5 |
|
Массовая доля кислот в пересчете на уксусную, %, не более |
0,0006 |
0,005 |
|
Показатель преломления при 20° С |
1,431–1,432 |
1,430–1,432 |
|
Пропускание в ультрафиолетовой области спектра, %, не менее, при длинах волн, нм: 220 |
75 |
- |
|
275 |
95 |
- |
|
350 |
100 |
- |
Внастоящее время основным промышленным способом получения этиленгликоля являетсягидратации окиси этилена, в основе которой лежит следующая реакция:
С2Н4О + Н2О → С2Н4(ОН)2 (1)
Кроме этого, окись этилена реагирует с образовавшимся моноэтиленгликоля и его высшими гомологами с образованием диэтиленгликоля, триэтиленгликоля и других, высших гликолей:
С2Н4О + С2Н4(ОН)2 → НО-СН2-СН2-О-СН2-СН2-ОН (2)
С2Н4О + НО-СН2-СН2-О-СН2-СН2-ОН → НО-СН2-(СН2-О-СН2)2-СН2-ОН (3)
nС2Н4О + НО-СН2-СН2-ОН → НО-СН2-(СН2-О-СН2)n-СН2-ОН (4)
В промышленных условиях применяют получение этиленгликоля некаталитической гидратацией окиси этилена, которая включает в себя следующие стадии: приготовление исходного водного раствора окиси этилена в воде, гидратация окиси этилена, упаривание водного раствора этиленгликоля и ректификация раствора гликолей с выделением товарных продуктов (моноэтиленгликоля и побочно получаемых ди- и триэтиленгликоля) [3, с.112; 4, с.583].
На рис.1 показана технологическая схема производства этиленгликоля мощностью около 3 т/ч (Германия, Anorgana), где 1, 5, 9, 12, 13, 19–22 — сборники; 2, 4 — насосы; 3 — смесители; 6 — теплообменник; 10, 23 — подогреватели; 11, 17 — выпарные аппараты; 14–16, 18 — колонны.
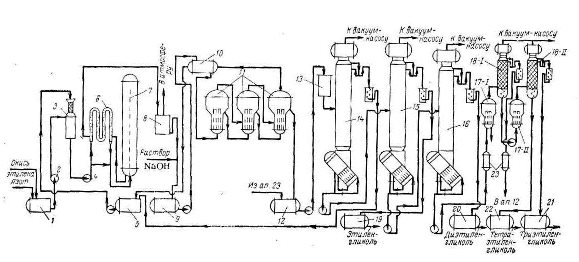
Рис. 1. Технологическая схема производства этиленгликоля
Предварительно окись этилена охлаждается до температуры -10 °С, после чего из сборника 1 подается в смеситель 3. Верхняя часть смесителя представляет собой насадочную колонну, которая заполнена кольцами Рашига (15*15 мм). Основная функция ее состоит в абсорбции паров окиси этилена, которые могут выделиться при неполном поглощении ее водой в нижней части смесителя.
Из сборника 5 подается в верхнюю часть смесителя водяной конденсат с температурой около 20 °С, который получен после выпаривания и ректификации слабого раствора гликоля. При этом соотношение окиси этилена и воды необходимо поддерживать 1:6 (по объему).
Шихта, состоящая из 13 % окиси этилена, из смесителя 3, подается при давлении до 2,45 МПа в гидрататор 7 через теплообменник 6. Шихта в теплообменнике 6 подогревается реакционной жидкостью, выходящей из гидрататора до 160–180 °С, при этом сама реакционная жидкость охлаждается до 90 °С.
Параметры работы гидрататора:
рабочее давление 1,5–2,1 МПа,
температура 200–210 °С (в верхней части)
около 180 оС (в нижней части гидрататора).
Реакционная жидкость, поступающая из гидрататора, дросселируется и из нее выделяется часть газов — ацетальдегид, кротоновый альдегид и др., после чего поступает в расширитель 8. Затем жидкость, в которую непрерывно вводится 30-процентный раствор щелочи для поддержания рН на уровне 7–8, попадает в емкость 9.
Слабый раствор гликолей из емкости 9 поступает на трехкорпусную выпарную установку 11 через подогреватель 10. Подогреватель обогревается вторичным паром, выходящим из последнего корпуса. Конденсат из подогревателя собирается в сборнике 5.
Раствор в первом корпусе нагревается до 214 °С паром 2,1 МПа. Выходящий из этого корпуса пар давлением 0,8–0,9 МПа и температурой 170 °С поступает на обогрев второго корпуса. Второй корпус работает при давлении 0,3–0,4 МПа. и раствор в нем нагревается до 170 °С; пары воды из этого корпуса с температурой 129 °С поступают на обогрев третьего корпуса. Последний работает при давлении 66,7 кПа, и выходящий из него сырой концентрированный гликоль содержит 5–15 % воды; он собирается в сборнике 12.
Для интенсификации выпаривания применена принудительная циркуляция вязкого раствора гликолей центробежным насосом. Гликоль из сборника 12 подается в ректификационную колонну 14 для полной отгонки воды. Параметры колонны: 31 колпачновая тарелка, диаметр 2000, расстояние между тарелками 250 мм, при этом питание подается на 9, 11, 13, 15 и 19 тарелки, считая снизу. Колонна работает при остаточном давлении вверху 1,3 кПа.
В сборнике 5 собирается дистиллят колонны 14, который используется для приготовления водно-оксидной шихты. Обезвоженный гликоль-сырец из куба колонны 14 с температурой 145 °С подается насосом в колонны 15 (в схеме предусмотрены две колонны) для получения этиленгликоля-ректификата. Ректификация проводится при остаточном давлении 0,7 кПа вверху колонны, что соответствует температуре 80 °С. Товарный этиленгликоль собирается в сборнике 19. Кубовая жидкость колонны 15 с температурой 195 °С насосом подается в колонну 16 диаметром 1600 мм. Колонна имеет 33 тарелки, расстояние между ними 333 мм. Питание подается на 6, 8, 10, 12 м 14 тарелки, считая снизу.
Товарный диэтиленгликоль отбирается в сборнике 20 сверху колонны (остаточное давление 0,5 кПа). Кубовый остаток колонны 16 направляют на склад и, по мере накопления, перерабатывают на двух последовательно работающих насадочных колоннах 18 при остаточном давлении 0,7 кПа.
Параметры колонн:
диаметр колонн 800 мм;
высота 6,5 м;
насадка — кольца Рашига 50*50 мм высотой слоя 3,5 м.
Каждая колонна имеет нагревательный змеевик и по два выносных выпарных аппарата 17, обогреваемых паром с давлением 2,1 МПа.
Кубовая жидкость колонны 16 подается первый выпарной аппарат 17 через подогреватель 23, из которого пары гликолей поступают в колонну 18–1. Дистиллят этой колонны, содержащий некоторое количество диэтиленгликоля, возвращается в сборник 12 концентрированного гликоля-сырца, а триэтиленгликоль в смеси с более высокомолекулярными гликолями из нижней части колонны насосом подается во второй выпарной аппарат 17. Пары из этого аппарата поступают во вторую колонну 18–11, дистиллят которой является товарным триэтиленгликолем и собирается в сборнике 21. Кубовые остатки колонны 18–11 — технический тетраэтиленгликоль собирается в сборнике 22. Выпарные аппараты 17 работают периодически. Перед сливом полигликолей аппараты продувают водяным паром (для отдувки остатков три- и тетраэтиленгликолей).
Практически вся аппаратура описанной установки для получения этиленгликоля была изготовлена из углеродистой стали. Вакуум в колоннах создавался индивидуальными паро-эжекционными установками. На такой установке с двумя параллельно работающими гидрататорами (один — внутренним диаметром 810 мм и второй — 760 мм) перерабатывали 2500 кг/ч окиси этилена и получали 3197 кг/ч гликолей, в том числе: этиленгликоля — 2830 кг (88,5 %), диэтиленгликоля — 296 кг (9,3 %) и триэтиленгликоля — 71 кг (2,2 %). Суммарный выход гликолей составляет от 92,5 до 95–96 % от теоретического [2, с.84].
Главным преимуществом процесса жидкофазной гидратации окиси этилена является практически полная конверсия окиси этилена. Однако, существует ряд недостатков, а именно: некаталитическая гидратация осуществляется при повышенном давлении; при кислотном катализе реакционная аппаратура должна изготавливаться из материалов, стойких к агрессивному действию разбавленных кислот, кроме того, требуется дополнительная аппаратура для нейтрализации кислоты и для вывода из системы образующихся солей; большие энергетические затраты при концентрировании разбавленных растворов этиленгликоля.
Предполагалось, что гидратация окиси этилена в паровой фазе над твердыми катализаторами позволит устранить недостатки жидкофазной гидратации.
Эффективным катализатором гидратации оказалась окись серебра, нанесенная па окись алюминия: при степени конверсии окиси этилена, равной 22–24 %, селективность превращения ее в гликоль составила около 80 %. При увеличении степени конверсии до 40 % селективность снижалась до 40 %.
При использовании катализатора цеолитов (температура от 30 до 150 °С, мольное отношение воды к окиси этилена, равное 10:1) выход этиленгликоля составляет 90,5 % при степени конверсии окиси этилена лишь 11,3 %. Если повышать степень конверсии окиси этилена до 17–24 %, снижается выход этиленгликоля до 78–69 %.
Если в процессе парофазной гидратации окиси этилена использовать катализатор катионит амберлит (температура от 115 до 200 °С, давление от 0,14 до 0,55 МП, мольном отношении паров воды и окиси этилена от 5 до 2) реакция протекает с большой скоростью (время контакта — сотые и десятые доли секунды). При температуре 160–165 °С и мольном отношении воды к окиси этилена, равном 20:1, выход этиленгликоля достигает 89 % при степени конверсии окиси этилена около 14 %. При отношении воды к окиси этилена, равном (5–10):1, выход этиленгликоля составляет 80–85 %, а степень конверсии окиси этилена — максимум 17 %.
Существует ряд недостатков в процессе гидратации окиси этилена в паровой фазе. Во-первых, при использовании катализаторов цеолитов и катионитов высокая селективность достигается при большом соотношении паров воды, окиси этилена и очень низкой степени конверсии окиси этилена. Высокая селективность и конверсия при малом отношении воды к окиси этилена получаются при проведении процесса парофазной гидратации окиси этилена в псевдоожиженном слое смешанного фосфатного катализатора (фосфатов кальция и меди). Однако время контакта весьма длительное, и поэтому в промышленных условиях использование невозможно, это потребует большего количества катализатора и реакторов значительного объема. Во-вторых, отсутствуют данные по механической прочности и стабильности катализатора, что не позволяет судить о практической возможности его использования.
Необходимо учитывать способность окиси этилена к полимеризации под влиянием различных веществ, поэтому можно полагать, что активность гетерогенных катализаторов по мере их эксплуатации будет снижаться из-за отложения на них продуктов полимеризации или изомеризации окиси этилена. Именно по этой причине в научной литературе отсутствуют информация об осуществлении процесса парофазной гидратации окиси этилена в промышленных условиях.
Литература:
1. ГОСТ 19710–83. Этиленгликоль. Технические условия. — М.: Изд-во стандартов, 1983. — 15 с.
2. Дымент О. Н., Казанский К. С., Мирошников А. М. Гликоли и другие производные окисей этилена и пропилена — М.: Химия, 1976. — 372 c. (84)
3. Казарновский С. Н., Козлов В. Н. Альбом технологических схем процессов основного органического синтеза: учеб. пособие. Горьк. политехн. ин-т им. А. А. Жданова. — Горький: 1958. — 123 с.
4. Юкельсон И. И. Технология основного органического ситеза: учеб. для химико-технологических специальностей. — М.: Химия, 1968. — 846с.: ил.







