Миастения является одной из часто встречаемых форм в группе нервно-мышечных болезней, удельный вес среди них составляет 60 %. Ранее миастения была тяжёлым заболеванием с высокой летальностью — 30–40 %. Однако при современных методах диагностики и лечения летальность стала минимальной — менее 1 %, около 80 % на фоне лечения достигают полной/неполной ремиссии.
Ключевые слова: миастения нервно-мышечные болезни интенсивная терапия.
Актуальность. Миастения является одной из часто встречаемых форм в группе нервно-мышечных болезней, удельный вес среди них составляет 60 %. Ранее миастения была тяжёлым заболеванием с высокой летальностью — 30–40 %. Однако при современных методах диагностики и лечения летальность стала минимальной — менее 1 %, около 80 % на фоне лечения достигают полной/неполной ремиссии. Средний возраст начала болезни у женщин — 26 лет, у мужчин — 31 год. Соотношение мужчин и женщин среди заболевших составляет 1:3. Но все-таки заболевание является хроническим, серьёзным и требует тщательного наблюдения и лечения. [1]
Цель: Провести анализ повышения эффективности интенсивной терапии (ИТ) миастении.
Задачи:
- Определить показания для лечения миастении в условиях отделения анестезиологи и реанимации интенсивной терапии (ОАРИТ)
- Изучить методики интенсивной терапии миастении в ОАРИТ.
- Определить место в комплексе ИВЛ у пациентов с миастенией.
Материал иметоды. Проведён ретроспективный анализ результатов лечения 52 пациентов с миастенией в РНПЦ «Неврологии и нейрохирургии» (г. Минск, Республика Беларусь) за период январь 2012 г. — январь 2016 г. Из них 35 женщин и 15 мужчин (соотношение 3,5:1,р<0.05). Наиболее значимая возрастная группа пациентов 21 -30 лет, которая составила 40,4 % (рисунок 1).
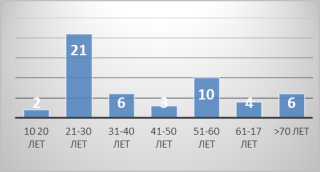
Рис. 1. Возрастные группы пациентов с миастенией
Для определения степени тяжести клинических проявлений миастении в РНПЦ «Неврологии и нейрохирургии» использовалась пятибалльная шкала MGFA (Barohn R. J., 1996) [7]:
1 — изолированная слабость только окулярных мышц, во всех других мышцах сила нормальная
2А — преобладание умеренной слабости мышц туловища, либо проксимальных отделов конечностей, либо и того и другого
2В — преобладание умеренной слабости бульбарной и дыхательной мускулатуры либо и того и другого
3А — преобладание средней степени слабости мышц туловища, либо проксимальных отделов конечностей, либо и того и другого
3В — преобладание средней степени слабости бульбарной и дыхательной мускулатуры, либо и того и другого
4А — преобладание тяжёлой степени слабости мышц туловища, либо проксимальных отделов конечностей, либо и того и другого
4В — преобладание тяжёлой степени слабости бульбарной и дыхательной мускулатуры
5 -интубация (с механической вентиляцией или без таковой), кроме случаев обычных послеоперационных вмешательств.
Основная масса пациентов имела среднюю и тяжелую степени тяжести клинических проявлений миастении по шкале MGFA (Barohn R. J., 1996)(рисунок 2).
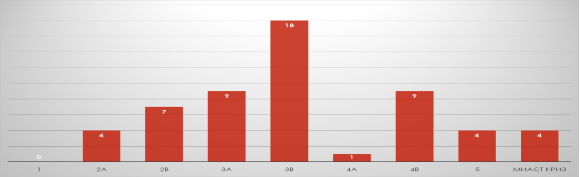
Рис. 2. Тяжесть клинических проявлений миастении по шкале MGFA (Barohn R. J., 1996) и миастенический криз
Всем пациентам проводилась базисная терапия антихолинэстеразными препаратами, глюкокортикостероидами, цитостатицескими препаратами. Были выявлены пациенты сразличным уровнем компенсации на прием глюкокортикостероидов (ГКС), антихолинэстеразных (АХЭП), цитостатиков: 4 пациента с достаточной компенсацией на прием ГКС, АХЭП, цитостатиков; 17 пациентов с неполной компенсацией на прием ГКС,АХЭП, цитостатиков; 31 пациент с неудовлетворительной компенсацией на прием ГКС,АХЭП, цитостатиков.
Результаты иих обсуждение. Все пациенты поступали в отделение неврологии № 2 РНПЦ «Неврологии и нейрохирургии». В связи с ухудшением состояния и резистентностью к базисной медикаментозной терапии данные пациенты были переведены в ОАРИТ с целью проведения специализированных методов лечения (плазмаферез) и необходимостью проведения ИВЛ. Плазмаферез был проведен 43(83 %) пациентам (12 пациентам с неполной компенсацией на прием ГКС, АХЭП, цитостатиков; 31 пациенту с неудовлетворительной компенсацией на прием ГКС, АХЭП, цитостатиков) с целью удаления из организма пациента антител к ацетилхолиновым рецепторам, иммуноглобулинов, провоспалительных медиаторов [3,4,6] (рисунок 3). Плазмаферез был проведен аппаратами цитоплазмафереза «СОМ.ТЕС». Fresenius, Германия и плазмафереза «PCS» Haemonetics, США, в объёме от 50 до 180 % объема циркулирующей плазмы, в качестве плазма заменителей использовались свежезамороженная плазма и 6 % раствор гидроксиэтилированного крахмала.
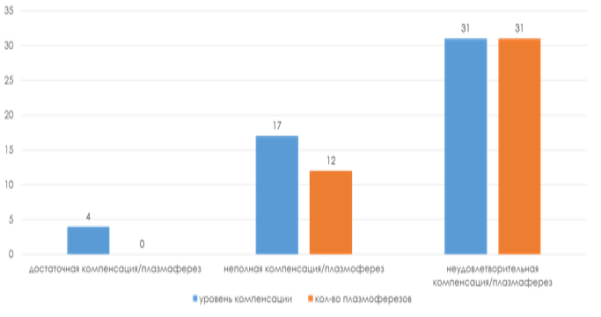
Рис. 3. Зависимость показаний к назначению плазмафереза от уровня компенсации на прием АХЭП, ГКС, цитостатиков
ИВЛ была проведена 4 пациентам в связи с развившейся острой дыхательной недостаточностью, неэффективностью аппарата внешнего дыхания (SaO2=80–85 %, PСO2> 55 мм.рт.ст, ЧД=7–10 в мин). Это были пациенты с 5 классом тяжести клинических проявлений миастении по шкале MGFA (BarohnR.J., 1996) и миастеническим кризом (рисунок 4). ИВЛ проводилась аппаратом DragerEvita 4 в режиме BIPAP (Pinsp 14 см. вод.ст., Peep5 см. вод. ст., FiO2 35 %, ЧД 13 в минуту), М=7,3 дня. 1 пациенту была назначена оксигенотерапия маской Вентури (O2 5 л/мин).
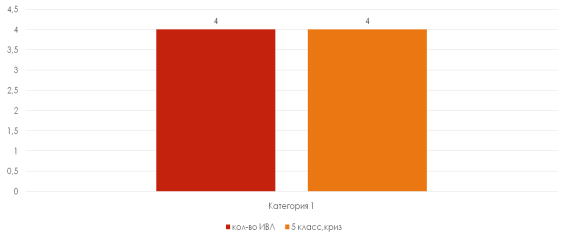
Рис. 4. Зависимость необходимости проведения ИВЛ от класса тяжести клинических проявлений миастении по шкале MGFA (Barohn R. J., 1996) и наличия миастенических кризов
В ОАИТР все пациенты так же получали базисную медикаментозную терапию:
1) Местинон (АХЭП) 60 мг от 1 до 6 раз в сутки. Оротат калия (препарат калия) 500 мг 3 раза в день с целью улучшения синаптической передачи нервного возбуждения, верошпирон (Калийсберегающий диуретик) 50 мг 1 раз в сутки. Прием препаратов калия и калийсберегающего диуретика позволяет уменьшить дозы АХЭП [1,5].
2) ГКС: Медрол 16мг из расчета 1 мг/кг/сут (использовались следующие схемы: прием 60–90 мг медрола через сутки с последующим снижением дозы на10 мг через 3–5 приемов). Модифицированная схема ежедневного приема медрола с чередованием больших и средних доз, с последующим снижением вначале меньшей дозы, а после ее отмены снижают большую дозу) назначался у 49 пациентов, 3 пациентам назначался преднизолон по схеме 40мг по четным дням и 20мг по нечетным дням, использовалась «пульстерапия» метпрезоном 1000мг ежедневно в течение 5 дней у 3 пациентов с миастеническими кризами. Лечение пациентов по одной из схем позволило достичь эффекта в 81 % (60–90 % случаев) [2]. Эффект ГКС связывают с их воздействием на антиген представляющие клетки, Т- и В- лимфоциты [1,5].
3) Азорфин (цитостатический препарат) 50 мг 3 раза в день. Применялся у 23 пациентов с неудовлетворительной компенсацией на прием АХЭП и ГКС
Средняя продолжительность пребывания в ОАРИТ составила М= 6,9 ± 0,65 дней. На фоне проводимого лечения в АОРИТ у пациентов наблюдалось улучшение и стабилизация состояния. Летальность среди пациентов за период январь 2012 г.-январь 2014 г. отсутствовала.
Выводы:
- Проводимое в РНПЦ «Неврологии и нейрохирургии» лечение позволяет исключить летальность и добиться улучшения и стабилизации состояния пациентов
- Показаниями для лечения миастении в условиях ОАРИТ являются тяжесть состояния (больше 2 по шкале MGFA), необходимость проведения плазмафереза и ИВЛ.
- Плазмаферез следует проводить при неудовлетворительной и неполной компенсации состоянияпри приеме АХЭП, ГКС, цитостатиков.
- Показанием к проведению ИВЛ у пациентов с миастенией явилось наличие миастенического криза, сопровождающегося ДН (SaO2=80–85 %,Pco2> 55 мм.рт.ст ЧД=7–10 в мин). У этих пациентов определяется 5 класс тяжести клинических проявлений миастении по шкале MGFA.
Литература:
- Пономарева Е. Н. Миастения: Клиника, патогенез, дифференциальная диагностика, тактика ведения / Е. Н. Пономарева — Мн: «МЕТ», 2002. — 10c.
- Evoli A., Battocchi A. P., Palmisani M. T. et al. Long- Term results of corticosteroid therapy in patiens with myasthenia gravis. // Eur. Neurol, Vol. 32–1992, P. 37–43.
- Лайсек Р. П., Барчи Р. Л. Миастения /Пер. с англ. Москва.- М., 1984.
- Tesar V., Jelinkova E., Jirsa et all., Soluble adhesive molecules and cytokines in patients with myasthenia gravis treated with plasmapheresis. //Cas.Lek.Cesk.- 1998, Nov 2; 137 (21), P.654–659.
- Пономарева Е. Н. Миастения гравис (классификация, принципы лечения)/Е. Н. Пономарева // Актуальные вопросы невропатологии и нейрохирургии. -Минск, 1999. т.Вып. 4.-С.153–160
- Гехт Б. М. Миастения: диагностика и лечение/Б. М. Гехт, А. Г. Санадзе // Неврологич. журн. (Прилож. № 1), 2003. т.Т.:8.-С.8–12
- http://www.medsecret.net/nevrologiya/nervno-myshechnye/595-miasteniya







