Интерес к химическим колебаниям определяется надеждой понять механизм биологических периодических процессов.
Проблема заключается в том, что на сегодняшний день мы не имеем ни одной удовлетворительной математической модели для этих колебаний, экспериментально изученных достаточно хорошо.
Цель настоящей работы — детализировать механизм гомогенной автоколебательной химической реакции Белоусова-Жаботинского (далее Б-Ж) в цилиндрическом стакане и чашке Петри. Для достижения поставленной цели были изучены теоретические основы автоколебательных химических реакций; проведены реакции Б-Ж в цилиндрическом стакане и чашке Петри; изучен механизм автоколебательной реакции Б-Ж, построена схема автоколебательной реакции Б-Ж.
Универсальность нелинейной динамики делает важным удачный выбор лабораторной системы, в которой можно изучать структурообразование (самоорганизацию). К таким лабораторным системам относится гомогенная автоколебательная химическая реакция, открытая Б. П. Белоусовым и в дальнейшем изучена А. М. Жаботинским и другими учеными.
Реакция Белоусова–Жаботинского — это протекающее в автоколебательном режиме каталитическое окисление восстановителей бромноватой кислотой НВrO3. При этом наблюдаются колебания концентраций окисленной и восстановленной форм катализатора и некоторых промежуточных продуктов. Реакция идет в кислотной среде (H2SO4), в качестве катализаторов используют ионы церия переменной степени окисления Ce(SO4)2:Ce3+ и Ce4+. В роли восстановителя выступает лимонная кислота ((HOOC)C(OH)(CH2COOH)2).
Первоначально данная реакция была проведена в лаборатории химии кафедры химии и экологии Морского Государственного Университета им. адмирала Г. И. Невельского (г. Владивосток), под наблюдением заведующей лабораторией Лубинец Ирины Ивановны. Затем реакция проводилась в домашней лаборатории. Так же эта реакция была проведена в Международной средней школе «Развитие» (г. Владивосток) в рамках Международного дня науки, 10 ноября 2015 г.
Для проведения эксперимента использовались реактивы:
160 мг раствора лимонной кислоты (HOOC)C(OH)(CH2COOH)2 — восстановитель;
3 мг серной кислоты (H2SO4) — для создания кислой среды;
16г бромата калия (KBrO3) — неорганическое соединение, соль щелочного металла калия и бромноватой кислоты, бесцветные кристаллы, хорошо растворимые в воде, является сильным окислителем, может быть использован в качестве разрыхлителя теста (в некоторых странах запрещен) — пищевая добавка Е924; бромат калия термически неустойчив, разлагается без плавления, образуя бромид и кислород. Реагирует с серной кислотой;
3,5г сульфата церия (Ce(SO4)2) — порошок белого цвета, безводная соль. Ион сульфата церия [Ce(SO4)24+] является сильным окислителем, особенно в кислой среде. Сульфат церия применяется как катализатор.
Эксперимент проходил так: на электронных весах были отмерены 16 г бромата калия (KBrO3) и 3,5 г сульфата церия (Ce(SO4)2). Подготовлен раствор серной кислоты H2SO4 в соотношении 1 / 3 частям дистиллированной воды, раствор лимонной кислоты: в стакан добавили 60 г лимонной кислоты, смешали со 100 мл дистиллированной воды. Затем в колбе были смешаны бромат калия и сульфат церия с кислотами (рис. 1).

Рис. 1. Подготовка растворов лимонной (HOOC)C(OH)(CH2COOH)2 (слева) и серной H2SO4 (в центре) кислот, смешивание реактивов с кислотами (справа)
- Детализация гомогенной автоколебательной реакции Б-Ж в цилиндрическом стакане
В экспериментах в цилиндрическом стакане зафиксировано периодическое изменение по спектральному испусканию окраски раствора от молочного (максимальная концентрация [Ce+3]) к темно-оранжевому (максимальная концентрация [Ce+4]) и обратно, вызванное колебаниями концентраций окисленной и восстановленной форм катализатора Ce(SO4)2 и промежуточных продуктов [Br-] (рис.2):

Рис. 2. Стадии реакции Белоусова-Жаботинского (приведены средние значения):
1 — желтая (длина волны, λ=580 нм; частота, f=520 ТГц; энергия фотонов, Е=2,15 эВ),
2–светло оранжевая (длина волны, λ=590 нм; частота, f=510 ТГц; энергия, Е=2,10 эВ),
3 — оранжевая (длина волны, λ=620 нм; частота, f=490 ТГц; энергия фотонов, Е=1,98 эВ),
4 — красная (длина волны, λ=750 нм; частота, f=410 ТГц; энергия фотонов, Е=1,68 эВ)
Переход от стадии 1 к стадии 3 сопровождается появлением бифуркаций — меняется установившийся режим работы системы в отдельных точках бифуркаций — точках критического состояния системы, в которых система становится неустойчивой относительно флуктуаций и возникает неопределенность: станет ли состояние системы хаотическим или она перейдет на новый, более дифференцированный и высокий уровень упорядоченности. Пока компоненты реакции не истрачены такой переход происходит. Стохастичность в данном случае содержится в вероятности появления точек бифуркаций.
Наблюдаемая химическая реакция является экзотермической, сопровождается выделением теплоты, вследствие разрыва связей, образования связей продуктов реакции, что отражается на спектральном испускании окраски раствора, а именно энергия фотонов уменьшается от 2,15эВ до 1,68 эВ.
Период колебаний Т четко делится на две части: Т1 — фаза окисления катализатора или фаза нарастания концентрации [Се4+], стадии 1–3–4, и Т2 — фаза восстановления катализатора или фаза падения концентрации [Се4+], стадии 4–2–1, был произведен с помощью экспериментальных данных. Отметим, что Т уменьшался со временем: от 1,5 до 0,6 минуты (рис.3–4). После того, как все компоненты реакции были истрачены, реакция прекратилась.
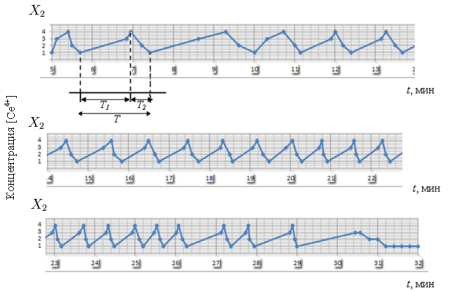
Рис. 3. Период колебаний Т реакции Б-Ж, который делится на две части: Т1 — фаза нарастания [Се4+] и Т2 — фаза падения [Се4+]
Полученный график демонстрирует экспоненциальный характер изменения концентрации катализатора.
Полученная закономерность удовлетворяет модели Лотки — Вольтерры, в которой концентрация С меняется экспоненциально, а концентрация [Br−] — линейно:
![]() (1)
(1)
![]() (2)
(2)
![]() (3)
(3)
где: ![]() концентрация автокатализатора [Се3+];
концентрация автокатализатора [Се3+];
![]() концентрация [Ce4+];
концентрация [Ce4+];
![]() = [Br−];
= [Br−];
C= [Ce4+]0+ [Ce3+]0.
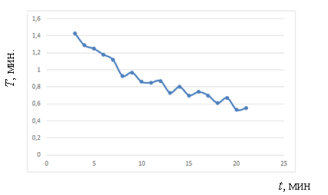
Рис. 4. Изменение периода Т на протяжении всего эксперимента
График изменения периода Т демонстрирует выявленную закономерность — неравномерное уменьшение периода на протяжение всего эксперимента.
Схематически изобразим механизм гомогенной автоколебательной реакции Б-Ж в цилиндрическом стакане (рис.5):
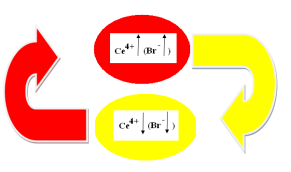
Рис. 5. Механизм реакции гомогенной автоколебательной Б–Ж
На первой стадии реакции (красный овал, Т1) [Се3+] окисляется броматом. Концентрация [Се4+] возрастает:
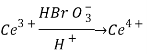 (4)
(4)
При достижении верхнего порогового значения по концентрации [Се4+], концентрация ![]() (ингибитора) резко возрастает, что приводит к торможению реакции. [
(ингибитора) резко возрастает, что приводит к торможению реакции. [![]() ] взаимодействует с активными частицами реакции и с некоторой скоростью исчезает из системы, что способствует уменьшению концентрации [Се4+].
] взаимодействует с активными частицами реакции и с некоторой скоростью исчезает из системы, что способствует уменьшению концентрации [Се4+].
Концентрация [Се4+] уменьшается (желтый овал), достигает нижнего порогового значения, при этом концентрация [![]() ] падает. Раз концентрация замедлителя [
] падает. Раз концентрация замедлителя [![]() ] упала, реакция начинается с большой скоростью: четырехвалентный церий восстанавливается лимонной (HOOC)C(OH)(CH2COOH)2 кислотой:
] упала, реакция начинается с большой скоростью: четырехвалентный церий восстанавливается лимонной (HOOC)C(OH)(CH2COOH)2 кислотой:
![]() (5)
(5)
После этого цикл повторяется. Таким образом, нами выявлены «часы» реакции: [![]() ].
].
Недостатком предложенной схемы является то, что, во-первых, она не содержит в себе все химические процессы, а выделяет только два основных, и во-вторых, не содержит математическую модель закономерности автоколебаний.
- Детализация гомогенной автоколебательной реакции Б-Ж в чашке Петри.
Для проведения эксперимента в чашке Петри был использован раствор, приготовленный в предыдущем эксперименте, который был размещен тонким слоем.
Наблюдается автоволновой процесс, возникший вследствие рассеивания концентрации катализатора на неоднородностях поверхности.
Данный автоволновой процесс характеризуется пространственными и временными размерами, независящими от начальных условий и геометрических размеров системы.
Также мы наблюдаем изменение спектрального испускания от желтого к оранжевому, вызванного колебаниями концентраций катализатора Ce(SO4)2 и промежуточных продуктов от желтого до оранжевого (рис.6). Изменение концентраций [Се3+] и [Се4+] не происходит синхронно во всем растворе вследствие расфазировки колебаний в отдельных точках раствора, максимумы возникают неравномерно в различных частях раствора.
Таким образом, мы наблюдаем периодические бегущие волны окислений, исходящие из неоднородности (участка с измененными параметрами). Скорость распространения волн окисления постоянна и определяется свойствами пространства, а период следования — параметрами в участке неоднородности.
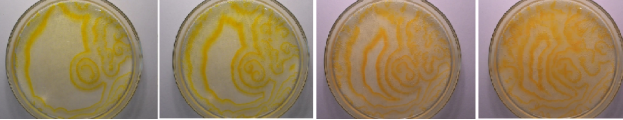
Рис. 6. Изменение структур из автоволн в реакции Б–Ж в чашке Петри
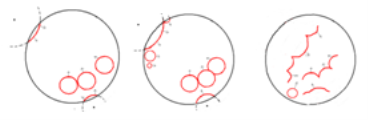
Рис. 7. Схематичное изображение изменение фронтов
При этом имеет место синхронизация среды вследствие локального повышения кислотности или концентрации бромата. Обозначим А и В — повышения кислотности (А) и повышение концентрации бромата (В); С — точка первого столкновения волн от А и В; D — захват В волнами, исходящими из А; F — полное исчезновение синфазных колебаний (рис.8).
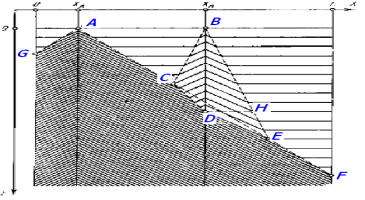
Рис. 8. Синхронизация среды: поглощение одной волны другую
После того, как концентрация компонентов реакции, а именно, концентрация выявленных «часов» реакции: [![]() ], была истрачена, реакция прекращается.
], была истрачена, реакция прекращается.
Таким образом, несмотря на различные условия протекания эксперимента в цилиндрическом стакане и чашке Петри: в первом случае причиной начала процесса самоорганизации служат бифуркации, во втором — рассеивание концентрации катализатора на неоднородностях поверхности, в обоих случаях выявлены «часы» реакций: [![]() ] — ионы брома, наличие необходимой величины которого является главным, но не единственным условием запуска самоорганизации. В системе Лотке «охотник-жертва» этими «часами» является корм для жертвы: если корма будет мало — овцы умрут, умрут и волки. Если корма будет очень много — волки перенасытятся, перестанут охотиться, в их стае поменяются законы иерархии… Т. е. налицо универсальность закономерностей самоорганизации!
] — ионы брома, наличие необходимой величины которого является главным, но не единственным условием запуска самоорганизации. В системе Лотке «охотник-жертва» этими «часами» является корм для жертвы: если корма будет мало — овцы умрут, умрут и волки. Если корма будет очень много — волки перенасытятся, перестанут охотиться, в их стае поменяются законы иерархии… Т. е. налицо универсальность закономерностей самоорганизации!
Литература:
- Ванаг В. К. Волны и динамические структуры в реакционно-диффузных системах. Реакция Белоусова — Жаботинского в обращенной микроэмульсии. — Успехи физических наук. Том № 174. № 9. 2004 г. С. 992.
- Жаботинский А. М. Концентрационные автоколебания. М.: Наука. 1974. С.180;
- Зачернюк А. Б. Открытие колебательных химических реакций. 1 сентября. № 38. 2008. Электронная статья. URL: http://him.1september.ru/article.php?ID=200303803
- Корзухин М. Д., Жаботинский А. М. Математическое моделирование химических и экологических автоколебательных систем. — М.: Наука, 1965

