JuniperusturcomanicaB. Fedtsch. — такое название дано одной из разновидностей можжевельников, произрастающей в Туркменистане. Juniperusturcomanica — можже-вельник туркменский (МТ) встречается в виде редколесья от нижнего до верхнего пояса гор в Юго-Западном и Центральном Копетдаге [18,19]. В народной медицине МТ используют в качестве мочегонного, дезинфицирующего, отхаркивающего и улучшающего пищеварение средства [4].
Целебные свойства можжевельника туркменского изучаются со времен Авиценны [18,25]. На протяжении многих лет это лекарственное растение привлекает внимание большого числа исследователей [1,12,18,19], в том числе и авторов настоящей работы [9,10,23,24].
Целью исследования являлось изучение инвитрового влияния 5 % отвара МТ на лейкограмму, численность и морфологию тромбоцитов крови условно здоровых лиц (УЗЛ) в зависимости от длительности инкубации пробы крови в присутствии препарата.
Материалы и методы. Было исследовано 200 гемограмм УЗЛ в возрасте 19–25 лет (средний возраст обследованных составил 22,7±0,9 лет), полученных на гемоанализаторе ABX Pentra 60 С+ (Франция). Для чего 5,0 мл венозной крови забирали преимущественно из локтевой вены УЗЛ при помощи вакутейнеров в специально предназначенные для гемоанализаторов данного класса одноразовые пробирки (BDVACUTAINER K2E (EDTA) 5.0 ml). Определяли следующие параметры крови — процентное содержание лейкоцитов (WBC), лимфоцитов (LYM), нейтрофилов (NEU), базофилов (BAS), эозинофилов (EОS), моноцитов (MON), абсолютное число атипичных лимфоцитов (ALY) и больших незрелых клеток (LIC), а также общую численность тромбоцитов (РLT,103/mm3) и средний объем тромбоцитов (MPV, μm3). После первичного измерения в пробирки с кровью вносили по 0,01 мл 5 % отвара МТ, тщательно перемешивали на шейкере при 150 колебаниях в минуту в течение 5, 30 и 60 минут при комнатной температуре (+25ºС) затем повторно определяли те же параметры.
МТ для проведения исследования получали в Государственном институте лекарственных растений АН Туркменистана в виде высушенной рубленой хвои, расфасованной в бумажные пакеты по 50 гр. 5 % отвар МТ (infusum ex 10:200) готовили в соответствии с требованиями Фармакопеи (1991) [26] по прописи для JuniperuscommunisL. [22]. Препарат готовили непосредственно перед проведением экспериментов. Полученные данные математически обработаны при помощи компьютерной программы SPSS.
Результаты исследования. Было установлено, что в течение первых 5 минут инкубации крови без препарата достоверно увеличивается процентное содержание MON, MPV, но снижается численность ALY (p<0,05 во всех случаях). Несмотря на некоторую тенденцию к снижению, содержание остальных субпопуляций лейкоцитов практически не изменяется (табл.1). Как видно из таблицы различие во всех случаях математически не достоверно (p>0,05).
Таблица 1
Показатели лейкограммы крови практически здоровых лиц в динамике инкубации без препарата
|
№ п/ п |
Показатели гемограммы |
Исходные данные |
Через 5 минут инкубации |
Через 30 минут инкубации |
Через 60 минут инкубации |
|
|
1. |
WBC(103/mm3) |
7,9±3,4 |
9,2±1,7 |
7,9±1,0 |
7,9±1,1 |
|
|
2. |
NEU (%) |
54,5±4,0 |
61,8±4,0 |
54,9±6,3 |
48,9±3,1* |
|
|
3. |
LYM (%) |
28,9±6,7 |
22,3±2,7 |
28,75±6,4 |
29,3 ±4,9 |
|
|
4. |
MON (%) |
11,2±1,5 |
14,8±1,7* |
11,9±2,5 |
8,9±1,1* |
|
|
5. |
EОS (%) |
1,7±0,9 |
1,1±0,9 |
3,7±0,7* |
2,6±0,7 |
|
|
6. |
BAS (%) |
0,15±0,05 |
0 |
0,25±0,05* |
0,35±0,07* |
|
|
7. |
PLT (103/mm3) |
290,0±50 |
277,0±47 |
279,5±48,5 |
270±45 |
|
|
8. |
MPV (μm3) |
7,0±0,23 |
7,65±0,15* |
7,95±0,25* |
8,05±0,15* |
|
|
9. |
ALY (абсол. число) |
98,5±6,5 |
76,5±2,4* |
69,0±4,7** |
71,3±6, 5* |
|
|
10. |
LIC (абсол. число) |
79,0±6,5 |
69,5±4,5 |
55,5±7,3* |
49,7±5,1* |
|
|
Примечание: *- p<0,05; ** -p<0,1 |
||||||
На 30 минуте инкубации довольно резко увеличивается содержание EОS и BAS (в 2,1 и 1,7 раза соответственно), еще более увеличивается значение MPV, прогрессивно снижается численность ALY (p<0,01) и достоверно по отношению к исходной -численность LIC (p<0,05). По истечении часа в пробе крови достоверно снижено содержание NEU, MON, BAS, численность ALY, LIC и величина MPV (p<0,05). То есть, по мере увеличения времени инкубации пробы крови, в режиме постоянного размешивания на шейкере при комнатной температуре, все более изменяются исходные параметры «белой» крови. Особенно чувствительны к этому воздействию BAS, ALY, LIC и тромбоциты.
Мы обратили особое внимание на субпопуляции LIC (больших незрелых клеток) и ALY (атипичных лимфоцитов).
Таблица 2
Показатели лейкограммы крови практически здоровых лиц в динамике инкубации в присутствии отвара можжевельника туркменского
|
№ п/п |
Показатели гемограммы |
Исходные данные |
Через 5 минут инкубации |
Через 30 минут инкубации |
Через 60 минут инкубации |
|
|
1. |
WBC (103/mm3) |
6,55+0,4 |
5,2+0,46* |
5,45+1,25 |
5,5+1,1 |
|
|
2. |
NEU (%) |
58+2,0 |
53,1+6,5 |
53+1,0* |
52+1,0* |
|
|
3. |
LYM (%) |
31,2+0,3 |
37,3+3,3* |
36+2,5* |
36+1,0* |
|
|
4. |
MON (%) |
9,6+0,3 |
7,9+0,7* |
7,7+0,6 |
7,15+0,35 |
|
|
5. |
EОS (%) |
1,5+0,1 |
2,85+0,9* |
1,5+0,35 |
1,1+0,1 |
|
|
6. |
BAS (%) |
0,17+0,2 |
0,26+0,1** |
1,0+0,1* |
1.6+0,4** |
|
|
7. |
PLT (103/mm3) |
228+31 |
157,3+22,6* |
227+55 |
193,5+41,5 |
|
|
8. |
MPV (μm3) |
6,6+0,4 |
9,16+0,76* |
7.65+0,25* |
7,65+0,25* |
|
|
9. |
ALY (абсол. число) |
96,0+23 |
99,3+28 |
44,5+13,5* |
34+2,0* |
|
|
10. |
LIC (абсол. число) |
74,5+9,5 |
80,6+9,6 |
56+8,0* |
69+8,0 |
|
|
Примечание: *- p<0,05; ** -p<0,1 |
||||||
Их идентификация и подсчет стали возможны на гемоанализаторах последних поколений [6, 7, 15, 16, 21]. Определение численности LIC и ALY в настоящее время рекомендуют использовать в клинической практике. Так, для мониторинга тяжести течения и эффективности лечения хронической миелоидной лейкемии целесообразно определять численность LIC [8,11], а при хронической лимфоидной лейкемии — ALY [3].
На диаграмме, отражающей динамику численности этих субпопуляций лейкоцитов, видно, что относительная численность ALY и LIC имеет практически одинаковую экспоненциальную линию тренда. То есть их относительное содержание при длительной инкубации in vitro изменяется в равной степени. Эта тенденция изменений характерна и для абсолютного числа нетипичных лейкоцитов (табл.1, рис.1).
Наше исследование показало, что в периферической крови практически здоровых лиц в возрасте 19–25 лет, проживающих в жарком регионе, циркулирует в среднем 1,24±0,1 % ALY и 1,0±0,09 % LIC, что соответствует данным литературы [11]. Численность обеих субпопуляций по мере увеличения времени инкубации крови без препарата прогрессивно снижается (Рис.1.).
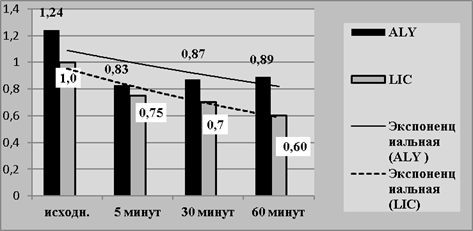
Рис. 1. Процентное содержание атипичных лимфоцитов (ALY) и больших незрелых клеток (LIC) в крови практически здоровых лиц в зависимости от времени инкубации без препарата
Изменения лейкограммы при добавлении в пробу крови 5 % отвара можжевельника туркменского (Juniperusturcomanica) представлены в таблице (Табл.2). Было установлено, что в присутствии препарата относительное содержание NEU и BAS снижается, в то время как LYM и EОS увеличивается по отношению к исходному уровню. Вместе с тем содержание LYM не изменяется, BAS прогрессивно увели-чивается.
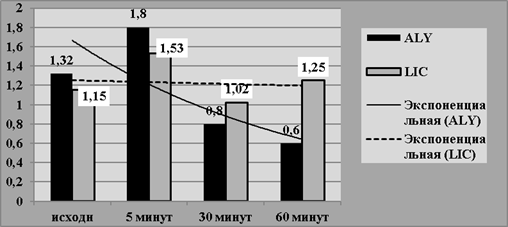
Рис. 2. Процентное содержание атипичных лимфоцитов (ALY) и больших незрелых клеток (LIC) в крови практически здоровых лиц в зависимости от времени инкубации с препаратом
То есть, препарат как бы меняет «знак» изменения относительного содер-жания указанных субпопуляций на противоположный (рис.3). Удивительно, что при этом не изменяется численность моноцитов, которая при инкубации без препарата увеличивается на 25 %.
Другая особенность заключается в том, что численность ALY в присутствии препарата достоверно снижается с 30 минуты инкубации и в общей сложности на 64 %, в то время как без препарата — прогрессивно снижается с 5 минуты инкубации, но максимально на 28 % (рис.2). Численность LIC изменяется волнообразно. Однако, линия тренда на диаграмме указывает на отсутствие тенденции к изменению численности LIC при добавлении препарата в пробу крови.
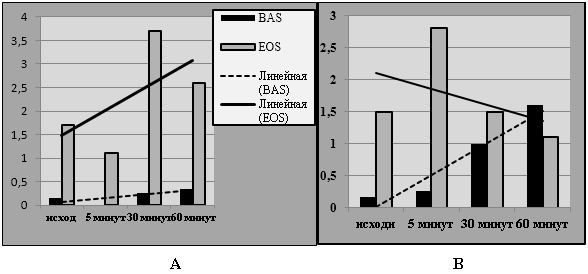
Рис.3. Динамика численности BAS и EOSпри инкубации пробы крови без препарата (А) и в присутствии отвара МТ
Кроме того, уже на 5 минуте культивирования пробы крови в присутствии препарата MPV увеличивается на 38,8 %. Показатель затем несколько снижается, но остается достоверно повышенным против исходного уровня в течение всего времени наблюдения. То есть, при инкубации пробы крови без препарата MPV увеличивается постепенно и максимально в 1,14 раза, в присутствии отвара МТ — уже на 5 минуте инкубации и в 1,4 раза. Другими словами, при инкубации пробы крови без препарата тромбоциты “набухают” постепенно, в присутствии отвара МТ — стремительно и в значительно большей степени. Таким образом, in vitro уже в течение первых 5 минут инкубации при комнатной температуре именно EОS, BAS и тромбоциты реагируют на добавление в пробу крови фитопрепарата, но не моноциты — циркулирующие фагоциты.
Поскольку истинное изменение численности клеток, фиксируемое прибором, в закрытой системе invitro практически невозможно, оно может быть связано только с изменениями их размеров [15,16]. В этой связи можно допустить, что в условиях стресса (длительное размешивание крови в закрытой пробирке при комнатной температуре) в первую очередь изменяется численность MON, ALY и LYK, которая достоверно снижается уже в первые 5 минут инкубации. В результате эти лейкоциты могут идентифицироваться прибором как другие клетки — например, LYM, MON или EOS. Следовательно, именно эти клетки являются наиболее чувствительными к стрессу (длительное встряхивание при комнатной температуре). Отвар МТ, по всей видимости, при добавлении в среду культивирования делает лейкоциты более устойчивыми к стрессу. В этой связи субпопуляции лейкоцитов, флагируемые как ALY и LYC, заслуживают пристального внимания, так как именно они, на наш взгляд, могут служить индикаторами степени стресса для длительно культивируемых образцов периферической крови или ее препаратов.
В этом контексте, безусловно, заслуживает внимания и популяция тромбоцитов. Известно, что благодаря наличию на их поверхности специальных рецепторов — TLRs (Toll-like recеptors) тромбоциты немедленно реагируют на любой бактериальный антиген, за что в англоязычной литературе они получили название «кочующие стражи порядка» (noma dicsentinels). [17]. Однако, за счет наличия открытой канальцевой системы (ОКС) в тромбоцит из окружающей среды поступают и элементы плазмы крови [13, 14, 20]. Следовательно, не только антигены, но и компоненты отвара МТ могут поступать в тромбоциты через ОКС и вызывать их набухание. Размер тромбоцитов является триггером тромбоцитопоэза через активацию мегакариоцитов [2, 5, 27]. Употребление отвара МТ, на наш взгляд, должно привести к появлению и накоплению в кровотоке некоторых его компонентов. В результате чего in vivo, так же как in vitro может произойти набухание тромбоцитов, что, в свою очередь, приведет к активации мегакариоцитарного ростка кроветворения и стимуляции тромбоцитопоэза.
Полученные данные в целом позволяют допустить, что на цитоплазматической мембране лейкоцитов и тромбоцитов крови условно здоровых лиц имеются рецепторы, распознающие определенные компоненты отвара МТ. Эти компоненты, по всей видимости, через экспрессию мембранных рецепторов модулируют функциональную активность тромбоцитов и атипичных лимфоцитов. На наш взгляд, исследования в этом направлении позволят расшифровать механизм взаимодействия отвара можжевельника туркменского (Juniperusturcomanica) с организмом человека в целом, с его иммунной и кроветворной системами, в частности. Они позволят получить новые представления о конкретной роли различных субпопуляций клеток крови в этом взаимодействии, под иным углом зрения рассмотреть вопросы фитотерапии и фитоиммуномодуляции.
Выводы.
1. Инкубация стабилизированной крови условно здоровых лиц в течение часа при комнатной температуре в режиме постоянного размешивания сопровождается изменениями лейко- и тромбоцитограмм, которые можно рассматривать как результат воздействия на клетки крови механического стресса.
2. Наиболее чувствительными к механическому стрессу являются моноциты, тромбоциты и атипичные лейкоциты (ALY, LIC).
3. 5 % отвар можжевельника туркменского (Juniperusturcomanica) in vitro повышает устойчивость лейкоцитов крови условно здоровых лиц к механическому стрессу.
4. Тромбоциты крови условно здоровых лиц in vitro реагируют на присутствие 5 % отвара МТ уже в первые 5 минут инкубации, что проявляется увеличением их объема на 38,8 %.
Литература:
1. Adams R. P. (2004). Juniperus deltoidеs, a new species and nomenclatural notes on Juniperus policarposand Juniperus turcomanica (Cupressaceae). Phytologia 86:49–53.
2. Andrews R. K., Berndt M. C. (2004). Platelet physiology and thrombosis // Thrombosis Res.V, 114: 447–453.
3. BelingaS.C., MangaJ,.Mouliom A, Menque M. A., Nidjonque T., Njile I. (2010). Proportion of Non-Iron Deficiency in full blood cell counts with microcytosis in Cameroon.ISLH 2010, Brighton, UK].
4. Berdimuhamedov G. M. (2009). Medical plants of Turkmenistan. — Ashkhabad: Turkmenskaya gosudarstvennaya izdatelskaya sluzba,. Vol. I., 385 p.
5. Butkiewicz A. M., Kemona H., Dymicka-Piekarska V. D., Matowicka-Karna J., Radziwon P., Lipska A. (2006). Platelet count, mean platelet volume and thrombocytopoietic indices in healthy women and men. //Thrombosis Research. 118 (2): 199–204.
6. Buttarello M, Plebani M.(2008). Automated blood cell counts state of the art. // Am. J. Clin. Pathol.130:104–116.
7. Hoffmann J. J. M. L. and Hoedemakers R. M. J. (2004). Diagnostic performance of the variant lymphocyte flag of the Abbott Cell-Dyn 4000 haematology analyser // Clinical & Laboratory Haematology Volume 26, Issue 1, pages 9–13, February (Article first published online: 23 JAN 2004 http://onlinelibrary.wiley.com/doi/10.1111/j.0141–9854.2003.00581.x/abstract).
8. María E. Arroyo, María D. Tabernero, María A. García-Marcos and Alberto Orfao Analytic Performance of the PENTRA 80 Automated Blood Cell Analyzer for the Evaluation of Normal and Pathologic WBCs http://ajcp.ascpjournals.org/content/ 123/2/206.full.pdf
9. Pleskanovskaya S. A., Gurbandurdiyev A. et all (2003) On the possibility of Juniperus turcomanica decoction in the chronic tonsillitis patients’ treatment using.// Turkmen health care J. 4:18–20.
10. Pleskanovskaya S. A., Mamedova G., Munir Ozturk, Salih Gucel, Ashyraliyeva M. (2012) Аn Overviev of the Ethnobotany of Turkmenistan and Use of Juniperusturcomanicain Phytotherapy In. Genetic resources, chromosome engineering, and crop improvement (Medical plants), Ed. Ram J. Singh, CRC Press, Taylor &Francis Group, Bocf Raton-London-New York, 2012, Vol.6, chapter 8, p.207–220
11. Portal J.,Blanco F.,CasanoL., BarronM-J., VargasC., TorricoD., CastroL., PinoJ., SanchezJ.,TorresA. (2010). Detection of nucleated red cells in peripheral blood samples from pregnant women using ABX Pentra DX 120 analyzer. ISLH 2010, Brighton, UK.
12. Ram J. Singh (2012) Landmark Research in medical plants Phytotherapy In. Genetic resources, chromosome engineering, and crop improvement (Medical plants), Ed. Ram J. Singh, CRC Press, Taylor&Francis Group, Bocf Raton-London-New York, 2012, Vol.6, chapter 1, p.1–13.
13. Васильев С. А., Виноградов В. Л., Карабудагова З. К. Структура и функция тромбоцитов. //Гематол. трансфузиол. 2010. № 5. С. 4–10.
14. Гаврилов О. К., Файнштейн Ф. Э. и Турбина Н. С. Депрессии кроветворения, М., 1987; Руководство по гематологии, под ред. А. И. Воробьева, т. 2, М., 1985.
15. Гематологические Анализаторы. Интерпретация Анализа Крови (Методические Рекомен-дации) Москва, Мз и Ср Рф, 21 Марта 2007 Г. N 2050-Рх
16. Грачёва В. В., Автоматизация лабораторных исследований. Pentra DX 120. Некоторые аспекты автоматизированного исследования клинико-диагностических параметров в гематологии// Журнал «Лаборатория», № 3, 2013 http://www.labix.ru/publikatsii/38-article2.html
17. Данилов И. П. Тромбоциты: новый взгляд на их роль в организме // Медицинские ново-сти. — 2008. — № 9. — С. 17–19.
18. Каррыев М. О. Арча — лекарственное растение, Ылым, Ашхабад, 1971.
19. КаррыевМ.О., АртемьеваМ.В., Баева Р. Т., Киселева В. В., Наби-заде Л. И., Оразму-хамедова Н. О. Фармакохимия лекарственных растений Туркменистана (Под ред. проф. Прокопенко А. П.), Ашхабад: Ылым,1991, 203 с.
20. Коробова Ф. В. Компьютерная морфометрия тромбоцитов периферической крови здоровых людей. // Автореф. канд. биол. наук. М., 2001. 25 с.
21. Куриляк О. А. Клиническая интерпретация некоторых показателей гематологических анализаторов 26.05.2009. http://unimedao.ru/articles/-6826/9671-/item/90.
22. Машковский М. Д. Лекарственные средства, том 1, Медицина: Москва, 1973, Стр.398;
23. Плескановская С. А., Акыев А., и др. (2007) Модуляция иммунного ответа на антиген эхинокковой кисты отварами можжевельника туркменского.//Аллергология и иммунология 8,1:104.
24. Плескановская С. А., Тачмухаммедова А. Х. Влияние можжевельника туркменского на эритроциты здоровых лиц… // ж. Молодой ученый, 2014, №.., Вып. Стр.
25. Справочник лекарственных растений Туркменистана (под ред. Каррыева М. О., Ашгабат-1992, изд. АНТ «Энциклопедия», 88 с.
26. Фармакопея СССР, изд. 11, вып.2, М: Медицина, 1990, 398 с.
27. Шапиро Эми Д. Нарушения функции тромбоцитов.:webadmin от 21 мая 2003







