В работе рассмотрены свойства дихлорангидрида терефталевой кислоты и пути его применения. Представлен обзор основных способов получения данного продукта и предложено несколько направлений совершенствования технологии.
Ключевые слова: гексахлор-п-ксилол, гидролиз, кубовый остаток, применение, терефталоилхлорид, технология, хлорирование, хлорангидрид.
Терефталоилхлорид (ТФХ; дихлорангидрид терефталевой кислоты, дихлорангидрид бензол-1,4-дикарбоновой кислоты, дихлорид терефталоила, дихлорид терефталевой кислоты, 1,4-бензолдикарбонилдихлорид, п-фенилендикарбонилдихлорид) — это вещество специального назначения. Применяется для получения полиамидных волокон, пластических масс типа полиарилатов, обладающих высокими физико-механическими и диэлектрическими свойствами [1, 2]. В промышленности ТФХ получают гидролизом гексахлор-п-ксилола в присутствии хлорного железа как катализатора с последующей перегонкой полученного ТФХ-сырца и чешуирование ТФХ [1, 2, 3].
История развития технологии
Данный метод был впервые предложен и запатентован в 1936 году немецким концерном «И. Г. Фарбен» [4].
Наиболее важные исследования по изучению процессов получения дихлорангидрида терефталевой кислоты, а также его дальнейшего применения можно отнести к 60–80-м годам XX века.
Терефталоилхлорид является сырьем для производства арамидных волокон. В связи с этим выпуск в 1971 г. его первой промышленной партии под торговой маркой «Кевлар» американской фирмой «Дюпон» [5] можно считать значительным импульсом дальнейших исследований свойств и методов получения ТФХ. В частности, непрерывный процесс производства данного соединения гидролизом гексахлор-п-ксилола водяным паром был разработан фирмой «Dynamit Nobel» (Германия) в 1976 году [3, 4].
В нашей стране исследованиями взаимодействия моно-, ди- и поликарбоновых кислот с различными агентами занималась группа ученых под руководством профессора Е. Л. Вулаха в 70–80-х годах XX века. В рамках проводимых экспериментов были детально изучены различные механизмы синтеза хлорангидридов дикарбоновых кислот, условия образования требуемого продукта наибольшей чистоты. В том числе исследовались дихлорангидриды изо- и терефталевой кислот [10].
Следует также отметить, что на фоне роста потребностей оборонной промышленности в высокотехнологичных материалах значимым событием для нашей страны стало создание в 1999 году производства терефталоилхлорида на базе ОАО «Каустик» (г. Стерлитамак) [6]. Это позволило отечественным производителям снизить объем закупок зарубежного сырья. Среди иностранных поставщиков данного продукта можно выделить, в частности, компании «ДюПон» (DuPont, США) и «Тейджин» (Teijin, Япония/Нидерланды).
Физико-химические свойства продукта. Применение
Терефталоилхлорид представляет собой кристаллическое вещество белого цвета со специфическим острым запахом. Молярная масса 203,03 г/моль. Температура плавления от 82 до 83 °C, температура кипения 266 °C, имеет склонность к возгонке; плотность (при 90 °C) 1,325 г/см3, насыпная плотность чешуированного продукта от 0,70 до 0,75 г/см3. Растворим в большинстве органических растворителей — эфирах, бензоле, ацетоне, четыреххлористом углероде, нефрасе и др. Горючее невзрывоопасное вещество, нечувствительное к удару и трению; температура вспышки в открытом приборе 152 °C, температура начала разложения пылевидного продукта 250 °C ТФХ обладает местным раздражающим действием [1].
Дихлорангидрид подвергается гидролизу водой, водными растворами кислот и оснований с образованием терефталевой кислоты или её солей:
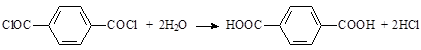
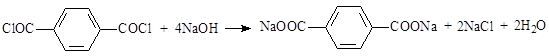
Терефталоилхлорид легко реагирует со спиртами, образуя сложные эфиры:
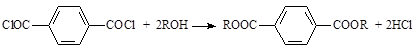
Также следует отметить склонность терефталоилхлорида вступать в реакции аминирования, образуя амиды кислот [1]:
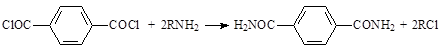
Терефталоилхлорид находит применение в производстве арамидных волокон типа терлон, фенилон и других, обладающих высокими физико-механическими и диэлектрическими свойствами, применяемых в кабельной промышленности, при армировании изделий, для изготовления специальных термостойких тканей, грузонесущих элементов и средств баллистической защиты. Хлорангидриды ароматических кислот, содержащие атомы хлора в ароматическом кольце, являются исходными продуктами для получения огнестойких и негорючих полимерных материалов. На основе хлорангидридов хлорзамещенных фталевых кислот получают красители для натуральной целлюлозы и полиамидных волокон, гидравлические жидкости, импрегнирующие добавки, термопластические смолы; они являются сырьем для синтеза гербицидов, пероксидных соединений, лекарственных препаратов, дезинфицирующих средств, красителей. Также ТФХ может служить сшивающим агентом для полисульфидов и полиуретанов [1,2].
Методы получения
Методы на основе гидролиза
Существуют различные способы синтеза ТФХ. Одним из основных промышленных методов его получения является гидролиз гексахлор-п-ксилола (ГХПК) в присутствии хлорного железа как катализатора при повышенной температуре и атмосферном давлении:
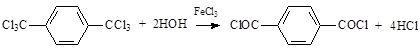
Процесс состоит из двух основных стадий: гидролиз гексахлор-п-ксилола водой в присутствии хлорного железа; перегонка терефталоилхлорида-сырца в вакууме [1, 2, 4, 11]. ГХПК может быть предварительно получен из п-ксилола жидкофазным хлорированием в присутствии инициатора (азобисизобутиронитрила). Принципиальная технологическая схема приведена на рисунке 1.
Гидролиз ГХПК водой осуществляют в реакторе 2, снабженном мешалкой и барботером для подачи воды. Расплав ГХПК из мерника 1 по обогреваемому трубопроводу поступает в реактор 2, где при перемешивании его нагревают до температуры от 110 до 120 °С. Затем добавляют хлорид железа. К этой смеси равномерно добавляют воду из мерника-дозатора 3 (с помощью дозировочного насоса, не показанного на схеме).
Процесс ведут при обычном давлении, строго выдерживая мольное соотношение реагентов хлорид:вода, равным 1:2. Выходящие из реактора газы проходят ловушку-холодильник 4, после чего поступают на абсорбцию водой. Сконденсировавшиеся в ловушке-холодильнике органические продукты (в основном гексахлор-п-ксилол и хлорангидрид) по окончании реакции переводят нагреванием в жидкое состояние и сливают обратно в реактор 2 для последующей переработки.
По окончании процесса гидролиза от реакционной массы «отдувают» растворенный хлорид водорода с помощью сухого азота. Продукт-сырец передают в куб 5 ректификационной колонны 6, снабженной дефлегматором 7, для разгонки в вакууме. Во избежание кристаллизации продукта в процессе перегонки температуру конденсата на выходе из холодильника 8 поддерживают на уровне температуры плавления хлорангидрида. Перегнанный хлорангидрид собирают в сборнике 9. Отходящие в процессе перегонки газы по обогреваемой линии поступают на стадию улавливания. Кубовый остаток перегонки направляют на обезвреживание [11].
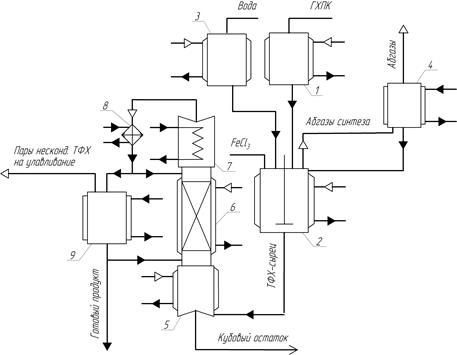
Рис. 1. Принципиальная технологическая схема получения ТФХ гидролизом ГХПК: 1 — мерник; 2 — реактор; 3 — мерник-дозатор; 4 — ловушка-холодильник; 5 — куб; 6 — ректификационная колонна; 7 — дефлегматор; 8 — холодильник; 9 — сборник)
Непрерывная схема гидролиза гексахлор-п-ксислола разработана фирмой «Dynamit Nobel». Принцип её действия показан на рисунке 2.
Гидролиз проводят в вертикальном трубчатом реакторе 5 при температуре от 105 до 108 °С с применением в качестве катализатора так же хлорида железа. Гидролизующим агентом является водяной пар, поступающий из аппарата 6 в нижнюю часть реактора.
В конденсаторе 4 в процессе гидролиза поддерживают такую температуру, чтобы жидкость не охлаждалась ниже температуры застывания. Продукты гидролиза выводятся из верхней части реактора 5. Часть хлорангидрида в качестве растворителя возвращается через теплообменник 3 в процесс, а остальное количество направляется через сборник 2 в колонну 1 для перегонки в вакууме.
В процессе циркулирует от 0,5 до 20 объемов хлорангидрида на 1 объем образующегося хлорангидрида. На выходе из теплообменника 3 в циркулирующий растворитель непрерывно вводятся исходный хлорид и катализатор, и смесь направляется в нижнюю часть реактора 5 [2, 3, 11].
Таким образом, предотвращается полный гидролиз гексахлорксилола, приводящий к образованию фталевой кислоты, осаждающейся в различных частях аппарат. Хлорид железа в присутствии хлорангидридов не катализирует побочных реакций. [2, 3].
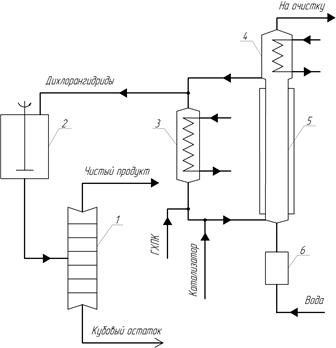
Рис. 2. Принципиальная схема непрерывного процесса получения ТФХ: 1 — перегонная колонна; 2 — сборник; 3 — теплообменник; 4 — конденсатор; 5 — трубчатый реактор для гидролиза; 6 — перегреватель воды.
При создании производств большой мощности экономически более выгоден метод производства из ГХПК и терефталевой кислоты (ТФК) в присутствии FeCl3 в качестве катализатора:
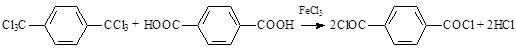
Процесс проводят по схеме, схожей с гидролизом водой, при температуре от 85 до 120 °С атмосферном давлении и мольном соотношении реагентов 1:1 [1, 2, 3].
Методы на основе хлорирования
Известно несколько способов получения терефталоилхлорида хлорированием терефталевой кислоты различными агентами. Так при взаимодействии её с тионилхлоридом происходит образование целевого продукта и газовой смеси из диоксида серы и хлороводорода:
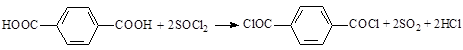
Реакция протекает в присутствии хлоридов металлов III-V групп периодической таблицы, азотсодержащих соединений: амидов муравьиной кислоты, N,N-диметилкарбаминовой кислоты, N,N-диметилацетамида, тетраметилмочевины, диэти- и дифениламина, пиридина, — катализирующих процесс хлорирования карбоновой кислоты [1, 2, 9, 12, 13].
В более мягких условиях и при отсутствии катализатора получение целевого хлорангидрида проходит при действии SOCl2 на терефталаты щелочных металлов:
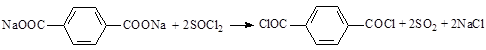
Оптимальными условиями являются мольное соотношение SOCl2:терефталат = 7:1, температура смешения от 50 до 65 °С с последующим нагреванием до температуры от 75 до 85 °С. Как видно из уравнения, в газовую фазу выделяется только сернистый ангидрид, что упрощает утилизацию побочных продуктов [14].
В качестве хлорирующего агента может выступать фосген (COCl2). В данном случае взаимодействие карбоксильных групп ТФК и дихлорангидрида угольной кислоты возможно в присутствии третичных оснований [16], давлении фосгена от 1 до 10 МПа и температуре реакции от 100 до 150 °С [17], в присутствии металлов VIII группы [18]:
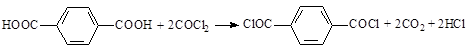
Хлористые соединения фосфора также превращают карбоновые кислоты в соответствующие хлорангидриды [9, 12]:
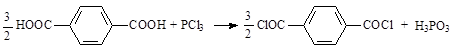
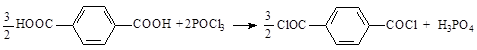
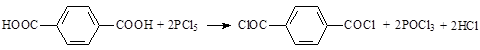
ТФХ может быть получен также при взаимодействии гексахлорксилолов со сложными эфирами в присутствии в качестве катализаторов соединений железа и алюминия при температуре от 140 до 185 °С. Практический интерес представляет применение этой реакции к отходам производства полиэфиров. Например, при взаимодействии полиэтилентерефталата (ПЭТ) с гексахлор-м-ксилолом мы получаем смесь изо- и терефталоилхлоридов, содержащих также 1,2-дихлорэтан [2, 7, 8]:
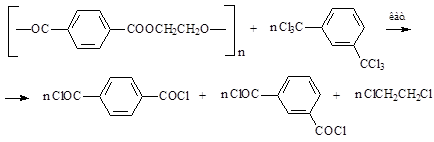
В некоторой степени обобщающим предыдущие методы выступает способ синтеза дихлорангидрида терефталевой кислоты хлорированием смеси полиэтилентерефталата и терефталевой кислоты при повышенной температуре и высоком давлении в среде инертного органического растворителя, в частности, хлорпроизводных углеводородов и хлоридов кислот (четыреххлористый углерод, формалин, хлорбензол и др.). Суммарно эту реакцию можно записать в следующем виде (n=1) [9]:
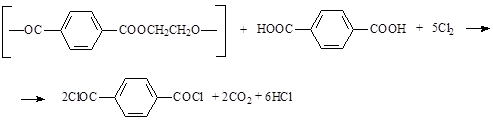
Использование такого сочетания исходных реагентов позволяет более полно использовать подаваемый хлор и предотвращает образование фосгена как побочного продукта.
В патентной документации также представлены некоторые другие методы синтеза дихлорангидрида терефталевой кислоты, отличающиеся исходным сырьем, условиями протекания процесса, типам применяемых катализаторов и способами выделения чистого продукта.
Пути совершенствования технологии
Описанные технологии позволяют получить терефталоилхлорид высокого качества, полностью удовлетворяющий техническим условиям и требованиям предприятий-покупателей, использующих данное вещество в качестве сырья в производстве других продуктов. Тем не менее, как и любая технология, данные способы промышленного получения дихлорангидрида ТФК могут быть усовершенствованы. Выделим несколько основных направлений достижения этой цели:
1) использование альтернативного сырья. Очевидно, что технологию можно улучшить, если изменить состав исходных веществ. Так, например, замена воды на терефталевую кислоту в гидролизном способе синтеза терефталоилхлорида позволяет сократить удельный расход гексахлор-п-ксилола, уменьшить содержание ТФК в сырце и увеличить выход готового продукта. Это должно снизить его себестоимость и способствовать наращиванию мощностей производства, повышая его рентабельность;
2) повышение чистоты получаемого терефталоилхлорида. Этого можно добиться, в частности, изменением условий процесса перегонки ТФХ-сырца. Так, например, предлагается, отгонка ТФХ из продуктов реакции его получения, которая, в отличие от предложенной, происходит при атмосферном давлении в токе инертного газа, а выделение продукта из паровой фазы осуществляется при температуре, меньшей температуры его плавления. При этом такой показатель качества терефталоилхлорида, как прозрачность раствора в тетрахлорметане, увеличивается до 97–98 %, что свидетельствует о снижении содержания примесей в продукте [15]. Как отмечают авторы, этот результат достигается, несмотря на то, что, казалось бы, повышение температуры может вызвать негативные эффекты. Продукт более высокого качества будет легче перерабатывать и получать полимеры с улучшенным характеристиками на его основе;
3) поиск новых путей утилизации газообразных отходов. Ряд методов промышленного синтеза терефталоилхлорида предполагает образование побочных продуктов в виде газовой смеси, в частности, образуется HCl, его смеси SO2. Одиночный хлороводород может быть абсорбирован водой с получением соляной кислоты [2]. При образовании его смеси с диоксидом серы возникает проблема эффективного разделения и утилизации данных компонентов. Может быть использована технология [19], позволяющая раздельно получить из газообразных отходов тиохлоридного метода товарные продукты — концентрированную соляную кислоту и диоксид серы, которые могут быть использованы затем в промышленном производстве. Таким образом, достигается снижение газообразных выбросов и обеспечивается ресурсосбережение;
4) эффективная переработка кубового остатка перегонки. В кубе после отгонки терефталоилхлорида, получаемого методом гидролиза, остается кубовый остаток, содержащий ТФХ, ТФК, FeCl3 и осмолы, предположительно представляющие собой полизвенные ангидриды терефталевой кислоты. Подобные соединения образуются при избытке ТФХ и повышенной температуре, характерной для стадии перегонки [10].
При условиях протекания процесса перегонки ТФХ-сырца образуется преимущественно дихлорангидрид бис-4(карбокси)-бензойного ангидрида:
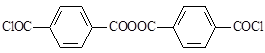
Данный дихлорангидрид образуется в результате следующих превращений:
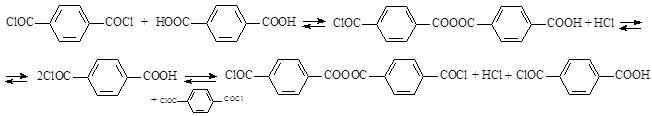
Температура плавления его составляет 180 °С; соединение растворимо в кипящем толуоле, четыреххлористом углероде [10].
Нерастворимый в кипящем толуоле остаток продуктов указанной реакции является смесью полизвенных ангидридов, из которых можно выделить такие соединения, как [10]
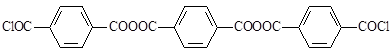 ,
,
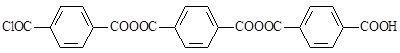 .
.
Таким образом, можно принять, что общая структурная формула строения полиангидридов терефталевой кислоты в осмолах имеет вид
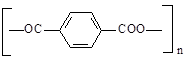 ,
,
где n — число звеньев полимерного ангидрида.
Существуют различные пути утилизации кубового остатка, ряд из них представлен в наших более ранних сообщениях [20, 21].
Представленные сведения показывают, что терефталоилхлорид — востребованный продукт на рынке химического сырья, хотя он и является относительно малораспространенным. Производство его может осуществляться различными способами в зависимости от наличия тех или иных исходных компонентов и величиной экономических затрат, необходимой мощности производства и степени воздействия на окружающую среду. При этом любая технология имеет ряд узких мест, устранение которых будет способствовать повышению мощности производства, улучшению качества получаемого продукта и положительно повлияют на экономический и экологический аспекты производства.
Литература:
1. Промышленные хлорорганические продукты: справочник / под ред. Л. А. Ошина. М.: Химия, 1978. 658 с.
2. Муганлинский Ф. Ф. и др. Химия и технология галогенорганических соединений. М.: Химия, 1991 г. 272 с.
3. Гайле А. А., Сомов В. Е., Варшавский О. М. Ароматические углеводороды: Выделение, применение, рынок: справочник. СПб: Химиздат, 2000. 544 с.
4. Richtzenhain H., Riegger P. Method of Preparing Terephtalic Acid Dichloride and Isoterephtalic Acid Dichloride. (Пат. 4091017 США, 1978.)
5. Справочник по композиционным материалам. В 2-х кн. Кн. 1 / под ред. Дж. Любина; пер. с англ. А. Б. Геллера, М. М. Гельмонта; под. ред. Б. Э. Геллера. М.: Машиностроение, 1988. 448 с.
6. Хабибуллина Л. Забыл прошлое — потерял будущее // Комсомольская правда: Уфа. № 15. 2009.
7. Funabashi K., Harada K. Process for Preparation of Aromatic Carboxylic Acid Chloride. (Пат. 3835186 США, 1974)
8. Katzschmann E. Process for the Production of Tere- and Isophthalic Acid Dichloride. (Пат. 711730 Канады, 1965.)
9. Zengel H., Frank D., Bergfeld M. Process for the Production of Terephtalic Acid Dichloride. (Пат. 3878244 США, 1975)
10. Чернобровкина М. Н. и др. Закономерности образования ангидридов взаимодействием ароматических карбоновых кислот с хлорангидридами // Основной органический синтез и нефтехимия. Ярославль. Вып. 25, 1989. С. 90–98
11. Моцарев Г. В., Успенская И. Н. Хлорпроизводные алкилароматических углеводородов. Получение и переработка. М.: Химия, 1983. 152 с.
12. Титце Л., Айхер Т. Препаративная органическая химия: реакции и синтезы в практикуме органической химии и научно-исследовательской лаборатории. Пер. с нем. М.: Мир, 1999. 704 с.
13. Вулах Е. Л. и др. Синтез фталоилхлоридов хлордегидроксилированием фталевых кислот тионилхлоридом // Основной органический синтез и нефтехимия. Ярославль. Вып. 20, 1989. С. 60–68.
14. Барк Д. С. и др. Получение терефталоилхлорида взаимодействием щелочных солей терефталевой кислоты с тионилхлоридом // Основной органический синтез и нефтехимия. Ярославль. Вып. 14, 1989. С. 51–55.
15. Способ очистки терефталоилхлорида: пат. 2263659 Рос. Федерация. № 2004119352/04; заявл. 24.06.2004; опубл. 10.11.2005.
16. Manufacture of Organic Acid Halides and of Derivates Therefrom (Пат. 401643 Великобритании, 1933).
17. Carnaham J. E. Process of Preparing Dicarboxylic Acid Chlorides (Пат. 2657233 США, 1953).
18. Long R., Marples B. A. Improvements in Acid Relating to the Preparation of Carboxylic Acid Halides (Пат. 987516 Великобритании, 1965).
19. Горпинченко А. В. и др. Основы ресурсосберегающего процесса синтеза дихлорангидрида терефталевой кислоты // Химия и химическая технология. Том 51. Вып. 4, 2008. С. 46–47.
20. Шаяхметов А. И. Технология утилизации кубовых остатков производства терефталоилхлорида // Малоотходные, ресурсосберегающие химические технологии и экологическая безопасность: сборник материалов Всероссийской научно-практической конференции. — Стерлитамак: Фобос, 2013. — С. 120–121.
21. Левашова В. И., Шаяхметов А. И. Способы утилизации кубовых остатков перегонки терефталоилхлорида // Химия и современность: сборник научных статей / Чуваш. гос. пед. ун-т; под ред. Ю. Ю. Пыльчиковой. — Чебоксары: Чуваш. гос. пед. ун-т, 2014. — С. 13–15.







