Гетерополисоединения (ГПС)- сложные в теоретическом отношении представители координационных соединений, находящие применение в различных областях науки и техники. ГПС находят широкое применение как гомогенные и гетерогенные кислотные катализаторы, а как модельные структуры в координационной химии [1]. ГПС представляют собой полиоксосоединения, включающие гетерополианионы (ГПА), построенные из металло-кислородных октаэдров МО6 как основных структурных единиц. ГПА может содержать один или несколько гетероатомов [2,3]. Впервые комплексные молибдаты кобальта были описаны Н.С. Курнаковым в 1900 году [4]. Позднее аммонийная и калиевая соль молибдокобальтата были исследованы Фридгеймом и Келлером [5]. Ранее автором были получены и исследованы методами рентгенофазового, рентгеноструктурного, термогравиметрического и химического анализов гексамолибденокобальтаты аммония, калия, марганца, а также гексамолибденокобальтаты с комплексными катионами: медно-аммиачным [6], цинк- аммиачным и никель- аммиачным катионом.
Настоящая работа посвящена синтезу и исследованию физико-химических свойств кислого гексамолибденокобальтата натрия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Гексамолибденокобальтат натрия был получен по методике [1]. К горячему насыщенному раствору молибдата натрия, подкисленному азотной кислотой до рН 3, добавляли раствор нитрата кобальта (II). Затем приливали 18%-ный раствор перекиси водорода. Полученную смесь нагревали в течение нескольких часов на водяной бане, затем охлаждали в эксикаторе, спустя несколько суток выпадали зеленые кристаллы гексамолибденокобальтата натрия, которые отфильтровывали и несколько раз перекристаллизовывали (рис.1).

Рис.1. Микрофотография Na3[СоMo6O18(OH)6]· 8H2O.
Для определения количественного и качественного состава соединения был проведен масс-спектральный анализ, данные которого представлены ниже:
Найдено, мас.%: Na- 5,57; Со- 4,76; Mo- 46,52; О- 31,02; H2O -11,63.
Для Na3[СоMo6O18(OH)6]· 8H2O
Вычислено, мас.%: Na- 5,59; Со- 4,70; Mo- 46,55; О- 31,03; H2O- 11,65.
РФА проводили на дифрактометре XRD-6000 (CuKα -излучение, Ni фильтр), в качестве внешнего стандарта использовали кремний. Образцы предварительно перетирали в яшмовой ступке. Обработка рентгенограмм включала в себя два этапа. На первом этапе уточняли положение максимума пика, который определяли с помощью программ WinXpow, на втором этапе проводили индицирование рентгенограмм с использованием пакета программ Powder–2. Фазы идентифицировали с помощью банка порошковых рентгенографических данных JCPDS 2001 года обновления.
ИК-спектр соединения записывали на спектрофотометре Perkin-Elmer в интервале частот 200 – 4000 см-1. Образцы готовили в виде таблеток с бромидом калия.
Термогравиметрическое исследование (ТГА) проводили на установке Паулик - Эрдей - Паулик Q-1500 в области температур 20 – 1000ºС, скорость нагревания составляла 10 град/мин, масса навески 100 мг. Эталоном служил прокаленный оксид алюминия.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для подтверждения индивидуальности и чистоты синтезированного соединения, а также для получения кристаллографических данных был проведен рентгенофазовый анализ (рис.2, табл.1). Сопоставление полученных рентгенограмм с базой данных PCPDFWIN показало, что соединение индивидуально, не содержит возможных примесей и относится к моноклинной сингонии со следующими параметрами элементарной ячейки:
а=10.31, b=10.31, c=17.55Ǻ, β=100.93˚, V=1834.77Ǻ3 . Пикнометрическая плотность определена по методу Сыромятникова [7] и составляет ρвыч=3.044 г/см3. Рассчитано число формульных единиц (Z=3).
Таблица 1.
Данные рентгенофазового анализа соединенияNa3[СоMo6O18(OH)6]· 8H2O.
|
№ |
2θ, град |
D,Ǻ |
I,% |
h |
k |
l |
|
1. |
8,75 |
10,08 |
8 |
0 |
0 |
1 |
|
2. |
9,23 |
9,58 |
16 |
1 |
0 |
-1 |
|
3. |
9,95 |
8,88 |
12 |
1 |
1 |
0 |
|
4. |
10,94 |
8,07 |
40 |
1 |
0 |
1 |
|
5. |
14,68 |
6,02 |
23 |
2 |
0 |
1 |
|
6. |
17,49 |
5,06 |
100 |
0 |
0 |
2 |
|
7. |
18,54 |
4,78 |
14 |
2 |
0 |
-2 |
|
8. |
19,53 |
4,54 |
11 |
0 |
1 |
2 |
|
9. |
20,03 |
4,43 |
15 |
2 |
2 |
0 |
|
10. |
21,94 |
4,05 |
17 |
2 |
0 |
2 |
|
11. |
22,52 |
3,94 |
2 |
4 |
1 |
-1 |
|
12. |
24,60 |
3,61 |
9 |
0 |
2 |
2 |
|
13. |
25,43 |
3,49 |
12 |
4 |
1 |
1 |
|
14. |
31,04 |
2,87 |
5 |
5 |
2 |
-1 |
|
15. |
32,43 |
2,75 |
4 |
1 |
3 |
2 |
|
16. |
36,35 |
2,47 |
8 |
2 |
4 |
0 |
|
17. |
39,93 |
2,25 |
3 |
2 |
1 |
4 |
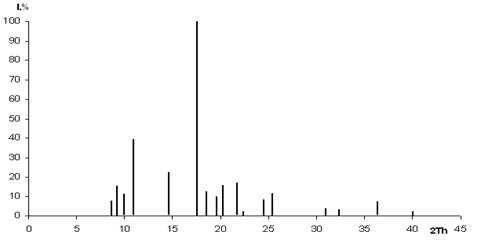
Рис.2. Схема рентгенограммы Na3[СоMo6O18(OH)6]· 8H2O.
Сравнение ИК-спектра синтезированного соединения и ранее изученных ГПС [8] указывает на идентичность, что дает возможность провести соотнесение полос (рис.3). Основные колебания концевых цис-МоО2-групп и мостиковых группировок Мо-О-Мо проявляются в области 1000 – 200 см-1. Интенсивная полоса в виде дублета в области 945- 900 см-1, соответствует асимметричным и симметричным валентным колебаниям концевых цис- МоО2 групп; полосы в пределах 570 см-1 (νs) и сильная полоса в области 640 см-1 (νas) относятся к симметричным и асимметричным валентным колебаниям фрагмента Мо-О.
Вследствие наложения колебаний на спектры нет ярко-выраженной полосы, соответствующей колебаниям связи Со –О. Полосы ниже 400 см-1 обусловлены деформационными колебаниями как цис-Мо-О2 группировок, так и мостиковых связей Мо–О–Мо. Кроме данных полос присутствуют полосы в области 3420 см-1, относящиеся к колебаниям воды и гидроксильных групп.
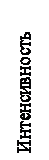
Рис.3. ИК-спектр соединения Na3[СоMo6O18(OH)6]· 8H2O.
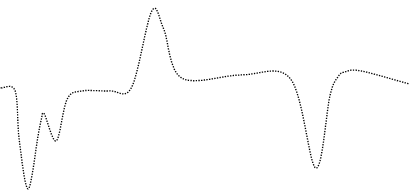
ТГА показал наличие двух эндо- и одного экзотермических эффектов (рис.4). Схема термораспада имеет следующий вид:
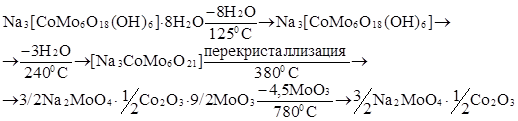
Первый эндоэффект (125ºС) соответствует удалению восьми молекул кристаллизационной воды; второй (240ºС) – выделению гидроксильных групп в виде трех молекул воды. При экзотермическом эффекте (при 380ºС) происходит перекристаллизация и полное разрушение комплексного ГПА. Эндоэффект при 780ºС соответствует удалению 4,5 молекул оксида молибдена.

|
|

|

|

|
|
|

Рис.4. Термодериватограмма (NH4)3[CoMo6O18(OH)6]· 7H2O.
Данное ГПС можно использовать в качестве катализатора в реакции мягкого окисления природного газа, в кварцевом реакторе проточного типа при постоянной температуре 650К.
СПИСОК ЛИТЕРАТУРЫ
1. Никитина Е.А. Гетерополисоединения. М.: Госхимиздат, 1962. 326с.
2. Сергиенко В. С., Порай-Кошиц М. А. // Итоги науки и техники. Сер. “Kристаллохимия”. М.: ВИНИТИ, 1985. Т. 19. С. 79.
3. Порай-Кошиц М. А., Атовмян Л. О. // Итоги науки и техники. Сер. Kристаллохимия. М.: ВИНИТИ, 1985. Т. 19. С. 3.
4. Mizuno N., Misono M. // J. Molec.Catal. 1994. V.86, P.319.
5. Friedheim C.,Keller F. //Ber. 1906. V.39. P.4304.
6. S. Holguin Quinones, Казиев Г.З., Орешкина А.В. и др. // Журн. неорган. химии. 2005. Т.50. №11. С.1813.
7. Сыромятников Ф.В. // Мин. Сырье. 1930. №6. С.908.
8. Накамото К. ИК спектры и спектры КР неорганических и координационных соединений. М.: Мир, 1991. 536с.







