Водные растворы короткоцепочечных жирных кислот С2-С6 экстрагировали метил-трет-бутиловым эфиром. Рассчитаны количественные характеристики (коэффициенты распределения, степень извлечения процесса), построены изотермы экстракций для карбоновых кислот — от уксусной до капроновой, включая изокислоты: изомасляную, изовалериановую, изокапроновую. Исследовано влияние высаливателя сульфата аммония на эффективность экстракции, для каждой кислоты построены графики зависимости логарифма отношений констант распределения lgDs/Dот концентрации высаливателя, найдены коэффициенты высаливания.
ВВЕДЕНИЕ
Короткоцепочечные жирные кислоты (КЖК) — это низшие карбоновые кислоты (от уксусной до капроновой, а также изокислоты: изомасляная, изовалериановая, изокапроновая), они содержатся в организме человека, где образуются главным образом из неперевариваемых углеводов или аминокислот в кишечнике бактериальной ферментацией [1]. В последнее время растет интерес к жирным кислотам, так как выяснилось, что они являются биомаркерами во многих заболеваниях, а также нарушений метаболизма, как гипогликемии и ацидоза. Изучение спектра КЖК в сыворотке крови также позволяет изучить исходное состояние микробного пейзажа кишечника, произвести сравнительный анализ дисбиотических нарушений у людей с различными хроническими заболеваниями пищеварительного тракта [2].
В связи с этим перед современной медициной встала задача разработки точной и экспрессной методики для определения КЖК в крови человека. Определение микроколичеств КЖК в крови на фоне большого числа примесей требует правильного выбора способа подготовки анализируемой пробы к анализу. Наиболее эффективным в данном случае оказалось применение способа жидкостной экстракции, который к тому же является и наиболее простым в техническом исполнении [3]. Экстракционное извлечение КЖК из растворов с малой концентрацией с целью последующего определения физико-химическими методами анализа остается малоизученным. Для повышения степени экстрагирования из водных растворов часто применяют высаливание, процессы высаливания-всаливания при экстракции органических компонентов достаточно хорошо изучены [4]. Однако отсутствие данных по высаливанию карбоновых кислот ограничивает применение этой методики при определении КЖК в сыворотке крови человека.
Жидкостно-жидкостная экстракция имеет особенное значение в определении карбоновых кислот в плазме крови человека методом ГЖХ, где требуется максимально полно извлечь в органическую фазу полярные компоненты и оставить в водной среде малополярные. В большинстве методик предлагается использовать в качестве экстрагента диэтиловый эфир [5]. И это можно объяснить тем, что в ряду гомологичных экстрагентов с увеличением молекулярной массы константы распределения должны понижаться, так как понижаются их мольные концентрации, т.е фактически уменьшается число активных групп в объеме растворителя (т.н. упаковочный эффект). Поэтому самой высокой экстракционной способностью должен обладать диэтиловый эфир, а затем уже эфиры с большей молекулярной массой.
Но диэтиловый эфир очень летуч (Ткип = 34.6 ºС), что налагает большую погрешность и переоценку кислот в органической фазе. Нами было предложено использование метил-трет-бутилового эфира (МТБЭ) в качестве экстрагента, в виду того, что он менее летуч (Ткип = 55.2ºС), доступен, малотоксичен [6], и абсолютно не образует перекисных соединений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Микрошприцом точно отмеряли рассчитанные объемы карбоновых кислот в пластмассовые пробирки на 15 мл с плотно завинчивающейся крышкой, в каждую стеклянной пипеткой внесли по 1 мл бидистиллированной воды, хорошо перемешивали. В водные растворы карбоновых кислот различной концентрации (1 мл) вносили стеклянными пипетками по 1 мл 0,1 н. соляной кислоты и 2 мл метил-трет-бутилового эфира. Перемешивали в течении 25 минут, затем оставляли на 10 минут для полного расслоения фаз. Медицинскими стерильными шприцами на 1000 мкл (инсулиновыми) отбирали верхнюю фазу, переносили в пронумерованные центрифужные микропробирки и проводили газо-хроматографический анализ. Пипеткой на 1 мл отбирали нижний слой водной фазы и повторно экстрагировали 1 мл метил-трет-бутиловым эфиром, отбирали верхний органический слой, проводили газо-хроматографический анализ.
Для приготовления водно-солевых растворов водные растворы кислот объемом 1 мл помещали в пластмассовые пробирки на 15 мл с плотно завинчивающимися крышками, затем вносили стеклянными пипетками по 1 мл раствора высаливателя сульфата аммония различной концентрации (5,8 М; 4,0 М; 3,0 М; 2,0М; 1,0М; 0,5М в 0,1 н. соляной кислоте) и 2 мл метил-трет-бутилового эфира. Далее экстракцию проводили по вышеописанной методике.
Анализ проводили на газовом хроматографе Shimadzu GC-2014 с пламенно-ионизационным детектором, кварцевой капиллярной колонкой HP-Innowax (Agilent) 30 метров, с внутренним диаметром 0.25 мм, толщиной пленки 0.25 мкм. Режим с делением потока. Газ-носитель — гелий, скорость общего потока 50 мл/мин, скорость потока колонки 1,07 мл/мин, линейная скорость 28,4 см/с. Температура испарителя 240 ºС, Температура детектора 240 ºС. Режим термостатирования колонки: от 80 ºС повышали до 150 ºС со скоростью 6 ºС в минуту, термостатировали в течении одной минуты, затем снова повышали до 200 ºС со скоростью 15 ºС в минуту, и выдерживали 15 мин при 200 ºС. Объем вкола 0,4 мкл. Для предотвращения загрязнения и порчи колонки каждые пять раз промывали капиллярную колонку смесью муравьиной кислоты (12 %) в МТБЭ.
Расчеты вели по формулам: D = У/Х
D — коэффициент распределения
Х — концентрация кислоты в водной фазе.
У — концентрация кислоты в органической фазе
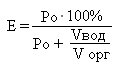
E — степень извлечения, %
Po — константа распределения
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
В хроматограф с пламенно-ионизационным детектором нежелательно закалывать водные растворы во избежание порчи детектора, кроме того, присутствие воды способствует уносу неподвижной жидкой фазы с колонки. Поэтому, при определении коэффициента распределения кислот D, который равен отношению равновесных аналитических концентраций кислоты в органической и водной фазах, в качестве концентрации кислоты в водной фазе мы принимали значение концентрация кислоты в органической фазе после второго экстрагирования. Такое приближение справедливо для кислот с высокой степенью извлечения, для самых низкоцепочечных кислот — уксусной и пропионовой — концентрацию в водной фазе определяли по разнице исходных значений и концентрации в органической фазы после первой экстракции.
Для растворов карбоновых кислот различной концентрации измеряли коэффициенты распределения и строили изотермы экстракций. На рисунке 1 изображены изотермы экстракции изокапроновой кислоты в координатах Y=f(X), lgY= f(lgX) и D = f(X).
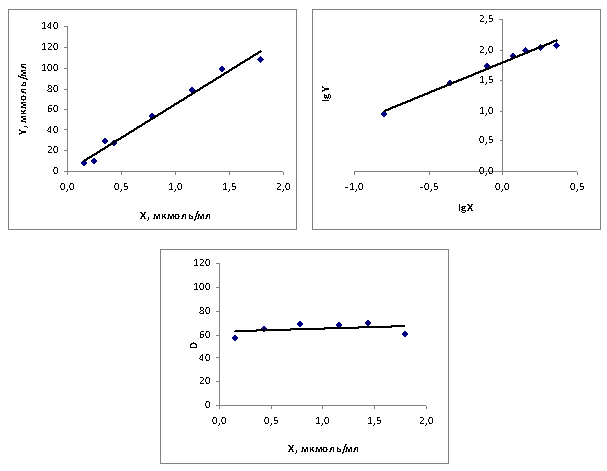
Рис. 1. Изотермы экстракции изокапроновой кислоты метил-третбутиловым эфиром
Исходные концентрации брали от 8 до 120 мкмоль/мл, коэффициенты корреляции составляли 0,967–0,991. Вид графиков свидетельствует об отсутствии процессов полимеризации и диссоциации кислот в органической и водной фазе. В этом случае коэффициенты распределения практически равны константе распределения Ро, не зависящей от равновесных концентраций кислоты в органической и водной фазах и являющейся фундаментальной константой. Константу распределения находили по отсечению D на оси ординат графика D = f(X).
Отсечение на оси ординат графика lgY= f(lgX) равен логарифму константы распределения lgP0, что следует из схемы, 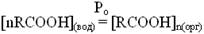 отражающей процесс распределения молекул кислоты (RCOOH) из водной в органическую фазу с некоторой константой распределения, которую можно представить как Ро = У/Хn. Логарифмируя, получим уравнение lg Y = lgP0 + nlgX. [7]
отражающей процесс распределения молекул кислоты (RCOOH) из водной в органическую фазу с некоторой константой распределения, которую можно представить как Ро = У/Хn. Логарифмируя, получим уравнение lg Y = lgP0 + nlgX. [7]
В таблице 1 отображены константы распределения и степени извлечения короткоцепочечных жирных кислот из водных растворов метил-третбутиловым эфиром. Установлено, что наиболее эффективно экстрагируются кислоты с большим числом углеродных атомов, и что изокислоты по сравнению с неразветвленными кислотами извлекаются в большей степени.
Таблица 1
Коэффициенты распределения (Po), степени извлечения (R) и коэффициенты высаливания (k)* КЖК метил-трет-бутиловым эфиром.
|
Кислота |
Ро |
E, % |
k |
|
уксусная |
0,85 |
45,9 |
0,081 |
|
пропионовая |
2,4 |
70,6 |
0,112 |
|
масляная |
4,1 |
80,4 |
0,153 |
|
изомасляная |
4,2 |
80,8 |
0,169 |
|
валериановая |
20,2 |
95,3 |
0,175 |
|
изовалериановая |
24,4 |
96,1 |
0,198 |
|
капроновая |
58,5 |
98,3 |
0,295 |
|
изокапроновая |
62,1 |
98,4 |
0,297 |
* высаливатель — сульфат аммония
Была построена зависимость логарифма константы распределения от числа углеродных атомов в кислоте. Данная зависимость описывалась прямой с тангенсом угла наклона 0,460.
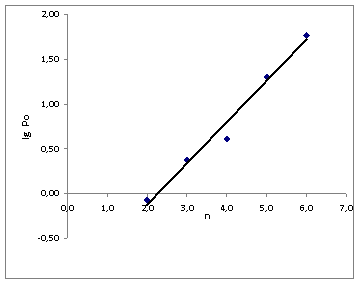
Рис.2. Зависимость lgРо от числа углеродных атомов в КЖК при экстракции МТБЭ
Изучено распределение КЖК в системах МТБЭ–высаливатель–водный раствор. В идентичных условиях установлены коэффициенты распределения (D), исследовано влияние концентрации высаливателя на величину D. Влияние концентрации высаливателя в водной фазе на величину D экстрагируемого вещества отражает уравнение Сеченова: lg(Ds/D)=kCs, где D — коэффициент распределения экстрагируемого вещества при нулевой концентрации высаливателя в водной фазе; Ds — коэффициент распределения экстрагируемого вещества в растворе с высаливателем, С — концентрация соли в водной фазе, моль/л;k — коэффициент высаливания.
Насыщение водного раствора кислот сульфатом аммония приводит к значительному возрастанию коэффициентов распределения. Установлено, что с повышением числа углеродных атомов в кислоте, константа высаливания возрастает, константы высаливания изокислот выше, чем константы высаливания карбоновых кислот нормального строения, что отражено в таблице 1.
Литература:
1. Ewaschuk J. B., Gordon A. Z., et al., J of Chrom. B., Vol. 781, (2002), p. 39–56.
2. Cruwys J. A., Dinsdale R.M, Hawkes F. R. et al., J of Chrom. A., Vol. 945, (2002), p. 195.
3. Коренман И. М. Экстракция в анализе органических веществ. М., «Химия», 1977. — С. 145–147.
4. Москвин Л.Н, Родинков О. В. Методы разделения и концентрирования в аналитической химии. Долгопрудный, «Интеллект», 2011. — С. 57–70
5. B. Bleiberg, J. J. Steinberg, S. D. Katz, et al., J of Chrom. B., Vol 568, (1991), р. 301–308
6. Егуткин Н. Л., Файзрахманова И. М., Сыркин А. М. Закономерности экстракции фенола и двухатомных фенолов метил-трет-бутиловым эфиром // Каталог докладов Международной конференции «Экстракция органических соединений», Воронеж 2005. — С. 139.
7. Чарыков. А.К., Осипов. Н. Н. Карбоновые кислоты и карбоксилатные комплексы в химическом анализе. Л., «Химия», 1991. — С. 99–139.







