- 1. Введение
Все неорганические материалы в виде чрезвычайно мелких частиц обладают способностью к обмену катионов. Существует две основные причины, обусловливающие емкость катионного обмена глинистых минералов:
1. Замещения внутри структуры четырехвалентного кремния трехвалентным алюминием в тетраэдрических сетках и трехвалентного алюминия ионами низшей валентности, обычно магнием, в октаэдрических сетках. Подобные замещения приводят к появлению отрицательного нескомпенсированного заряда структурной ячейки. В глауконите ионом компенсатором является К+.
2. Разрыв химических связей в тетраэдрических и октаэдрических сетках кристаллов минерала приводит, в конечном счете, к появлению на его боковых гранях гидроксильных групп, ион водорода которых при определенных условиях может вступать в реакцию обмена. Количество нарушенных связей, а, следовательно, и величина обменной способности в этом случае возрастают по мере уменьшения размера частиц. На боковых гранях слоистых силикатов присутствуют кислые Si-OH, основные Al-OH, Fe-OH и Mg-OH группировки, и координационно ненасыщенные ионы Al3+, Fe3+ и Mg2+. Группировки основного характера Me3+-OH и координационно ненасыщенные ионы Al3+ или Fe3+, являются теми основными центрами, которые определяют сорбционные и каталитические свойства этих веществ.
Молекулярное моделирование структуры слоистых силикатов на примере глауконита позволяет реально оценить не только геометрические факторы сорбции (преимущественную локализацию ионов), но и произвести ряд термодинамических расчетов, объясняющих природу, химизм сорбции, а также сопоставить теоретические и экспериментальные данные по сорбции различных элементов на глауконите.
2. Экспериментальная часть
Сорбция редкоземельных элементов: лантана, гадолиния, иттрия, (далее РЗЭ) на глауконите, в К форме, изучали в интервале равновесных концентраций 0 – 0,1 моль/л, при рН = 5. Сорбцию РЗЭ на глауконите осуществляли через ряд последовательных действий:
а) насыщение (взаимодействие с раствором соли РЗЭ) глауконита, высушивание образцов после сорбции до воздушно-сухого состояния;
б) обработка глауконита 0,1 М КОН;
в) отмывка глауконита до нейтрального рН, с последующим высушиванием до воздушно-сухого состояния.
Кинетику сорбции ионов гадолиния глауконитом изучали методом ограниченного объема. Для этого в конические колбы помещали навески глауконита, растворы нитрата гадолиния постоянной концентрации, растворы хлорида калия для поддержания постоянной ионной силы. Через определенные промежутки времени производили разделение раствора и сорбента, и определяли содержание ионов гадолиния в маточном растворе.
Молекулярное моделирование структуры производилось после математического расчета геометрических координат каждого из атомов фрагмента структуры глауконита на основе справочных данных о длинах связей. С использованием генетического алгоритма оптимизации при поиске структуры, отвечающей минимуму потенциальной энергии, производили оптимизацию геометрии структуры глауконита. Учет влияния соседних ячеек производился в модифицированном приближении Борна для кристаллических тел. Расчет энергии межатомного взаимодействия в системе производился с помощью потенциала Леннард – Джонса:
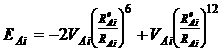 ,
где VAi
–
глубина минимума на кривой зависимости потенциальной энергии от
межатомного расстояния RAi;
ReAi
– значения равновесного расстояния между атомами А и i,
соответствующие минимальной энергии.
,
где VAi
–
глубина минимума на кривой зависимости потенциальной энергии от
межатомного расстояния RAi;
ReAi
– значения равновесного расстояния между атомами А и i,
соответствующие минимальной энергии.
Полная энергия (E) взаимодействия в системе представляется в виде суммы вкладов кулоновских (EQ) и ван-дер-ваальсовых взаимодействий (EVDW).
В рамках программы DENSON/MERA for Solutions произведено моделирование взаимодействий в системе «глауконит – вода – катион металла – противоион».
3. Обсуждение результатов
3.1. Сорбция ионов иттрия, гадолиния, лантана
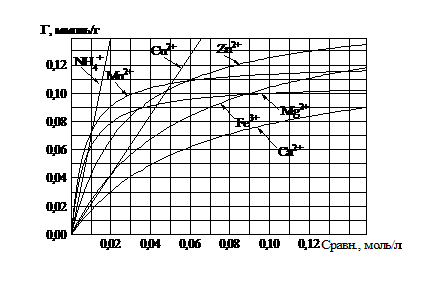
Глауконит к катионам иттрия, гадолиния, лантана, по сравнению с элементами низших периодов, проявил повышенную (сверхстехиометрическую) обменную способность, которая составила 0,2 – 0,3 ммоль/г, в интервале равновесных концентраций 0…0,1 моль/л. В сравнении, предел насыщения глауконита ионами кальция, железа, магния, цинка, меди, марганца не превышает 0,15 ммоль/г, в том же интервале равновесных концентраций (рис. 1).
Рис. 1. Сводный график. Изотермы сорбции ионов кальция, железа, магния, цинка, меди, марганца, ионов аммония глауконитом в Na-форме
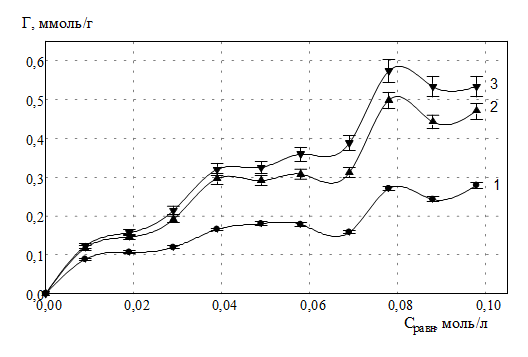
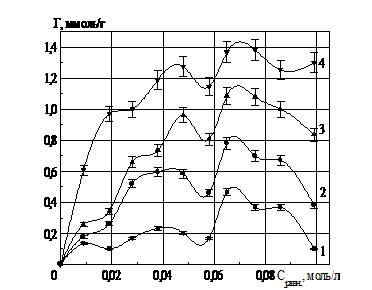
При повторной сорбции ионов РЗЭ на глауконите (рис. 2, 3, 4), отмечается аддитивное увеличение количества сорбированных ионов РЗЭ, перешедших в фазу глауконита. На изотермах сорбции ионов РЗЭ используются следующие обозначения: 1,2,3… n – n-й раз взаимодействия соли РЗЭ и глауконита.
Рис. 2. Изотермы сорбции ионов гадолиния глауконитом в К-форме
При сорбции РЗЭ на поверхности глауконита происходит сополимеризация изначально гидратированных форм ионов РЗЭ конденсированной фазой соответствующих оксигидратов, образовавшихся в результате обработки системы сорбент – сорбированное вещество щелочью. В результате процесса взаимодействия гидратированных ионов РЗЭ с оксигидратной полимерной матрицей образуется кислота. При этом происходит ол - связывание ионов металлов с алюмосиликатной матрицей глауконита. Ионы водорода перходят в раствор сорбата. В стесненых условиях сорбции ионов РЗЭ на глауконите маловероятным представляется формирование активного сорбционного комплекса, который формируется в результате сорбции свободных ионов гидроксония Н3О+ полимерными оксигидратными фрагментами РЗЭ. Ионы гидроксония в случае системы с глауконитом выводятся в сорбат. По этой причине нами экспериментально обнаружено сильное подкисление растворов в результате сорбции исследуемых ионов.
Рис. 3. Изотермы сорбции ионов лантана глауконитом в К- форме
Рис. 4. Изотермы сорбции ионов иттрия глауконитом в К- форме
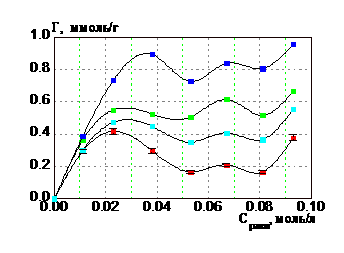
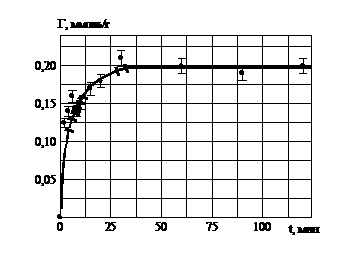
3.2. Кинетика сорбции ионов гадолиния глауконитом
Автоволновый механизм сорбции РЗЭ на глауконите, связан с формированием гелевых матриц оксигидратов РЗЭ, которые осуществляются при помощи автоволнового механизма. Кинетическая зависимость (рис. 5) свидетельствует о внешнедиффузионной сорбции, которая происходит на поверхности глауконита. Ионы гадолиния взаимодействуют с гелевой матрицей (в виде пленки на глауконите) по ионообменному механизму, о чем свидетельствует выделение в раствор Н+ ионов после сорбции.
Рис. 5. Кинетика сорбции ионов гадолиния глауконитом
3.3. Молекулярное моделирование сорбционной системы
Величина сорбции при постоянной равновесной концентрации является отражением константы равновесия «раствор – поверхность» и, таким образом, зависит экспоненциально от энергетических характеристик модельной системы или логарифм величины сорбции зависит линейно от энергетических характеристик модельной системы. Экспериментально измеренные характеристики сорбции сопоставлены с результатами расчетов. В качестве опорной характеристики сорбции принято значение Г (ммоль/г) при равновесной концентрации катиона Сравн. = 0,10 моль/л, поскольку значение сорбции определено для всех исследованных катионов.
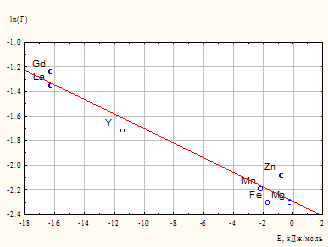
По рассчитанным значениям полной энергии взаимодействия в исследуемой системе построена зависимость в координатах ln(Г) = f(Е), где наблюдается существенная линейная взаимосвязь логарифма величины адсорбции с полной энергией взаимодействия катиона металла с компонентами системы. График зависимости приведен на рис. 6.
Достаточно важной является существенная зависимость способности к адсорбции от энергии ван-дер-ваальсовых взаимодействий. Катионы La3+, Gd3+, Y3+ обладают крупной электронной оболочкой с хорошо поляризуемыми d (а гадолиний и f) электронными уровнями. Последнее, в соответствии с формулой Лондона и соотношением Клаузиуса-Моссотти, приводит к наличию высокого потенциала дисперсионных взаимодействий, являющихся важнейшей составляющей ван-дер-ваальсовых взаимодействий. Это и обеспечивает лучшую сорбируемость данных катионов на глауконите.
Рис. 6. Зависимость величины логарифма сорбции (Г, ммоль/г) от полной энергии взаимодействия (Е) катиона металла с компонентами системы
Следует отметить, что энергии ван-дер-ваальсовых взаимодействий катионов редкоземельных элементов весьма велики по абсолютной величине (табл. 1) и имеют порядок сходный с энергиями специфических взаимодействий, таких как водородная связь или контакты галоген - галоген.
Таблица 1
Рассчитанные энергии взаимодействия катионов с компонентами системы «глауконит – вода – катион металла – противоион»
|
Катион |
E, кДж/моль |
EVDW, кДж/моль |
EQ, кДж/моль |
|
La3+ |
-16,3 |
-11,6 |
-4,7 |
|
Gd3+ |
-16,3 |
-13,4 |
-2,9 |
|
Y3+ |
-11,5 |
-11,1 |
-0,4 |
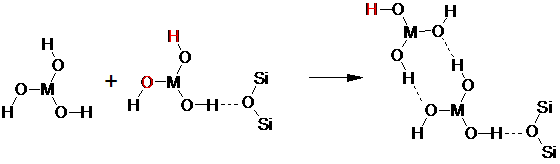
Образование водородных связей оксигидратной формы редкоземельного элемента с атомами кислорода глауконита можно представить следующим образом:
В этом случае, оставшаяся свободная пара гидроксильных групп, может инициировать последующий рост цепочки полимерного оксигидрата. Выделенные атомы, способные к дальнейшему образованию водородных связей.
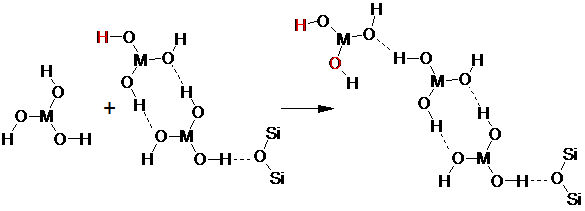
Данный процесс может обусловливать вид кривых, наблюдаемых при многократной сорбции (рис. 2, 3, 4), поскольку сорбция второй частицы М(ОН)3 на изоструктурной частице с образованием двух водородных связей имеет преимущество. Сорбция третьей частицы должна протекать несколько хуже, поскольку свободной для водородной связи у внешней частицы остается только один атом водорода. Сорбция четвертой частицы вновь должна протекать лучше вследствие образования двух потенциальных центров образования водородных связей и т.д.:
Поскольку рост цепей при многократной сорбции начинает происходить асинхронно, то в адсорбционном слое одновременно начинают присутствовать цепочки с одним и двумя концевыми центрами образования водородной связи.
Следует отметить также конкурирующее влияние воды на данный процесс. Очевидно, что для сорбции, оксигидратная частица должна, во-первых освободится от собственной сольватной оболочки; во-вторых, вытеснить воду с поверхности глауконита.
4. Заключение
Высокая специфичность глауконита к редкоземельным d , f элементам обусловлена ван-дер-ваальсовыми взаимодействиями, где решающий вклад оказывают дисперсионные силы. Предложенный механизм сорбции (образование водородных связей оксигидратной формы редкоземельного элемента с атомами кислорода глауконита) подтверждает колебательный характер сорбции РЗЭ на глауконите.
-
- Литература:
Николаева, И.В. Кристаллохимические особенности минералов группы глауконита в решении вопросов палеографии, геохронологии и эволюции осадконакопления / И.В. Николаева, Э.В. Бородаевская, Г.А. Голубова // Кристаллохимия минералов и геологические проблемы. М.: Наука, 1972. – С. 69 – 74
Григорьева, Е.А. Сорбционные свойства глауконита Каринского месторождения: Дис. … канд. хим. наук. Южно–Уральский гос. Ун-т. Челябинск, 2004. 140 с.
Сухарев, И.Ю. Математическое моделирование структуры глауконита уральского месторождения / И.Ю. Сухарев, В.А. Потемкин, Е.А. Григорьева // Известия Челябинского центра УрО РАН, 2004. – Вып. 1. С. 136 – 140