The article concerns studies of effect of decreased activity of serotonergic system on the level of mutagenic changes (micronucleus test) in gobies (Neogobius fluviatilis) and sturgeon juveniles (Acipenser gueldenstaedti persicus). It is shown that prolonged exposure of animals to the industrial and oil pollution leads to significant decrease of the level of serotonin-modulating anticonsolidation protein (SMAP) being in linear relationship with the serotonin level, in the liver and, simultaneously, to acute elevation of Micronuclei level in erythrocytes. Intramuscular administration of ant-SMAP polyclonal antibodies to the sturgeon juveniles induces significant increase of micronuclei amount in erythrocytes relatively to the group of animals injected with non-immune γ-globulins. The results give grounds to make a conclusion that downregulation of serotonergic system activity presents the mechanism launched by adverse environmental factors and realizing mutagenic damages in the modified genetic apparatus.
Key words: serotonin-modulating anticonsolidation protein (SMAP), mutagenic changes, industrial and oil pollution, polyclonal antibodies to SMAP.
Неблагоприятные факторы окружающей среды различной природы вызывают значительное изменение активности серотонинергической системы в тканях животных. В частности, повышенная солёность воды (1%-ный раствор NaCl) приводит к резкому увеличению уровня серотонина и дофамина в структурах головного мозга мальков карпа [1]. хроническая экспозиция рыб в воде, содержащей примеси меди [2] и ртути [3], приводит к значительному снижению уровня серотонина в тканях животных. В исследованиях, проведенных на ракообразных, было показано, что длительная экспозиция животных в воде, содержащей примеси тяжёлых металлов и органических соединений, оказывает негативное воздействие на обмен серотонина, приводя к снижению его уровня [4]. Вместе с тем, большинство неблагоприятных факторов обладают способностью индуцировать мутагенные изменения в тканях [5, 6]. В этой связи представляет несомненный интерес изучение роли серотонинергической системы в развитии мутагенных изменений.
Материалы и методы исследований
Работа выполнена на бычках (Neogobius fluviatilis), обитающих в прибрежной зоне Каспийского моря и ведущих осёдлый образ жизни, и на молоди осетров (Acipenser gueldenstaedti persicus). Бычки (по 7 особей) были выловлены в двух зонах – в относительно чистой и в зоне, характеризующейся высоким уровнем загрязнения железом, цинком и полиароматическими углеводородами. У животных брали пробы крови из хвостовой вены, делали мазки на предметных стёклах, окрашивали по Романовскому-Гимзе и под световым микроскопом подсчитывали количество микроядер в 2000 эритроцитов, пересчитывая полученное количество на 1000 клеток. Одновременно у животных забирали пробы печени, экстрагировали водорастворимые белки и определяли содержание серотонин-модулируемого антиконсолидационного белка (СМАБ) методом твёрдофазного иммуноферментного анализа на полистироловых планшетах. При проведении анализа в качестве антигенов использовали суммарные белки печени осетров, экстрагированные в 0,05 М фосфатном буфере (рН 7,2-7,4), содержавшем 0,3 М NaCl, 5 мМ ЭДТА и 0,1%-ный тритон Х-100 и доведённые до концентрации 20 мкг/мл с помощью 0,1 М буфера трис-HCl (pH 8,6). Каждую пробу дублировали трижды и по завершении реакции вычисляли среднюю арифметическую из значений трёх проб. Концентрацию белка определяли по методу Бредфорд с использованием 0,01%-ного раствора Кумасси бриллиантового синего G-250, на длине волны 595 нм [10]. в качестве первых антител использовали кроличьи иммуноглобулины к белку СМАБ, а в качестве вторых антител – противокроличьи козьи иммуноглобулины с конъюгированной пероксидазой хрена. Визуализацию реакции осуществляли с помощью субстрата пероксидазы хрена – 0,05% -ного раствора ортофенилендиамина в 0,05 М цитрат-фосфатном буфере (pH 4,5). Реакцию останавливали через 20 мин после добавления субстрата путем приливания в лунки 3 М раствора NaOH, а результаты реакции считывали на фотометре для иммуноферментного анализа “StatFax 303” (Awareness, США) на длине волны 492 нм. Результаты исследования усредняли по группам и сравнивали по t–критерию Стьюдента.
Во второй серии экспериментов, выполненных на годовалой молоди осетров, животных разбили на 3 группы: 1) группа интактных животных (n=7); 2) группа животных, находившихся в течение 5 сут в пресной воде, содержавшей нефть из месторождения «Нефтяные камни» в концентрации 100 мг/л (n=7); 3) группа животных, находившихся в течение 15 сут в пресной воде, содержавшей нефть в той же концентрации (n=7). По завершении экспериментов у осетров брали пробы крови из хвостовой вены для проведения микроядерного теста, а также пробы печени для определения уровня СМАБ методом иммуноферментного анализа. Результаты исследования усредняли по группам и сравнивали по t–критерию Стьюдента.
В третьей серии исследования также осуществляли на молоди осетров весом 10-15 г и были использованы 3 группы животных: 1) группа интактных животных (n=11); 2) группа животных (n=10), которым внутримышечно вводили кроличьи неиммунные γ-глобулины в концентрации 1,5 мг/мл и объёме 0,7 мл (в целях контроля неспецифических эффектов гетерологических антител); 3) группа животных (n=9), которым вводили кроличьи поликлональные антитела к белку СМАБ в таком же количестве. Антитела к СМАБ очищали из раствора иммуноглобулинов, полученных в результате 5-6-месячной иммунизации кроликов этим белком, методом аффинной хроматографии на колонке CNBr-сефарозы с предварительно иммобилизованным СМАБ. СМАБ выделяли в препаративных количествах из головного мозга быка описанным ранее способом [7]; гомогенность выделенного белка оценивали методом электрофореза в полиакриламидном геле в трис-глициновой буферной системе (рН 8,3). Инъекции неиммунных γ-глобулинов и антител молоди осетров осуществляли дважды: в 1-ый день и через 24 ч. На 3-ьи сут после первой инъекции у животных из хвостовой вены забирали пробы крови для проведения микроядерного теста. Результаты исследования усредняли по группам и сравнивали по t-критерию Стьюдента.
Результаты и обсуждение
СМАБ был ранее идентифицирован в коре головного мозга и выделен из целого мозга крыс, определены его физико-химические свойства и участие в интегративной деятельности нервных клеток, в частности, в процессе консолидации следов памяти [7]. Биохимическими исследованиями, выполненными на коре головного мозга наркотизированных крыс [7, 8], и электрофизиологическими исследованиями, связанными с регистрацией нейрональной активности на идентифицированных командных нейронах моллюсков [9], было показано, что содержание СМАБ в нервных клетках животных находится в прямой зависимости от уровня серотонина. Указанный факт позволяет оценивать внутриклеточную активность серотонинергической системы по уровню СМАБ в исследуемых тканях, а также целенаправленно воздействовать на активность этой системы путём введения в организм самого белка или антител к нему.
В результате проведенных исследований на бычках было установлено, что в микроядерном тесте количество микроядер в эритроцитах рыб из загрязнённой зоны значительно превышало их количество у животных из чистой зоны (p<0,001; Рис.1А). При изучении содержания СМАБ в печени бычков было обнаружено его значительное снижение у животных, выловленных из загрязнённой зоны, по сравнению с животными из чистой зоны (p<0,001; Рис. 1Б).
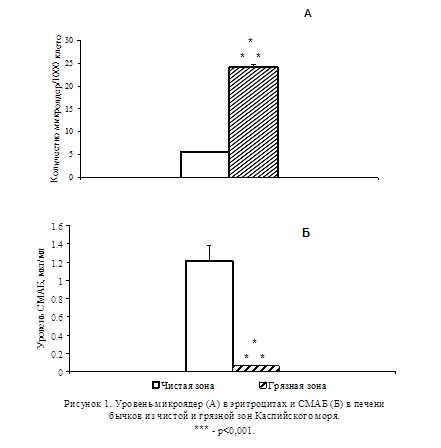
В модельных экспериментах при экспозиции молоди осетров в загрязнённой нефтью воде в течение 5 сут не отмечалось увеличения уровня микроядер в эритроцитах (Рис.2А). При этом уровень СМАБ в печени подопытных животных не отличался от контрольного (Рис. 2Б). В то же время в группе животных, содержавшихся в загрязнённой нефтью воде на протяжении 15 сут, наблюдалось резкое увеличение количества микроядер в эритроцитах (p<0,01; Рис. 2A), сопровождавшееся заметным снижением уровня СМАБ в печени (p<0,01; Рис. 2Б).
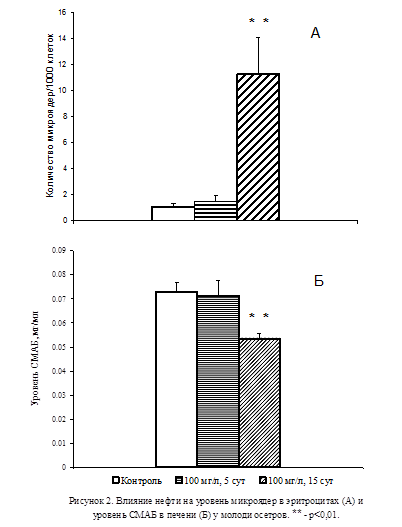
Результаты проведенных исследований позволили придти к заключению о том, что при воздействии на организм неблагоприятных факторов снижение активности серотонинергической системы в тканях организма является неотъемлемой частью возрастания уровня мутагенных изменений. Для выявления роли активности серотонинергической системы в формировании мутагенных изменений в тканях были проведены эксперименты, в которых осуществляли избирательную блокаду активности СМАБ с помощью поликлональных антител.
В этих экспериментах двукратное внутримышечное введение антител к СМАБ приводило к значительному увеличению (на 56%) количества микроядер в эритроцитах молоди осетров по сравнению с животными, которым в таком же количестве вводили неиммунные γ-глобулины (p<0,01; Рис. 3). При этом, введение неиммунных γ-глобулинов вызывало увеличение уровня микроядер в эритроцитах относительно этого показателя интактных животных (p<0,05; Рис. 3), свидетельствующее о наличии токсических эффектов у использованных гетерологических неиммунных γ-глобулинов и антител. Полученные результаты продемонстрировали, что ингибирование активности серотонинергической системы индуцирует возникновение мутагенных изменений в тканях и что снижение активности этой системы может лежать в основе механизма формирования мутаций в клетках различных тканей при воздействии на организм неблагоприятных факторов окружающей среды.
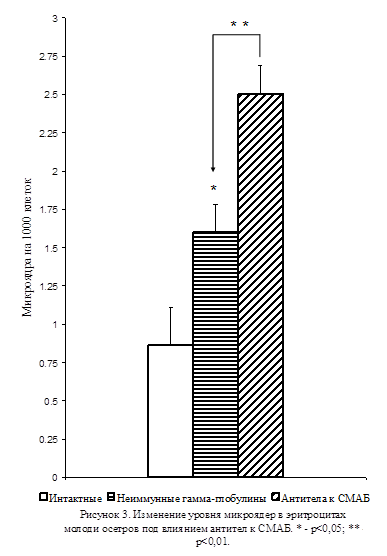
Из литературы известно, что формирование микроядер в результате воздействия на организм животных неблагоприятных факторов происходит в период клеточного деления [11, 12, 13]. Возможно, это обусловлено большей уязвимостью хроматина в связи с конформационными перестройками, которые он претерпевает в этот период клеточного цикла. В тканях зрелого организма пролиферативная активность клеток, как известно, снижена. вместе с тем, вследствие того, что серотонин реализует свои функции внутри клеток посредством модуляции активности отдельных генов [14], снижение его уровня под влиянием неблагоприятных факторов, вероятно, будет способствовать включению генов, которые активно функционируют на эмбриональных стадиях развития, что приведёт к обретению зрелыми клетками свойств, присущих эмбриональным, в частности, высокой пролиферативной активности. В условиях эксперимента была, в частности, продемонстрирована способность миобластов мышей к дедифференциации с утратой ими специфических миогенных маркеров (MyoD и миозин) и предотвращением наступления последующих этапов клеточной дифференциации – формирования мышечных трубок [15]. Из сказанного следует, что образование микроядер в условиях воздействия на организм неблагоприятных факторов может быть обусловлено опосредованное сниженным уровнем активности серотонинергической системы переключением работы зрелых клеток на режим высокой митотической активности, повышающей риск возникновения мутагенных повреждений генетического аппарата.
Подтверждением правомочности предложенного механизма возникновения мутагенных изменений под влиянием неблагоприятных факторов являются результаты воздействия антител к СМАБ на уровень микроядер у молоди осетров. Целью данной серии исследований являлось моделирование влияния неблагоприятных факторов на уровень микроядер путём одного только искусственного снижения активности серотонинергической системы. Значительное увеличение уровня микроядер в эритроцитах в условиях блокады СМАБ антителами относительно группы животных, которым вводили кроличьи неиммунные γ-глобулины (что, таким образом, исключает неспецифический характер эффектов гетерологичных антител), свидетельствует о том, что снижение уровня СМАБ в печени бычков и осетров, подвергнутых длительному воздействию промышленного и нефтяного загрязнения, носит не сопутствующий характер, а, вероятно, является механизмом, запускаемым неблагоприятными факторами и реализующим мутагенные поломки в модифицированном генетическом аппарате.
В рамках описанной схемы становятся понятными результаты ранее проведенных исследований, в которых был продемонстрирован антимутагенный характер влияния экзогенно введённого СМАБ, повышающего внутриклеточную активность серотонинергической системы [16]. В этом случае, предварительное введение СМАБ молоди осетров, подвергнутым воздействию неблагоприятных факторов химической природы, вероятно, индуцировало перевод клеток в фазу митотического покоя и соответствующие конформационные перестройки хроматина, обеспечивающие его защиту от мутагенных повреждений.
Литература
1. De Boeck G., Nilsson G.E., Vlaeminck A., Blust R. Central monoaminergic responses to salinity and temperature rises in common carp // J. Exper.Biol. 1996. V. 199, № 7, p.1605-1611.
2. Handy R.D. Chronic effects of copper exposure versus endocrine toxicity: two sides of the same toxicological process?// Comparative Biochemistry and Physiology – Part A: Molecular & Integrated Physiology, 2003, V. 135, № 1, pp. 25-38.
3. Tsai C.L., Jang T.H., Wang L.H. Effects of mercury on serotonin concentration in the brain of tilapia, Oreochromis mossambicus.// Neurosci Lett., 1995, V. 194, № 3, pp.208-211.
4. Fingerman M., Jackson N. C. and Nagabhushanam R. Hormonally-regulated functions in crustaceans as biomarkers of environmental pollution.// Comparative Biochemistry and Physiology. Part C: Pharmacology, Toxicology and Endocrynology, 1998, V. 120, № 3, pp. 343-350.
5. Nepomuceno J.C., Ferrari I., Spano M.A., Centeno A.J. Detection of micronuclei in peripheral erythrocytes of Cyprinus carpio exposed to metallic mercury.// Environ. and Mol. Mutagenesis. 1997, V. 30, № 3, pp. 293-297.
6. Bickham J.W., Sandhu S., Herbert P.D.N., Chikhi L., Athwal R. Effects of chemical contaminants on genetic diversity in natural populations: implication for biomonitoring and ecotoxicology.// Mutation Res., 2000. V. 463, p. 33-51.
7. Мехтиев А.А. Обнаружение в головном мозге крыс белка, обладающего антиконсолидационными свойствами // Бюллетень экспер. биол. мед. 2000. т. 129, № 8, с. 147-150.
8. Гасанов Г.Г., Мехтиев А.А. Выявление серотонин-модулируемой белковой фракции и изучение её участия в организации поведения пассивного избегания // Бюллетень экспер. биол. мед., 1991, т. 112, № 7, с. 5-7.
9. Мехтиев А.А., Козырев С.А., Никитин В.П., Шерстнёв В.В. Избирательное влияние антител к белку SMP-69 на активность командных нейронов оборонительного поведения виноградных улиток // Российский физиол. журнал им. И.М.Сеченова, 2003, т. 89, № 4, с. 389-396.
10. Скоупс Р. Методы очистки белков. М., 1985, с. 173-178.
11. Paglin S., Delohery T., Erlandson R., Yahalom J. Radiation-induced micronuclei formation in human breast cancer cells: dependence on serum and cell cycle distribution // Biochem. Biophys. Res. Commun. 1997. V. 237, № 3, P. 678-684.
12. Kasuba V., Rozgaj R.. Micronucleus distribution in human peripheral blood lymphocytes treated in vitro with cadmium chloride in G0 and S phase of the cell cycle // Chemosphere. 2002. V. 49, № 1, P. 91-95.
13. Banasik A., Lankoff A., Piskulak A., Adamowska K., Lisowska H., Wojcik A. Aluminum-induced micronuclei and apoptosis in human peripheral-blood lymphocytes treated during different phases of the cell cycle // Environ. Toxicol. 2005. V. 20, № 4, P. 402-406.
14. Barziali A., Kennedy T.E., Sweatt J.D., Kandel E.R. 5-HT modulates protein synthesis and the supression of specific proteins during long-term facilitation in Aplysia sensory neurons.// Neuron. 1999, V. 2, p. 1577-1586.
15. Chen Sh., Zhang Q., Wu X, Schultz P.G., Ding Sh. Dedifferentiation of lineage-committed cells by a small molecule // J. Am. Chem. Soc. 2004. V. 126, № 2, p. 410-411.
16. Мехтиев А.А., Мовсум-заде С.К. Антимутагенная активность серотонинергической системы и подлежащие механизмы у молоди осетров (Acipenser gueldenstaedti persicus) и серебряных карасей (Carassius auratus).// Журнал эволюц. биохимии и физиологии. 2008, т. 44, № 5, c.476-481.







