Ключевые слова: грибы, лекарства, трансформация, хинолоны.
Keywords: fungi, drugs, transformation, quinolones.
Хинолоны являются объектами изучения многих лабораторий и применяются в клинической медицине против грамположительных и грамотрицательных бактерий [1]. Вместе с тем, к настоящему времени известно, что 4-хинолоны проявляют противоопухолевую, антивирусную (в отношении гепатита В, С, ВИЧ и вирусов герпеса), антиаллергическую, противотуберкулезную, иммуномодулирующую, противогипоксийную, антидиабетическую активности [2].
Выяснено, что действие хинолонов распространяется на разные виды малярийного плазмодия [3]. Различия в молекулярной структуре и активностихинолонов invitroсоставляют основу их классификации [4, 5].
Антимикробная активность первого поколенияхинолонов(например,налидиксовойкислоты [6],оксолиновой кислоты [7],циноксацина [8],пиромидиновой кислоты [9],пипемидиновой кислоты [10] и флумекина) была высокойв отношении аэробныхграмотрицательных бактерий, но не оченьвысокой в отношенииаэробныхграмположительных бактерий и анаэробных бактерий.В 1980 году появилосьвторое поколенияхинолонов [11], когда был синтезирован норфлоксацин [12]путем введения атомафторав положение6 молекулы 4-хинолонаи диаминопиперазинав положение7 [13].
Эти модификации позволили хинолонам обрестиантимикробную активностьв отношении аэробныхграмположительных бактерий, а также повысить ихактивность в отношенииграмотрицательных бактерий. Хинолонывторого поколениявключают в себя такие антибиотики, какципрофлоксацин [14], офлоксацин [15], эноксацин [16], флероксацин [17], ломефлоксацин [18], пефлоксацин [19]и руфлоксацин [20, 21].
Разработанные впоследствии хинолоны третьего поколения такие, как грепафлоксацин, гатифлоксацин, спарфлоксацин, энрофлоксацин, данофлоксацин и прадофлоксацинбылиэффективныв отношении грамположительныхбактерий, в частности, пневмококков и обладали высокой активностью в отношениианаэробных бактерий [21].
Четвертое поколение хинолонов (например, тровафлоксацин, клинафлоксацин, ситафлоксацин, моксифлоксацин и гемифлоксацин) обладаютвысокой активностьюв отношении анаэробови пневмококков [21, 20].
Привлечение микробных технологий в сферу модификации хинолонов позволит получить производные, обладающие новыми терапевтическими свойствами для лечения многих болезней, в том числе и малярии [3, 22]
1. Трансформация хинолонов первого поколения и их аналогов
Известно, что налидиксовая кислота обладает антималярийными свойствами [23, 3]. Была изучена трансформация налидиксовой кислоты (I) растущей культурой гриба Penicilliumadametzi 737. Через 24 часа наблюдалось образование гидроксиметилпроизводного (II) с выходом, достигающим 60 %, а его дальнейшее окисление приводило к образованию 3,7-дикарбоновой кислоты (III) [24]:
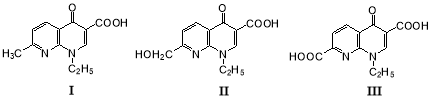
Представляет интерес микробная трансформация аналогов налидиксовой кислоты. В растущей культуре гриба P. adametzi АТСС 10407 наблюдалось преимущественное окисление метильной группы 3-карбокси-7-метил-1-этилхинолона-4 (IV) до гидроксиметильной (V), тогда как ароматические атомы углерода не затрагивались [25]:
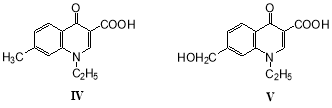
Аналогичная картина наблюдается при окислении различными микроорганизмами более сложного хинолона (VI), содержащего гидрированный цикл — 1-этил-4-оксо-1,4,6,7,8,9-гексагидробензо- [γ]-хинолин-3-карбоновой кислоты [25]:
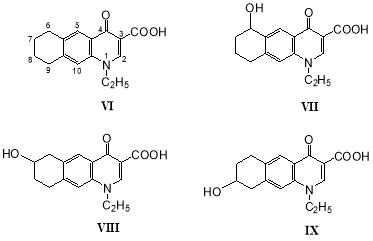
Гриб B. bassiana АТСС 7159 вводил гидроксильную группу в положение 6 соединения (VI) с образованием продукта трансформации (VII); гриб P. adametzi — в положения 7 и 8 с образованием продуктов трансформации (VIII и IX); клетки культуры Streptomycesachromogenes в положение 6, 7 и 8 с образованием продуктов трансформации (VII,VIII и IX) [25].
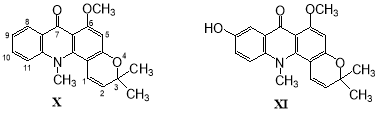
Известно, что аналоги акроницина (акридоны) обладают антималярийной активностью [26, 27]. При окислении акроницина (X) растущими культурами грибов рода Cunninghamella наблюдалось гидроксилирование бензольного кольца [28]. При этом наиболее активный штамм C. echinulataNRRL 3665 в течение 70 часов превращал исходное вещество в 9-гидроксиакроницин (XI) с выходом 30 % [28]:
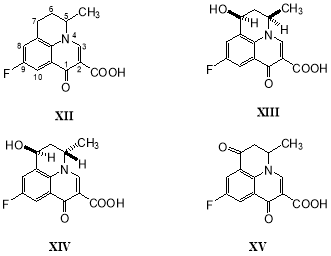
При трансформации флумекина (XII) растущей культурой гриба C. elegans в течение 7 суток наблюдалось образование диастереомеров 7-гидроксифлумекина (XIII, выход 23 %) и (XIV, выход 43 %), а также 7-оксофлумекина (XV, выход 11 %) [29]:
2. Трансформация хинолонов второго поколения
Известно, что появление норфлоксацина, положило начало новому (второму) поколению хинолонов [13]. Лабораторные испытания показали, что норфлоксацин обладает антималярийной активностью [3, 30].
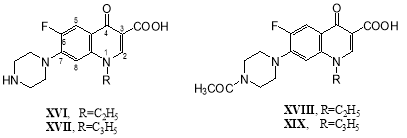
Некоторыми исследователями были описаны микробные превращения норфлоксацина (XVI) и ципрофлоксацина (XVII); например, при их трансформации растущей культурой Escherichiacoli наблюдалось образование N-ацетилнорфлоксацина (XVIII) и N-ацетилципрофлоксацина (XIX) [31–33]:
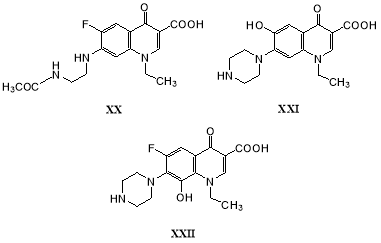
При трансформации норфлоксацина (XVI) растущей культурой Microbacteriumsp. 4N2–2 в течение 14 суток было обнаружено четыре метаболита: N-ацетилнорфлоксацин (XVIII), продукт элиминирования этилена изN-ацетилнорфлоксацина (XX), а также два гидроксипроизводных — 6-гидроксинорфлоксацин (XXI) и 8-гидроксинорфлоксацин (XXII) [34]:
Ципрофлоксацин (XVII) известен своими антималярийными свойствами [35], поэтому внимание исследователей привлекают новые способы получения производных этого лекарства.
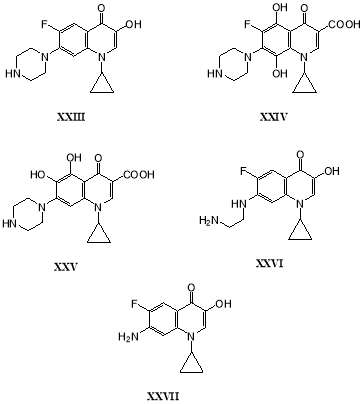
Трансформация ципрофлоксацина (XVII) в течение 90 часов грибом Gloeophyllumstriatum показала образование 11 метаболитов. Основными продуктами процесса являлись моногидроксилированные производные: 3-гидроксиципрофлоксацин (XXIII), 6- и 8-гидроксипроизводные (аналогичные гидроксипроизводным XXI и XXII норфлоксацина); дигидроксилированные производные: XXIV и XXV; продукт элиминирования этилена из пиперазинового кольца (XXVI) и продукт деградации пиперазинового кольца — 7-аминоципрофлоксацин (XXVII) [36]:
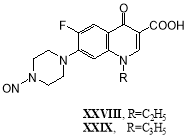
Трансформация норфлоксацина (XVI) [37] и ципрофлоксацина (XVII) [38] растущей культурой Mycobacteriumglivum приводила к образованию ацетилированных продуктов XVIII и XIX, а также N-нитрозонорфлоксацина (XXVIII) и N-нитрозоципрофлоксацина (XXIX):
3. Трансформация хинолонов третьего поколения
Хинолоны третьего поколения такие, как энрофлоксацин [39], сарафлоксацин [40, 41], данофлоксацин [42], прадофлоксацин [43], также представляют интерес с точки зрения их модификации путем введения дополнительных функциональных групп с помощью микробиологического синтеза.
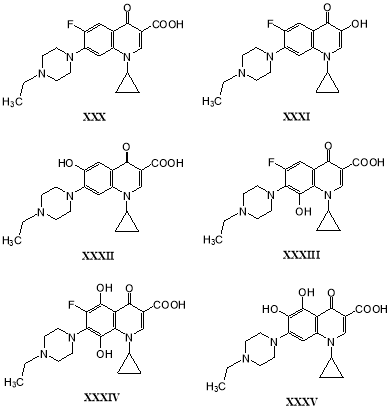
При трансформации энрофлоксацина (XXX) в течение 7 дней грибом G. striatum было выделены 11 метаболитов. Наибольший интерес для дальнейшего органического синтеза представляли гидроксипроизводные (XXXI-XXXV) [44]:
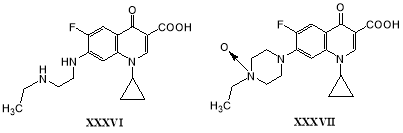
Два других полученных метаболита являются типичными для процессов микробного окисления фторхинолонов: продукт элиминирования этилена из энрофлоксацина (XXXVI) и 7-аминоципрофлоксацин производное (XXVII) [44].
В более поздних работах помимо большого количества метаболитов была описана N-окись энрофлоксацина (XXXVII) — еще один типичный метаболит, полученный при окислении энрофлоксацина грибом G. striatum [44–46]:
В результате трансформации энрофлоксацина грибом MucorramannianusATCCMYA-883 [32, 47, 48] в течение 21 дня были выделены три продукта: продукт элиминирования этилена из энрофлоксацина (XXXVI, выход 3,5 %), N-окись энрофлоксацина (XXXVII, выход 62,0 %) и N-ацетилципрофлоксацин (XIX, выход 8,0 %) [47, 48].
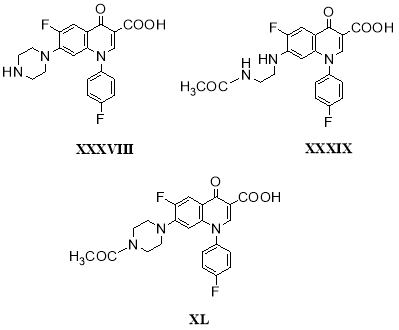
Сарафлоксацин (XXXVIII) используется как антибактериальный агент на птицефермах [49, 41] и в разведении водных биоресурсов (аквакультура) [50]. Была изучена трансформация сарафлоксацина в растущей культуре гриба M. ramannianusATCCMYA-883. В течение 18 дней наблюдалось образование двух метаболитов: продукт элиминирования этилена из сарафлоксацина (XXXIX, выход 26,0 %) и N-ацетилсарафлоксацин (XL, выход 15,0 %) [51, 52]:
При трансформации данофлоксацина (XLI) культурами Mycobacterium smegmatis UI AM-563 и Pseudomonas fluorescens UI AM-670 было выделено два метаболита — N-деметилданофлоксацин (XLII) и 7-аминоданофлоксацин производное (XLIII) [53]:
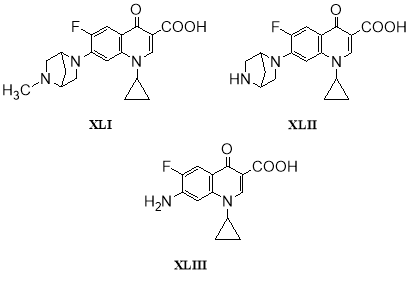
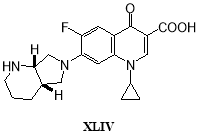
Была изучена трансформация прадофлоксацина (XLIV) растущей культурой гриба G. striatumDSM 9592 [54]:
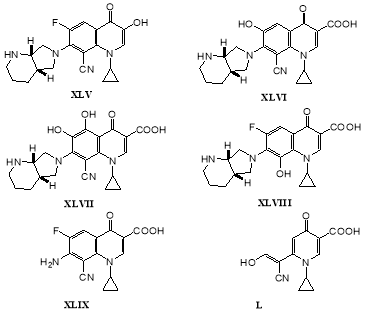
В результате было выделено шесть основных метаболитов: 3-гидрокси-8-циано-прадофлоксацин (XLV, выход 3,0 %), 6-гидрокси-8-циано-прадофлоксацин (XLVI, выход 9.0 %), 5,6-дигидрокси-8-циано-прадофлоксацин (XLVII, выход 3,0 %), 8-гидрокси-прадофлоксацин (XLVIII, выход 1,0 %), аминопроизводное (XLIX, выход 1,0 %) и 6- [(E/Z)-1-циано-2-гидроксиэтенил]-1-циклопропил-4-оксо-1,4-дигидро-3-пиридинкарбоновая кислота (L, выход 1,0 %) [54]:
4. Трансформация хинолонов четвертого поколения
В литературе не так много сведений о микробных превращениях хинолонов четвертого поколения.
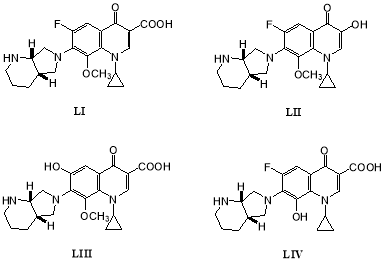
В процессе микробного окисления моксифлоксацина (LI) в течение 3 суток грибом G. striatumDSM 9592 было выделено несколько метаболитов, среди них — 3-гидроксипроизводное (LII), 6-гидроксимоксифлоксацин (LIII), а также деметилированное производное (LIV) [55]:
Заключение
Хинолоны широко используются в медицинской практике. Однако, проблема возникновения устойчивых к антибиотикам штаммов патогенных микроорганизмов остается неизменной. Модификация химической структуры хинолонов позволяет решать эти вопросы. Производные полученные методами микробной химии [56–59, 60, 61] могут оказаться полезными в синтезе новых поколений лекарственных средств.
Литература:
- Owens R. C., Ambrose P. G. Clinical use of the fluoroquinolones. // Med. Clin. North Am. 2000. V.84. P.1447–1469.
- Boteva A. A., Krasnykh O. P. The methods of synthesis, modification, and biological activity of 4-quinolones (review). // Chem. Heterocycl. Compds. 2009. V. 45. N 7. P.757–785.
- Mahmoudi N.,Ciceron L., Franetich J-F., Farhati K., Silvie O., Eling W., Sauerwein R., Danis M., Mazier D., Derouin F. In vitro activities of 25 quinolones and fluoroquinolones against liver and blood stage Plasmodium spp. // Antimicrob. Agents Chemother. 2003. V. 47. N 8. P.2636–2639.
- Ball P. The quinolones: history and overview. In: The Quinolones, 3rd ed. (Andriole V. T., ed.) San Diego: Academic Press, 2000. P.1–31.
- Oliphant C. M., Green G. M. Quinolones: a comprehensive review. // Am. Fam. Physician. 2002. V. 65. N 3. P.455–464.
- Lesher G. Y., Froelich E. J., Gruett M. D., Bailey J. H., Brundage R. P. 1,8-Naphthyridine derivatives. A new class of chemotherapeutic agents. // J. Med. Chem. 1962. N 5. P.1063–1065.
- Pianotti R. S., MohanR.R., Schwartz B. S. Biochemical effects of oxolinic acid on proteus vulgaris. // J. Bacteriol. 1968. V.95. N 5. P.1622–1626.
- Giamarellou H., Jackson G. G. Antibacterial activity of cinoxacin in vitro. // Antimicrob. Agents Chemother. 1975. V.7. N 5. P.688–692.
- Shimizu M., Takase Y., Nakamura S., Katae H., Minami A., Nakata K., Inoue S., Ishiyama M., Kubo Y. Pipemidic acid, a new antibacterial agent active against Pseudomonas aeruginosa: in vitro properties. // Antimicrob. Agents Chemother. 1975. V.8. N 2. P.132–138.
- Sun H., Li L., Su M. Simultaneous determination of proline and pipemidic acid in human urine by capillary electrophoresis with electrochemiluminescence detection. // J. Clin. Lab. Anal. 2010. V.24. N 5. P.327–333.
- Appelbaum P. C., Hunter P. A. The fluoroquinolone antibacterials: past, present and future perspectives. // Int. J. Antimicrob. Agents. 2000. V.16 P.5–15.
- Wise R. Norfloxacin — a review of pharmacology and tissue penetration. // J. Antimicrob. Chemother. 1984. V.13. Suppl. B. P.59–64.
- Brighty K. E., Gootz T. D. Chemistry and mechanism of action of the quinolone antibacterials: the quinolones. — 3-rd ed. — San Diego: Academic press, 2000. — P. 33–97.
- Green S., Tillotson G. Use of ciprofloxacin in developing countries. // Pediatr. Infect. Dis. J. 1997. V.16. N 1. P.150–159.
- Crumplin G. C., Odell M. Development of resistance to ofloxacin. // Drugs. 1987. V.34. Suppl. 1. P.1–8.
- Mukherjee P., Mandal E. R., Das S. K. Evaluation of antiproliferative activity of enoxacin on a human breast cancer cell line. // Int. J. Hum. Genet. 2005. V.5. N 1. P.57–63.
- Balfour J. A., Todd P. A., Peters D. H. Fleroxacin. A review of its pharmacology and therapeutic efficacy in various infections. // Drugs. 1995. V.49. N 5. P.794–850.
- Sultana N., Arayne M. S., Furqan H. In vitro availability of lomefloxacin hydrochloride in presence of essential and trace elements. // Pak. J. Pharm. Sci. 2005. V.18. N 3. P.59–65.
- Jones R. N. Antimicrobial activity and interaction of pefloxacin and its principal metabolites. Collaborative Antimicrobial Susceptibility Testing Group. // Eur. J. Clin. Microbiol. Infect. Dis. 1989. V.8. N 6. P.551–556.
- Andersson M. I., MacGowan A. P. Development of the quinolones. // J. Antimicrob. Chemother. 2003. V.51. Suppl. S1. P.1–11.
- Andriole V. T. The quinolones: prospects: the quinolones. — San Diego: Academic press, 2000. — 517 P.
- Parshikov I. A., Woodling K. A., Sutherland J. B. Biotransformations of organic compounds mediated by cultures of Aspergillus niger. Appl. Microbiol. Biotecnol. 2015. V.99. N 17. P. 6971–6986. http://dx.doi.org/10.1007/s00253–015–6765–0
- Divo A. A., Sartorelli A. C., Patton C. L., Bia F. J. Activity of fluoroquinolone antibiotics against Plasmodium falciparumin vitro. // Antimicrob. Agents Chemother. 1988. V.32. N 8. P.1182–1186.
- Hamilton P. B., Rosi D., Peruzzotti G. P., Nielson E. D. Microbiological metabolism of naphthyridines. // Appl. Microbiol. 1969. V.17. N 2. P.237–241.
- Kieslich K., Wieglepp H., Hoyer G.-A., Rosenberg D. Mikrobiologische Umwandlungen nichtsteroider Strukturen, V. Mikrobiologische Reaktionen von substituierten 1-Äthyl-4-oxo-1,4-dihydrochinolin-3-carbonsäuren. // Chem. Ber. 1973. Bd. 106. N 8. P.2636 2642.
- Fujioka H., Nishiyama Y., Furukawa H., Kumada N. In vitro and in vivo activities of atalaphillinine and related acridone alkaloids against rodent malaria. // Antimicrob. Agents Chemother. 1989. V.33. P.6–9.
- Hari G. S., Lee Y. R., Wang X., Lyoo W. S., Kim S. H. New synthetic routes to acronycine, noracronycine, and their analogues. // Bull. Korean Chem. Soc. 2010. V.31. N 8. P.2406–2409.
- Betts R. E., Walters D. E., Rosassa J. Microbial transformations of antitumor compounds. 1. Conversion of acronycine to 9-hydroxyacronycine by Cunninghamella echinulata. // J. Med. Chem. 1974. V.17. N 6. P.599–602.
- Williams A. J., Deck J. D., Freeman J. P., Chiarelli M. P., Adjei T. M., Heinze T. M., Sutherland J. B. Biotransformation of flumequine by the fungus Cunninghamella elegans. // Chemosphere. 2007. V.67. P.240–243.
- Sarma P. S. Norfloxacin: a new drug in the treatment of falciparum malaria. // Ann. Intern. Med. 1989. V.111. P.336–337.
- Parshikov I. A., Freeman J. P., Lay J. O. Jr., Beger R. D., Williams A. J., Sutherland J. B. Regioselective transformation of ciprofloxacin to N-acetylciprofloxacin by the fungus Mucor ramannianus. FEMS Microbiol. Lett., 1999, v. 177, P. 131–135. http://dx.doi.org/10.1111/j.1574–6968.1999.tb13723.x
- Parshikov I. A., Sutherland J. B. Original Strain of Umbelopsis ramanniana R-56 in ATCC. 2015. Dataset: ResearchGate http://dx.doi.org/10.13140/RG.2.1.4445.6167
- Jung C. M., Heinze T. M., Strakosha R., Elkins C. A., Sutherland J. B. Acetylation of fluoroquinolone antimicrobial agents by an Escherichia coli strain isolated from a municipal waste water treatment plant. // J. Appl. Microbiol. 2009. V.106. P.564–571.
- Kim D.-W., Heinze T. M., Kim B.-S., Schnackenberg L. K., Woodling K. A., Sutherland J. B. Modification of norfloxacin by a Microbacterium sp. strain isolated from a waste water treatment plant. // Appl. Environ. Microbiol. 2011. V.77. N 17. P.6100–6108.
- Watt G., Shanks G. D., Edstein M. D., Pavanand K., Webster H. K., Wechgritaya S. Ciprofloxacin treatment of drug-resistant falciparum malaria. // J. Infect. Dis. 1991. V.164. P.602–604.
- Wetzstein H.-G., Stadler M., Tichy H.-V., Dalhoff A., Karl W. Degradation of ciprofloxacin by basidiomycetes and identification of metabolites generated by the brown rot fungus Gloeophyllum striatum. // Appl. Environ. Microbiol. 1999. V.65. N 4. P.1556–1563.
- Adjei M. D., Heinze T. M., Deck J., Freeman J. P., Williams A. J. Sutherland J. B. Transformation of the antibacterial agent norfloxacin by environmental mycobacteria. // Appl. Environ. Microbiol. 2006. V.72. N 9. P.5790–5793.
- Adjei M. D., Heinze T. M., Deck J., Freeman J. P., Williams. A.J., Sutherland J. B. Acetylation and nitrosation of ciprofloxacin by environmental strain of mycobacteria. // Can. J. Microbiol. 2007. V.53. P.144–147.
- Sellyei B., Varga Z., Szentesi-Samu K., Kaszanyitzky E., Magyar T. Antimicrobial susceptibility of Pasteurella multocida isolated from swine and poultry. // Acta Vet Hung. 2009. V.57. N 3. P.357–367.
- Edens F. W., Qureshi R. A., Parkhurst C. R., Qureshi M. A., Havenstein G. B., Casas I. A. Characterization of two Escherichia coli isolates associated with poult enteritis and mortality syndrome. // Poult, Sci. 1997. V.76. P.1665–1673.
- Abd El-Ghany W. A., Madian K. Control of experimental colisepticaemia in broiler chickens using sarafloxacin. // Life Sci. J. 2011. V.8. N 3. P.318–328.
- Sappal R., Chaudhary R. K., Sandhu H. S., Sidhu P. K. Pharmacokinetics, urinary excretion and plasma protein binding of danofloxacin following intravenous administration in buffalo calves (Bubalus bubalis). // Vet. Res. Commun. 2009. V.33. N 7. P.659–667.
- Wetzstein H.-G. Comparative mutant prevention concentrations of pradofloxacin and other veterinary fluoroquinolones indicate differing potentials in preventing selection of resistance. // Antimicrob. Agents Chemother. 2005. V.49. N 10. P.4166–4173.
- Wetzstein H.-G., Schmeer N., Karl W. Degradation of the fluoroquinolone enrofloxacin by the brown rot fungus Gloeophyllum striatum: identification of metabolites. // Appl. Environ. Microbiol. 1997. V.63. N 11. P.4272–4281.
- Wetzstein H.-G., Schneider J., Karl W. Patterns of metabolites produced from the fluoroquinolone enrofloxacin by basidiomycetes indigenous to agricultural sites. // Appl. Microbiol. Biotechnol. 2006. V.71. P.90–100.
- Karl W., Schneider J., Wetzstein H.-G. Outlines of an “exploding” network of metabolites generated from the fluoroquinolone enrofloxacin by the brown rot fungus Gloeophyllum striatum // Appl. Microbiol. Biotechnol. 2006. V.71. P.101–113.
- Parshikov I. A., Freeman J. P., Lay J. O. Jr., Beger R. D., Williams A. J., Sutherland J. B. Microbiological transformation of enrofloxacin by the fungus Mucor ramannianus. 100th General Meeting of American Society for Microbiology, Los Angeles, California, May 21–25, 2000, Q-180.
- Parshikov I. A., Freeman J. P., Lay J. O., Beger R. D., Williams A. J., Sutherland J. B. Microbiological transformation of enrofloxacin by the fungus Mucor ramannianus. Applied and Environmental Microbiology. 2000. V. 66. N 6. P.2664–2667.
- Jones R. N., Erwin M. E. In vitro susceptibility testing and quality control parameters for sarafloxacin (A-56620): a fluoroquinolone used for treatment and control of colibacillosis in poultry. // Diagn. Microbiol. Infect. Dis. 1998. V. 32. P.55–64.
- Martinsen B., Horsberg T. E. Comparative single-dose pharmacokinetics of four quinolones, oxolinic acid, flumequine, sarafloxacin, and enrofloxacin, in Atlantic salmon (Salmo salar) held in seawater at 10°C. // Antimicrob. Agents Chemother. 1995. V. 39. P.1059–1064.
- Parshikov I. A., Freeman J. P., Lay J. O. Jr., Moody J. D., Williams A. J., Beger R. D., Sutherland J. B. Metabolism of the veterinary fluoroquinolone sarafloxacin by the fungus Mucor ramannianus. 100th General Meeting of American Society for Microbiology, Los Angeles, California, May 21–25, 2000, Q-182.
- Parshikov I. A., Freeman J. P., Lay J. O. Jr., Moody J. D., Williams A. J., Beger R. D., Sutherland J. B. Metabolism of the veterinary fluoroquinolone sarafloxacin by the fungus Mucor ramannianus. Journal of Industrial Microbiology and Biotechnology. 2001. V. 26. P.140–144.
- Chen Y., Rosazza J. P. N., Reese C. P., Chang H.-Y., Nowakowski M. A., Kiplinger J. P. Microbial models of soil metabolism: biotransformations of danofloxacin. // J. Ind. Microbiol. Biotechnol. 1997. V.19. P.378–384.
- Wetzstein H.-G., Schneider J., Karl W. Metabolite proving fungal cleavage of the aromati core part of a fluoroquinolone antibiotic. // AMB Express 2012. V. 2. N 3. http://dx.doi.org/10.1186/2191–0855–2-3
- Wetzstein H.-G., Dalhoff A., Karl W. BAY 12–8039. A new 8-methoxyquinolone, is degraded by the brown rot fungus Gloephyllum stratum. // 37th Interscience conference on antimicrobial Agents and Chemiterapy (Toronto, Sept., 28 -Oct., 01, 1997). — Toronto, Canada, 1997. — Abstract F 157. P.172.
- Parshikov I. A. Microbial conversions of nitrogenous heterocycles. 2015. M.: Editus, 130 p. (ISBN: 978–5-00058–198–8) http://dx.doi.org/10.5281/zenodo.28313
- Parshikov I. A., Sutherland J. B. Biotransformation of steroids and flavonoids by cultures of Aspergillus niger. Applied Biochemistry and Biotechnology. 2015. V.176. N 3. P. 903–923. http://dx.doi.org/10.1007/s12010–015–1619-x
- Parshikov I. A., Sutherland J. B. The use of Aspergillus niger cultures for biotransformation of terpenoids. // Process Biochemistry. 2014. V.49. N 12. P. 2086–2100. http://dx.doi.org/10.1016/j.procbio.2014.09.005
- Parshikov I. A., Terent'ev P. B., Modyanova L. V. Microbiological Transformations of Nitrogen-Containing Heterocycles. Cheminform. 2010, v.26, N 30, http://dx.doi.org/10.1002/chin.199530292
- Modyanova L. V., Duduchava M. R., Piskunkova N. F., Grishina G. V., Terent'ev P. B., Parshikov I. A. Microbiological Transformation of Piperidine and Pyridine Derivatives. // Cheminform. 2010. V.31, N 12. http://dx.doi.org/10.1002/chin.200012047
- Parshikov I. A., Terent'ev P. B., Piskunkova N. F., Gracheva R. A., Bulakhov G. A. Microbial Transformation of 4-Phenylpyrrolidone-2 Derivatives by Micellar Fungi. // Cheminform. 2010. V. 29. N 1. http://dx.doi.org/10.1002/chin.199801032







